阴沟肠杆菌产β-内酰胺酶和质粒介导耐药基因的检测及耐药性分析
2019-03-29王勇王雪芬卜劲松章旺徐丁
王勇 王雪芬 卜劲松 章旺 徐丁
作者单位:312300 浙江省绍兴市上虞人民医院
阴沟肠杆菌是医院感染常见的条件致病菌之一,因抗菌药物的长期不合理应用,常对多种抗菌药物耐药,造成临床治疗困难。其耐药机制主要包括产生超广谱β-内酰胺酶(ESBLs)、产AmpCβ-内酰胺酶(AmpC)、喹诺酮类(qnr)基因介导耐药、整合子、主动外排泵系统作用、药物作用靶位的改变、外膜通透性改变等[1]。本实验通过对阴沟肠杆菌产酶及耐药基因检测进行研究,旨在为指导临床合理选用抗生素及控制耐药菌株在医院内的传播提供理论依据。
1 资料与方法
1.1 菌株来源 收集本院临床分离去除同一病例同一部位的阴沟肠杆菌共89株。菌株采用法国生物梅里埃公司的VITEK-2 Compact进行鉴定。质控菌株大肠埃希菌ATCC25922、肺炎克雷伯菌ATCC700603购自中国食品药品检定研究院。
1.2 仪器与试剂 药敏纸片:亚胺培南(IPM,10μg/片)、头孢他啶(CAZ,30μg/片)、头孢吡肟(FEP,30μg/片)、头孢噻肟(CTX,30μg/片)、头孢西丁(FOX,30μg/片)、头孢噻肟/克拉维酸(CTX/CA,30/10μg/片)和头孢他啶/克拉维酸(CAZ/CA,30/10μg/片)均购自英国OXOID公司。细菌质粒DNA提取试剂盒购自北京天根。引物参考李美[2]的文献由上海Invitrogen公司合成,PCR扩增仪和凝胶成像分析系统为美国BIO-RAD公司产品。
1.3 方法 (1)阴沟肠杆菌产不同表型ESBLs酶和AmpC的检测:依据明德松[3]建立的多底物协同-拮抗法(MSSAT),一步检测出产ESBLs、不同型AmpC酶及二者不同组合产酶情况。(2)阴沟肠杆菌耐药基因检测:按照质粒提取试剂盒的操作步骤提取阴沟肠杆菌质粒DNA,采用PCR法扩增ESBLs基因(TEM-1、SHV-12、SFO-1、VEB-3、CTX-M)、AmpC酶基因(ACT-1、DHA-1)和qnr基因(qnrA、qnrB、qnrS)。煮沸法制备PCR模板,反应体系为:总体积均为50μl:ddH2O 25μl、Premix ExTaq 20μl、10μmmoL/L上、下游引物各1.5μl、模板DNA 2μl。热循环参数:94℃预变性5 min,94℃变性50s,SHV-12 53℃退火 50s;CTX-M 55℃退火 50s;VEB-3、qnrB 56℃退火 50s;TEM-1、SFO-1、DHA-1、qnrA、qnrS 57℃退火50s;ACT-1 59℃退火50s;30个循环后,72℃最后延伸10min。PCR 扩增产物经2%琼脂糖凝胶电泳后观察结果,抽取各阳性标本PCR扩增产物送上海Invitrogen 公司进行测序,应用GenBank在线数据库对比工具BLAST进行序列比对分析。
2 结果
2.1 阴沟肠杆菌对14种抗生素的耐药率 89株阴沟肠杆菌对14种常见抗菌药物的药敏试验结果,见表1。
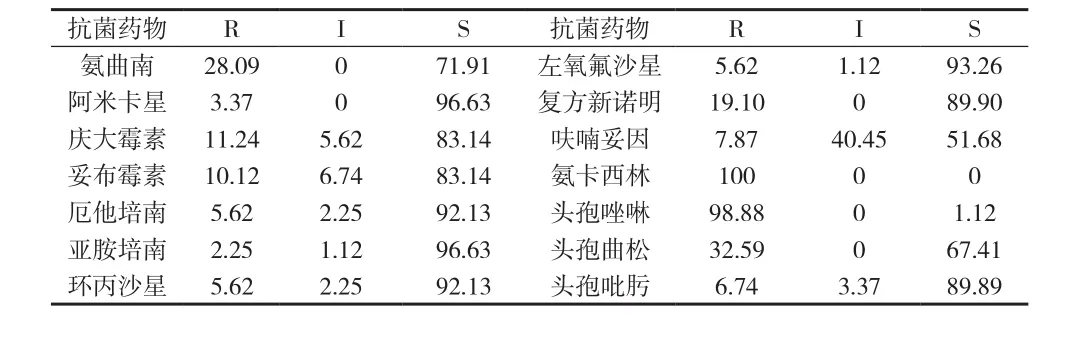
表1 阴沟肠杆菌对14种抗生素的耐药率(%)
2.2 阴沟肠杆菌ESBLs和AmpC酶表型检测结果 89株阴沟肠杆菌中,单产ESBLs13株(14.61%,13/89),单产AmpC酶41株(46.07%,41/89),同时产ESBLs和 AmpC酶 24株(26.97%,24/89), 不 产 酶 11株(12.36%,11/89)。
2.3 阴沟肠杆菌质粒介导耐药基因检测结果 (1)β-内酰胺酶基因检测结果:89株阴沟肠杆菌共测出43株携带β-内酰胺酶基因,其中含一种β-内酰胺酶基因的有18株,其余25株均含两种或两种以上β-内酰胺酶基因。43株β-内酰胺酶基因检出菌中,ESBLs基因检出率为38.20%(34/89),AmpC酶基因检出率为19.10%(17/89),见表2。(2)qnr基因检测结果:89株阴沟肠杆菌检出qnr基因阳性有11株(12.36%,11/89),其中5株(5.62%,5/89)qnrA基因阳性;4株(4.49%,4/89)qnrB基因阳性;2株(2.25%,2/89)qnrS基因阳性。(3)β-内酰胺酶表型与基因型检测结果:通过MSSAT法检测出的37株ESBLs表型阳性菌中有30株携带ESBLs耐药基因;65株AmpC酶表型阳性菌中有15株携带AmpC酶耐药基因。
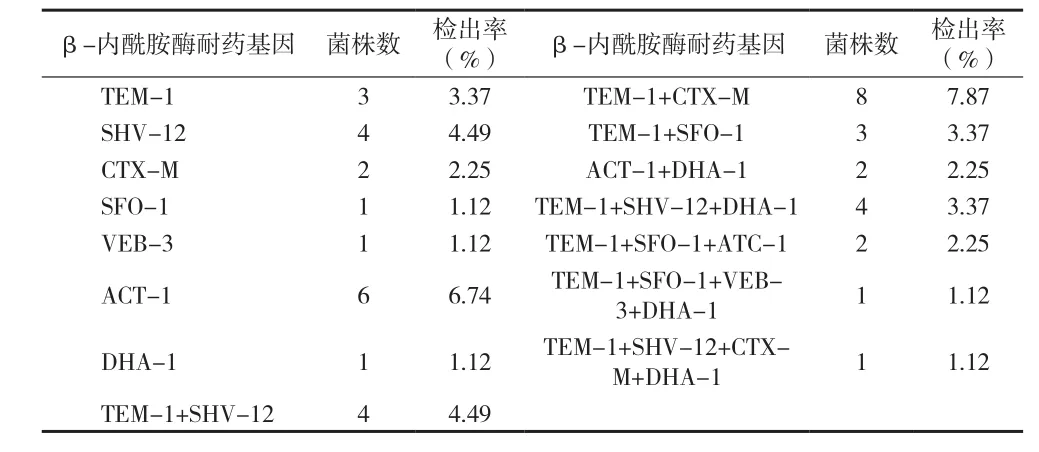
表2 89株阴沟肠杆菌中β-内酰胺酶基因的分布情况
3 讨论
研究显示,钝化酶或灭活酶的产生、质粒和整合子等可移动基因元件参与的耐药、qnr基因介导的耐药、外膜通透性下降、主动外排泵增强、生物被膜的形成等是引起阴沟肠杆菌耐药的主要机制,其中以细菌产β-内酰胺酶所占的比重较大[4]。近年来,因为广谱抗生素的广泛使用,阴沟肠杆菌对抗菌药物的耐药性不断增强,其多重耐药(MDR)甚至泛耐药(PDR)不断被发现。本资料药敏试验结果显示,阴沟肠杆菌对青霉素类(氨卡西林)、一代头孢(头孢唑啉)耐药率最高,对碳青霉烯类(亚胺培南、厄他培南)、氨基糖苷类(阿米卡星)、喹诺酮类(左氧氟沙星、环丙沙星)、四代头孢(头孢吡肟)药物耐药率较低,整体耐药情况尚好,未发现较严重的抗菌药物耐药现象,说明本院对临床抗生素的合理使用、规范管理工作较好,杜绝了由于完全经验用药、滥用药物而造成的细菌耐药率提高。
有研究发现,ESBLs和AmpC 酶是阴沟肠杆菌对β-内酰胺类药物产生耐药的主要机制[5]。ESBLs主要由质粒介导,能水解广谱青霉素、单环类抗生素、β-内酰胺酶及第三代头孢类,但对碳青霉烯类、头霉素及酶抑制剂敏感。AmpC 酶主要由染色体介导,属Ambler分类中C类酶,Bush分类中I类酶,其水解底物比ESBLs更广泛,可水解多种三代头孢菌素类抗菌药,且不受酶抑制剂所抑制,极易造成续发耐药[6]。作者采用MSSAT法一步同时检测ESBLs、AmpC酶的不同表型,其结果显示,89株阴沟肠杆菌中,单产AmpC酶占46.07%,同时产ESBLs和AmpC酶占26.97%,低于杨洪芬[7]的52.87%,31.03%,高于吴财铭[8]的40.2%,17.1%、苏国娟[9]的19.74%,14.47%。PCR结果显示,ESBLs基因检出率为38.20%,以TEM-1型为主,低于李美[2]的57.47%,高于王凤霞[10]的15.79%,且均以TEM-1型为主;AmpC酶基因检出率为19.10%,均低于上述报道。以上结果,一方面说明阴沟肠杆菌产ESBLs酶和AmpC酶的情况在不同地区、不同医院间存在显著差异,而产生这些差异的原因多样化,比如和细菌存活环境、医院用药习惯、患者感染情况、医院感染、消毒措施等有关;另一方面可能与相互之间检测的基因类型不同有一定的关系。同时,通过对β-内酰胺酶的表型、基因型检测结果的比较发现,在37株ESBLs阳性菌中有30株携带ESBLs基因,未检测出的7株菌株所携带ESBLs基因可能是本试验未检测的;同时有4株菌检测出ESBLs基因型呈阳性而表型却呈阴性,这可能是因为细菌酶产量低致使MSSAT法无法检测出或者作者采用的MSSAT法是一步检测ESBLs和AmpC酶,药物纸片之间可能存在一定的干扰而影响到检出,需要后续研究进一步探讨。在65株AmpC酶阳性菌中仅有15株检测到质粒型AmpC酶基因,大部分AmpC酶基因未检测到的原因一方面可能与作者检测的是质粒型的AmpC酶基因,而AmpC酶只有少部分由质粒介导有关,另一方面也可能因为本试验未检测的AmpC酶基因型的存在;另外有2株菌AmpC酶基因型呈阳性而表型呈阴性,也可能与待检菌产酶量低有关。
近年发现,质粒上携带的qnr基因可介导喹诺酮类药物的耐药。qnr基因的作用机制为表达细菌DNA解旋酶保护蛋白,从而拮抗喹诺酮类药物的作用,而喹诺酮类药物正是通过作用于解旋酶而达到杀菌的作用[11]。质粒介导的qnr基因具有水平传播性,可以跨种传播,导致耐药扩散。本实验共检测出质粒介导qnr基因阳性菌株11株,qnrA、qnrB、qnrS基因检出率分别为5.62%、4.49%、2.25%,均低于李美[2]、张伟红[12]等的报道,这可能和每个地区临床抗菌药物使用习惯等有关。在实验中作者发现携带qnr基因的菌株均呈MDR现象,其对14种抗菌药物的耐药率高达75%以上。考虑这是因为在qnr基因存在时,发生不同喹诺酮类耐药机制的累加效应,被认为对抗菌药物低水平耐药能使细菌在次级突变出现的基础上达到高水平耐药[13]。同时,在11株qnr基因阳性菌株中,在产ESBLs和(或)AmpC酶菌株中检出的有9株,说明qnr基因主要存在于产ESBLs和(或)AmpC 酶的菌株中,且其和细菌的多MDR有较大的关联。
综上所述,阴沟肠杆菌耐药机制复杂,抗耐药形势严峻。在临床抗感染治疗中,应考虑产ESBLs和AmpC酶阴沟肠杆菌有可能存在的MDR问题,同时对qnr基因介导的喹诺酮类药物耐药也应引起足够的重视。医院应规范抗菌药物的使用和管理,严格按照药敏试验结果合理使用抗菌药物,同时加强临床耐药菌株监测,避免经验用药、滥用药物导致耐药菌株产生。
