多糖结构修饰研究进展
2019-03-28,,,*
, ,,*
(1.贵州师范大学,贵州省山地环境信息系统与生态环境保护重点实验室,贵州贵阳 550001; 2.贵州师范大学,贵州省药物质量控制及评价技术工程实验室,贵州贵阳 550001; 3.贵州师范大学,天然药物质量控制中心,贵州贵阳 550001)
多糖(Polysaccharide)是由10个及以上的单糖通过糖苷键连接缩合而成的多羟基醛酮类高分子聚合物[1],广泛存在于动植物及微生物等有机体的细胞膜和细胞壁中,它不仅参与了细胞识别、生长、分化、代谢、胚胎发育、病毒感染、癌变、免疫应答等各种生命活动,还具有结构支持、能量储存、防御等多方面的生理功能,是构成生命的四大基本物质之一[2]。大量研究表明,多糖具有多种生物活性,包括抗肿瘤、抗病毒、抗凝血、抗氧化、降血糖及免疫调节作用等活性;因此,关于多糖的研究日趋活跃起来。目前,多糖的生物活性、结构解析及构效关系已成为多糖研究的重点,也是医药学领域与食品保健行业共同关注的焦点。
尽管多糖被证实具有多种生物活性,但在研究过程中也陆续发现以下问题:自然界中并非所有的多糖都具有活性,例如,从桑白皮中分离出的多糖(CMA-a-1与CMA-b1-1),尽管来自同一植物体内,但多糖CMA-a-1却不具有多糖CMA-b1-1所具有的抗肝癌活性[3];某些多糖会因受自身结构或理化性质的影响导致其生物活性难以发挥出来,例如,从密花石斛中提取出的密花石斛多糖,由于分子量太大导致其无法通过细胞膜障碍进入细胞发挥生物学效应[4],一种条斑紫菜多糖也因其分子量过大而不利于对胃癌细胞的抑制[5];某些从天然生物中分离出的多糖生物活性较弱,难以达到应用标准,需采取方法增强其生物活性;某些多糖虽然药效不错,但同时也产生一些不良反应,如某些硫酸化多糖因硫酸基过多而产生其它毒副作用[6]。
大量研究证明,多糖的生物活性或药理性质直接或间接地受其分子结构的影响[7-8]。因此,为了解决以上问题,采取适宜的方法对多糖进行结构修饰以增强多糖的生物活性具有重要意义,对多糖进行结构修饰也已成为近年来国内外多糖领域研究的重点之一,它是研究多糖构效关系,探寻多糖生物活性根源的重要手段。
多糖的结构修饰主要是通过化学、物理学及生物学等手段对多糖分子结构进行修饰,通过改变多糖的分子结构、分子量、粘度及取代基的种类、位置及数量以实现其理化性质的改变、生物活性的增强甚至获得新的生物活性多糖衍生物等。据目前的研究报道来看,多糖结构修饰的研究已取得了较大进展,其修饰方法主要分为化学方法、物理方法及生物方法,其中对多糖结构利用化学法进行化学修饰是多糖结构修饰中研究报道最多,应用范围最广的方法。本文以这三大方法为主线,化学修饰法为介绍重点,对近年来国内外多糖结构修饰研究进展进行综述,为多糖结构修饰的深入研究与探索及糖类产品的开发与利用提供一定的参考。
1 化学修饰方法
对多糖结构进行化学修饰是当前多糖领域研究的重点之一。此方法通过对多糖残基上的羟基、羧基、氨基等基团进行化学修饰,引入如硫酸基、羧甲基、烷基等不同种类的新基团以改变其空间结构、分子量数量等来增强其生物活性。化学修饰的方法多种多样,目前常用的方法有硫酸化、羧甲基化、乙酰化、硒化、磺酰化、磷酸化、双基团衍生化等。
1.1 硫酸化修饰
硫酸化修饰是多糖化学结构修饰最常用的方法之一。早在1987年,Nakashima等[9]就发现了天然海洋硫酸化多糖卡拉胶具有显著的抗HIV活性,后来Nakashima等[10]又相继报道了卡拉胶具有抑制单疱疹病毒复制的作用,至此硫酸化多糖逐渐引起了广大科技研究者的关注;1988年,日本科学研究者Mizumoto等[11]首次成功在某些均多糖结构中引入硫酸基团后发现,此硫酸化多糖呈现出抗T-淋巴细胞病毒的活性,这一发现为日后硫酸化成为多糖化学结构修饰的重要方向之一奠定了基础。
1.1.1 原理及修饰方法
1.1.1.1 原理 硫酸化修饰的原理是将多糖与相应的硫酸化试剂溶于一定的溶剂中,在一定的条件下相互反应,从而将硫酸基团引入原多糖残基上的某些羟基上[12],以图1中的反应为例,采用氯磺酸为主要试剂,多糖在路易斯碱溶液体系中,其羟基中的-H被-SO3H所取代,经反应完成后获得多糖硫酸盐。

图1 多糖硫酸化反应(R为H或SO3Na)Fig.1 The sulfation reaction of polysaccharides(R is H or SO3Na)
1.1.1.2 修饰方法 硫酸化修饰多糖常用的方法主要有氯磺酸-吡啶法、浓硫酸法、三氧化硫-吡啶法、氨基磺酸-甲酰胺法、三氧化硫-二甲基甲酰胺法及氯磺酸-二甲基甲酰胺法等[13]。通常根据多糖分子主链的糖单元类型来选择引入硫酸基团的方法,例如wolfrom法适用于吡喃型多糖[14],而Nagasawa法则适用于呋喃型多糖[15]。其中,氯磺酸-吡啶法、浓硫酸法及三氧化硫-吡啶法是最常用的3种方法。
氯磺酸-吡啶法因试剂易得,具有反应比较简单彻底,产物回收率较高等优点,成为硫酸化修饰的一种理想方法,但在应用过程中要注意温度的控制,温度过高将有可能破坏多糖的结构。汲晨峰等[16]与李东霞等[17]采用氯磺酸-吡啶法分别对昆布多糖,鲨鱼软骨多糖及太白蓼多糖进行硫酸化修饰,结果都各自获得了不同取代度的硫酸化多糖;经结构鉴定发现,昆布硫酸化多糖是一以β-(1→3)糖苷键为主链,C2-OH与C6-OH位为硫酸基取代位置的多糖,其硫酸基含量为45.92%,取代度为1.51;而鲨鱼软骨硫酸化多糖硫酸基取代在C-6位上,其硫酸基含量为19.6%,比未硫酸酯化前增加了6.1%。安乐等[18]与刘婕等[19]采用氯磺酸-吡啶法,以硫酸基取代度为指标,分别考察了太白蓼多糖与皱皮木瓜多糖硫酸化修饰的最佳条件,结果显示,当氯磺酸与吡啶体积比为1∶10,反应温度及时间分别为80 ℃和1 h时,太白蓼硫酸化多糖硫酸基取代度最高,数值为1.57;当v(氯磺酸)/m(多糖)=30 mL∶1 mg、反应温度及时间分别为30 ℃和2 h时,皱皮木瓜硫酸化多糖硫酸基取代度最高,数值为2.41。
硫酸法与三氧化硫-吡啶法的制备过程相对较简单,但取代度和产物回收率却不是很高。朱影等[20]与栾琳琳等[21]采用浓硫酸法,分别对白背三七多糖和五味子叶多糖进行硫酸化修饰,结果获得了硫酸基含量为13.70%,取代度为1.23的白背三七硫酸化多糖与取代度为0.46的五味子叶硫酸化多糖,其中,还发现白背三七多糖在硫酸化修饰的同时,其主体结构并未被破坏;而反应试剂配比为3∶1、反应温度0 ℃和反应时间1.4 h则是五味子叶多糖硫酸化修饰的最佳工艺。王新宇等[22]分别采用氯磺酸-吡啶法和浓硫酸法对小刺猴头菌多糖进行硫酸化修饰,结果表明,氯磺酸-吡啶法获得的硫酸化多糖含硫量为11.64%,取代度为0.94,浓硫酸法获得的硫酸化多糖含硫量为10.68%,取代度为0.82,证实氯磺酸-吡啶法更适合制备小刺猴头菌多糖硫酸化衍生物。张秋平等[23]与杜挺挺等[24]分别考察了三氧化硫-吡啶法对桦褐孔菌多糖与厚壳贻贝多糖硫酸化修饰的影响,结果得出,当反应温度为75 ℃,时间为1.5 h,反应摩尔浓度比为1∶3.5时,桦褐孔菌硫酸化多糖硫酸基取代度达到最高值0.97;而当反应温度为90 ℃,时间为6 h,三氧化硫与吡啶体积比为1∶6时,厚壳贻贝硫酸化多糖得率为34%,且修饰后硫酸根含量从6.51%提升到32.95%,取代度从0.12提升到0.86。
除以上几种常用方法外,吴素珍等[25]、周本宏等[26]与王欢等[27]也均采用氨基磺酸-甲酰胺法分别获得了当归多糖硫酸化衍生物(硫酸基含量13.69%,取代度为1.23),天麻多糖(GEP)硫酸化衍生物(GEPs取代度为0.59,GEPsⅡ取代度为0.64)与党参多糖硫酸化衍生物(取代度为0.75)。
1.1.2 硫酸化修饰对多糖生物活性的影响 大量研究事实证明,硫酸化修饰多糖可增强其生物活性,如今,硫酸化多糖也因其突出的抗病毒(抗HIV病毒、流感病毒、巨噬细胞病毒)、抗肿瘤、抗凝血等活性在实际生产过程中应用最为广泛。Miao等[28]采用氯磺酸-吡啶法对马尾藻多糖进行化学结构修饰,获得取代度为0.803的马尾藻硫酸化多糖,与未修饰前相比,马尾藻多糖硫酸酯对HepG2细胞的增长呈现出一定的抑制作用,证实马尾藻的硫酸化多糖能有效增强其抗肿瘤活性的发挥。Geng等[29]采用氯磺酸-吡啶法对马尾松花粉多糖进行化学结构修饰,获得马尾松硫酸化多糖,并研究了其对RAW264.7巨噬细胞免疫功能的影响,结果显示,马尾松硫酸化多糖具有抑制巨噬细胞的免疫功能,这是由于SPPM60-D与巨噬细胞上的TLR4结合激活了TLR4-PI3K-PLC-IP3R信号通路,导致CRAC通道的开放,增加了[Ca2+]i并激活了巨噬细胞,从而促使了免疫功能的提高。Malagoli等[30]通过对红藻(L.muelleri)的两种硫酸化多糖Fra-B1和Fra-B2进行探究发现,Fra-B1和Fra-B2均能抑制1型和2型单纯疱疹病毒(HSV-1和HSV-2),可阻止单纯胞疹病毒(HSV)的吸附,防止其穿透细胞,是一种新的抗HSV剂。
此外,相关研究发现,硫酸化多糖的生物活性与其分子结构中的硫酸根有着密切关系,在多数硫酸化多糖中,若将硫酸根去除,其生物活性尤其是抗病毒活性均会消失,原因可能是硫酸化多糖的抗病毒活性与糖链空间结构有关,多糖进行硫酸化修饰后,糖链柔性降低,进而表现出抗病毒活性,但并非硫酸根的数量越多生物活性就越强,硫酸根数量过多会导致抗凝血等副作用或其它毒副作用的产生,一般平均每个单元的糖残基中含1.5~2.0个硫酸根最为适宜[6]。
1.2 羧甲基化修饰
羧甲基化修饰具有试剂易得、成本较低、制备过程简单及反应所生成的物质低毒或无毒等优点,已成为多糖化学结构修饰较为常用的方法之一。相关研究表明,某些多糖具有良好的抗肿瘤活性,但因其分子量过大,溶解性能差导致多糖的广泛应用受到限制,而对多糖结构进行甲基化修饰,能有效提高多糖的水溶性,对多糖生物活性的发挥尤其是抗肿瘤活性的发挥具有重要作用。
1.2.1 原理及修饰方法
1.2.1.1 原理 羧甲基化修饰的原理是将多糖与一氯乙酸在碱性的条件下相互反应,从而将羧甲基引入原多糖残基上的某些羟基上,如图2所示,以茯苓多糖羧甲基化反应为例[31],采用一氯乙酸为主要试剂,多糖在碱性环境中,其某羟基中的-H被ClCH2COO-所取代,经反应完成后获得羧甲基化多糖。
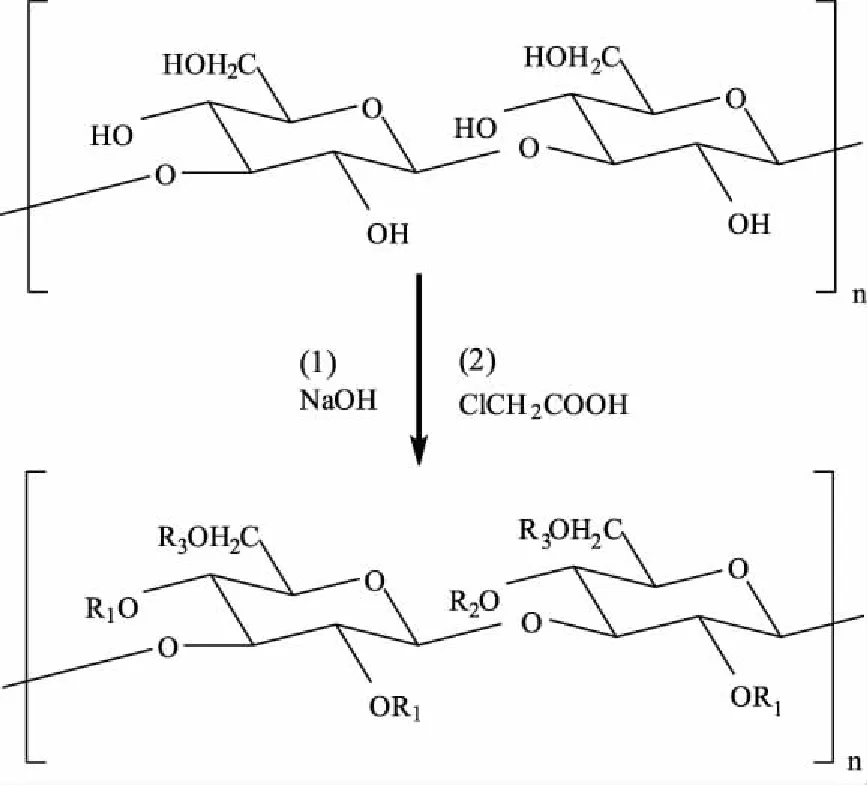
图2 茯苓多糖羧甲基化反应Fig.2 The carboxymethylation reaction of pachymaran注:R1、R2、R3代表取代基ClCH2COO-或H, 羧甲基反应一般取代C-6位。
1.2.1.2 修饰方法 对多糖结构进行羧甲基化修饰主要有溶媒法和水媒法两种方法。
溶媒法是指将一定量的多糖悬浮于如甲醇、乙醇、丙酮等有机溶剂中,在碱性条件下反应一段时间后加入一氯乙酸,于适当温度下进行醚化反应,即得羧甲基多糖。曹莉莉等[32]采用氢氧化钠-异丙醇-氯乙酸钠反应体系,以羧甲基取代度为指标对余甘多糖进行羧甲基化修饰,经红外光谱显示COO-成功接入余甘多糖,证实羧甲基化余甘多糖制备成功,其取代度为0.961。张洋婷等[33]采用氢氧化钠-乙醇-氯乙酸反应体系,以羧甲基取代度为指标对红景天多糖进行羧甲基化修饰,通过正交试验确定羧甲基化红景天多糖的最佳条件为反应温度60 ℃、氯乙酸15 mg、反应时间3.5 h,得出最佳取代度为15.07。陈义勇等[34]采用氢氧化钠-异丙醇-氯乙酸反应体系,以羧甲基取代度为指标对杏鲍菇多糖进行羧甲基化修饰,结果表明,当NaOH为2.98 g,氯乙酸为2.51 g,反应时间为4 h,反应温度为60 ℃时,羧甲基杏鲍菇多糖取代度可达0.891。
水媒法是指将一定量多糖用稀碱溶液溶解后加入适量一氯乙酸,再在适当的温度下进行醚化反应,即得羧甲基多糖。申林奔等[35]以苦豆子多糖为原料,采用氢氧化钠-氯乙酸钠反应体系,以羧甲基取代度为指标,通过正交实验确定了其最优反应条件:原料为50 mg,在氯乙酸钠0.5 g,反应温度55 ℃,反应时间5 h,氢氧化钠浓度25%的优化条件下羧甲基基团取代度可达1.50以上,且红外光谱分析表明,该方法成功引入羧甲基基团。韦毅铭等[36]与谢静南等[37]采用氢氧化钠-一氯乙酸反应体系,以羧甲基取代度为指标分别对龙眼肉多糖和甜玉米芯多糖进行羧甲基修饰,结果发现,当一氯乙酸浓度1.2 mol/L、反应温度73 ℃、反应时间3.2 h时,龙眼肉羧甲基化多糖取代度可达1.053,当NaOH溶液浓度4.0 mol/L,温度45 ℃,一氯乙酸用量2.360 g时,甜玉米芯羧甲基化多糖取代度最高为0.0516。
溶媒法具有反应过程迅速,主反应速度快且稳定,副反应少,醚化剂利用高等优点,但由于应用过程中使用大量有机试剂导致物耗提高,有机试剂分离回收困难,生产成本也较高;水媒法具有设备简单、投资少、成本低等优点,但产品质量不均匀、醚效低,生产出产品粘度低、副作用较多,后处理比较困难。
1.2.2 羧甲化修饰对多糖生物活性的影响 将多糖结构进行羧甲基化修饰后,其水溶性大大提高,多糖生物活性的发挥也跟着增强了。经大量的研究报道证明,羧甲基化后的多糖能呈现出较强的抗肿瘤、抗氧化、抗疲劳及免疫调节等生物活性。
Surhio等[38]通过对粒毛盘菌属的胞外多糖及其羧甲基化衍生物的抗疲劳活性研究中发现,它们均能抑制运动过程中血清尿素氮和血液乳酸含量的积累,延长运动耐久性,同时两者均能改善小鼠的抗氧化防御机制,但是研究发现,在相同剂量下,羧甲基化衍生物比未修饰前更能增强小鼠的耐受能力延缓小鼠疲劳,这表明羧甲基化可以增强粒毛盘菌多糖的抗疲劳活性,可被用作一种医疗手段来抵抗疲劳和增加体力。Liu等[39]对菌丝体羧甲基化多糖研究发现,其羧酸酯基团的取代主要出现在C-6位上,通过比较,羧甲基化能显著提高菌丝体多糖的抗氧化活性和抗菌活性,其中中等取代度和稳定三螺旋结构的菌丝体羧甲基化多糖具有最大的DPPH自由基清除能力、还原能力、金属螯合活性和抗菌活性。Shi等[40]为了改善苔菜多糖(PE)的生物活性,将其降解为低分子量多糖(DPE),之后又对其进行羧甲基化获得羧甲基化多糖(CDPE),经过对PE、DPE及CDPE的抗氧化分析发现,在各样品浓度均为4 mg/mL时,CDPE对DPPH的清除率达到36.2%,而DPE和PE分别为19.8%和11.3%,CDPE对超氧阴离子自由基的除率达到61.1%,而DPE和PE分别为49.7%和28.7%,CDPE具有更强的抗氧化活性。
1.3 乙酰化修饰
乙酰化修饰因具有反应速度快、反应温和、产物转换率高等优点成为多糖化学结构修饰中常用的分子修饰方法之一。乙酰化修饰通过改变多糖的定向性和横向次序改变多糖的理化性质。经乙酰化修饰后的多糖会导致分子结构伸展的产生变化,致使自身分子结构中的羟基暴露在外,增大了多糖的溶解度,从而影响多糖生物活性的发挥[41]。
1.3.1 原理及修饰方法
1.3.1.1 原理 乙酰化修饰作为常用的修饰方法之一,其通过在多糖分子支链上引入乙酰基达到增强其生物活性的目的。通常采用乙酸或者乙酸酐为多糖乙酰化的主要试剂,在适当的条件下,多糖分子结构上的活性羟基基团可与相应试剂发生亲核取代反应,生成乙酰化多糖酯,如图3所示,在甲苯、高氯酸存在的条件下,纤维素与乙酸酐发生全乙酰化反应。
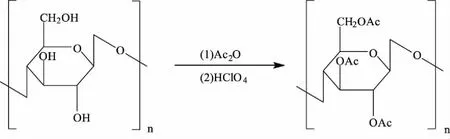
图3 纤维素的全乙酰化Fig.3 Complete acetylation of cellulose
1.3.1.2 修饰方法 乙酸酐-吡啶法是乙酰化修饰多糖常用的方法,此法主要为将多糖充分溶解于一定的有机溶剂(吡啶、甲醇、甲酰胺、DMAc/LiCl等)中,然后加入合适的乙酰化试剂(乙酸或乙酸酐)进行修饰反应,通常氨基氮和羟基氧是乙酰基取代的多取代点[42]。郭晓强等[43]在氢氧化钠水溶液的均相体系中以乙酸酐为酰化试剂对银耳多糖进行乙酰化修饰,在本实验条件下获得了低取代度0.214的乙酰化银耳多糖。杨春瑜等[44]以甲酰胺为溶剂,乙酸酐为酰化试剂,N-溴代琥珀酰亚胺(NBS)为催化剂对黑木耳多糖进行乙酰化修饰,结果得到,制备乙酰化黑木耳多糖的最优实验条件为,反应时间3.5 h,反应温度80.0 ℃,乙酰化试剂用量32.5 mL,NBS添加量为1.0%,在此实验条件下,得到的乙酰化取代度平均值为0.55。黄丹菲等[45]采用乙酸酐为乙酰化试剂,以大粒车前子多糖为原料,对其进行乙酰化修饰,当乙酸酐体积分数为10%、反应温度为30 ℃、时间为2.5 h时,取代度达最高值为0.094,其中,反应温度和乙酸酐体积分数是影响多糖乙酰化反应取代度的主要因素。
1.3.2 乙酰化修饰对多糖生物活性的影响 乙酰化修饰通过向多糖分子中引入乙酰基团来改变其生物活性的强弱。曾有美国学者报道指出多糖的生物活性随乙酰基含量的增大而增强,但随着研究的不断深入,研究人员发现多糖生物活性的强弱并非与其乙酰基含量呈正相关,例如,地衣类多糖石脐素β(1→6)-D-葡聚糖,将其部分乙酰化后,乙酰基的引入使多糖分子结构产生变化,使其呈现出抗肿瘤活性,而当再将其脱乙酰化或全乙酰化后,其呈现出的抗肿瘤活性又消失了[46]。经大量研究发现,乙酰化多糖中乙酰基的数量及取代位置与多糖的活性存在构效关系,例如,当多糖分子中O-3位被乙酰基取代时,多糖的抗肿瘤活性明显增强;而当O-5位被乙酰基取代时,其抗肿瘤活性明显减弱;当O位被乙酰基全部取代时,多糖的活性则完全消失;其原因可能是乙酰基团的引入改变了多糖糖链分子的空间排布,进而导致了生物活性的变化[47]。因此,根据不同的性质,采取不用的方案,达到预期的目的是值得深入研究的方向之一。
乙酰基团的引入还可使多糖呈现出显著的抗氧化、抗凝血及免疫调节活性等。Deng等[48]从石斛中分离得到一种具有生物活性的石斛多糖,研究结果表明,此多糖在水溶液中呈球形,含有β-1,4-D-Manp构架并且在某些甘露糖残基的O-2或O-3位置上被乙酰基多取代,研究显示石斛多糖对RAW 264.7巨噬细胞表现出免疫调节功能。Liu等[49]研究了青钱柳叶多糖与其乙酰化衍生物对RAW264.7巨噬细胞的潜在免疫调节活性,结果表明乙酰化多糖能明显促进巨噬细胞的增殖,且作用明显强于未修饰的多糖。王之珺等[50]对青钱柳乙酰化多糖进行自由基清除实验,结果显示乙酰化修饰可显著提高青钱柳多糖的抗氧化活性。
1.4 硒化修饰
硒是人体生命活动的必需元素,可增强机体的抗氧化能力,在防癌抗癌方面起着重要的作用。硒和多糖都具有多种生物活性,都可对疾病进行防治,相关实验证实,将硒和多糖有机结合在一起形成的硒多糖具有多种生物活性,其可通过提高相关酶的活性来拮抗重金属中毒和抗活性氧损伤的能力,可使癌细胞DNA合成受阻而抑制癌细胞生长等[51]。硒多糖不仅兼顾了硒和多糖的活性,且活性高于两者,更易被机体吸收利用,因具有低毒性、低副作用及易吸收等优点受到了广大科技研究者的关注,尽管目前对于硒和多糖活性的研究已取得巨大成果,但将硒和多糖有机结合在一起合成的硒多糖方面,国内外相关研究仍然处于发展中状态。开展硒多糖的合成具有重要意义。
1.4.1 原理及修饰方法 许多动植物和微生物体内都含有天然硒多糖,特别是在植物体内。但研究人员发现生物体内的天然硒多糖的含量少之又少,远远达不到研究要求,这使得硒多糖的研究受到了限制。因此,必须采取方法,对多糖进行硒化修饰或者其它方法获取硒多糖。硒多糖的化学结构不同于普通多糖,它含有特殊的硒氧键,其中在一定条件下利用无机硒(单体硒、亚硒酸或亚硒酸钠)与多糖反应对其进行硒化修饰是目前对多糖进行硒化修饰最常用的方法。张越峰等[52]以红枣多糖为原料,亚硒酸为主要试剂与其进行硒化反应,通过红外光谱证实,硒在红枣多糖中以硒酸酯的形式存在。李志洲等[53]与陈文霞等[54]以亚硒酸钠法分别考察了猪苓多糖及纹党参多糖硒化修饰的最佳工艺,其中,当亚硒酸钠溶液与猪苓多糖溶液流量配比1∶1,反应温度70 ℃、反应釜内硝酸的浓度0.008 mL/mL,超声辅助合成频率为30 kHz,其合成率达26.5 mg/g;当反应时间为5 h,反应温度 60 ℃,投料比1∶1时,硒化纹党参多糖中含硒量可达1.07 mg/g,产率可达50.3%。吴秀钦等[55]也运用亚硒酸钠法,在不同时间、温度及亚硒酸钠浓度条件下对太子参多糖进行正交硒化修饰,最终得到9种硒化太子参多糖。
除此之外,还可以在适宜培养条件下将无机硒添加到真菌、藻类等的培养基中,通过真菌、藻类等的生长代谢,对硒进行富集和生物转化来获得硒多糖,此法获得的硒多糖不仅含量高且种类繁多[56]。
1.4.2 硒化修饰对多糖生物活性的影响 硒多糖兼有硒的强抗氧化性和多糖的抗肿瘤、抗病毒及抗辐射等两者的生物活性,在医药和食品等领域有着广泛的应用前景。Wang等[57]使用H2SeO3/HNO3和BaCl2作为催化剂合成了具有高硒含量的硒化沙蒿多糖,研究发现,硒化结构主要在多糖分子结构中的C-6位上,与原沙蒿多糖相比,硒化沙蒿多糖呈现出更强的清除羟基和超氧自由基活性。Gao等[58]从O. radicata的菌丝体中成功获得硒多糖(SMPS)和多糖(MPS),并且研究它们的抗氧化能力,抗肺损伤活性及单糖组成,结果显示SMPS和MPS都具有潜在的抗氧化活性和对LPS诱导的肺损伤有显著的保护作用。Mao等[59]对硒化灰树花多糖进行研究发现,硒化灰树花多糖可通过提高荷瘤小鼠的免疫功能而间接发挥抗肿瘤作用。
1.5 磷酸化修饰
磷酸化修饰是多糖化学结构修饰常用的方法之一,与其它化学修饰一样,它也是一种对分子支链的共价修饰。多糖分子经磷酸化修饰后,其抗肿瘤、抗凝血等生物活性得到明显提高,因此受到相关领域的关注。
1.5.1 原理及修饰方法 磷酸化修饰的原理是将多糖与磷酸化试剂相互反应,从而将磷酸基引入多糖残基上的某些羟基上。目前,磷酸氢二钠、磷酸二氢钠及三聚磷酸钠等磷酸盐因廉价易且不易引起多糖的降解常用于多糖的磷酸化。
Passauer等[60]在淀粉加入一定量的磷酸氢二钠和磷酸二氢钠混合盐水,搅匀烘干,将干燥的混合物于高温下制得磷酸化淀粉,但其反应活性低,不易获得高取代度产物。倪海钰等[61]以淫羊藿多糖为对象,使用三聚磷酸钠和三偏磷酸钠混合试剂作为磷酸化试剂,对淫羊藿多糖进行磷酸化修饰,结果显示,当三聚磷酸钠与三偏磷酸钠比为5∶2,反应温度97 ℃,反应时间2.8 h,反应pH8.7时,磷酸化淫羊藿多糖磷酸根含量可达(6.012±0.021)。冯小玲等[62]以三聚磷酸钠和三偏磷酸钠为原料对裂褶多糖进行磷酸化修饰,当反应条件为m(三聚磷酸钠-三偏磷酸钠):m(裂褶多糖)=2∶1,反应温度60 ℃,反应时间3 h时,其反应取代度最佳,为0.052。总的来说,相对其他化学修饰方法,关于磷酸化修饰研究的报道较少,其如何在多糖残基上发挥作用的机理机制也尚未明确,还待进一步研究。
1.5.2 磷酸化修饰对多糖活性的影响 磷酸化多糖具有很强的抗肿瘤、抗病毒及免疫调节等生物活性,对多糖相关产品的研究开发具有重要作用。Deng等[63]对竹荪多糖与竹荪磷酸化多糖研究发现,竹荪磷酸化多糖表现出令人满意的水溶性且抗氧化性活性的显著增加,与竹荪多糖相比,竹荪磷酸化多糖对MCF-7和B16肿瘤细胞的生长也显示出更显著的抑制作用。孙婕等[64]对南瓜多糖与南瓜磷酸化多糖进行研究发现,南瓜磷酸化多糖在清除羟基自由基和超氧阴离子自由基能力方面均强于未修饰的南瓜多糖,具有更强的抗氧化活性。杨萍[65]研究了银耳磷酸化多糖对辐射损伤小鼠造血功能的影响发现,银耳磷酸化多糖具有保护机体的造血组织,拮抗白细胞降低的功效,为肿瘤治疗领域开发低毒、高效的新靶点药物提供了科学依据。宁苑灵[66]对龙眼肉磷酸化多糖研究发现,龙眼肉磷酸化多糖具有提高环磷酰胺致免疫低下小鼠的免疫功能作用及抗小鼠肝脂质过氧化作用。
1.6 其他化学修饰方法
多糖的化学结构修饰除以上几种方法外,还有磺酰化修饰、烷基化修饰、双基团衍生化修饰、棕榈酰化修饰、硝酸酯化修饰及碘化修饰等。
其中,磺酰化修饰是将多糖与磺酰化试剂(对甲基苯磺酰氯或苯磺酰氯)在一定条件下进行反应,使多糖支链上的羟基被磺酰基所取代的一种修饰方法(以图4[67]中淀粉的磺酰化为例),多糖通过磺酰化修饰,可增强其原有生物活性或产生新的生物活性,另外磺酰基的引入除了可对多糖进行结构修饰以外,还可作为多糖结构中羟基的保护基团[68]。
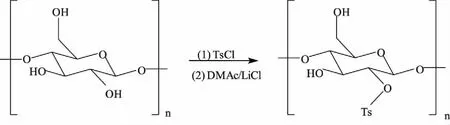
图4 淀粉的磺酰化反应Fig.4 Sulfonylation of starch
近年来,关于磺化多糖的生物活性报道较少,张强[69]将茯苓多糖进行磺酰化修饰后获得磺酰化茯苓多糖,研究发现其具有较好的清除自由基的能力,并对Fe3+有不同程度的还原作用,可作为一种天然的抗氧化剂。
某些多糖因粘度高、溶解度低等阻碍了其生物活性的发挥,烷基化修饰多糖可使其水溶性增大,增强其生物活性。通常采用卤化烃为多糖烷基化试剂,通过向多糖主链中引入不同长度或类型的烷基、取代烷基或长链芳香醇实现多糖的甲基化修饰。烷基化部位常为N或羟基,以图5壳聚糖氨基氮的烷基化为例[70]。

图5 壳聚糖的烷基化反应Fig.5 The alkylation reaction of chitosan注:R为乙基、丁基、辛基、十六烷基等。
对于烷基化修饰多糖,近年相关报道也比较少,黄玉芬等[71]研究发现,在壳聚糖的C2位上引入一定数量的十八烷基苯基团进行疏水改性后,可显著提高壳聚糖的凝血性能,但并非烷基程度越高,凝血能力越强,凝血能力受烷基化程度的影响。另外,在一些报道中发现烷基化对硫酸多糖的抗艾滋病毒活性有促进作用,如硫酸化烷基寡糖,因其烷基部分可与病毒囊膜脂双层作用,致使囊膜破裂,从而达到抗艾滋病毒的功效。
另外,双基团衍生化修饰解决了单一基团衍生化可能存在的修饰后生物活性仍不理想的弊端,如壳聚糖经羧基化修饰后再磺酰化修饰能呈现出较高的抗凝血活性[72],但不便于操作和相关条件的控制;此外,另有报道发现,多糖分子结构中的羟基和肽键与金属离子络合形成的复合物能使其呈现新的活性,这对多糖化学结构修饰方法的研究具有重要意义[73]。
2 物理修饰方法
研究发现,多糖因分子量大、空间结构复杂及聚合度高等阻碍了其生物活性的发挥,对多糖结构进行物理修饰可达到增强其生物活性的目的,而且相对于化学修饰,物理修饰还具有节约能源、操作简便、降低化学反应产物对环境的破坏等优点。目前,对多糖进行物理修饰应用比较广泛的主要有超声波降解修饰和离子辐射修饰两种方法。
超声波降解因具有降解过程和降解程度容易控制,获得的产物分子量小,易获得目标分子量,且不引入新物质,对多糖的结构不会造成破坏,不影响其固有的生物活性等优点,目前已成为国内外关注的热点之一。其主要通过切断多糖大分子中的某些化学键以降低多糖分子量,增加其水溶性来提高多糖生物活性,此法广泛应用于多种大分子生物如葡聚糖、壳聚糖及其他天然多糖等的结构修饰。王振斌等[74]对超声波修饰前后的无花果多糖进行抗氧化活性分析和分子结构表征,经过超声波处理,多糖的C-O-C和C-O-H键被超声波大量打断,断裂为分子量较小的多糖,数均分子量和重均分子量分别从536800、1061000 Da减少到46410、93870 Da,分子量分布宽度由1.98变成2.02,对修饰后的多糖进行醇沉和葡聚糖凝胶G-150层析,得到一种抗氧化能力较强的组分。Tang等[75]采用超声波降解青钱柳叶多糖后发现,与未降解多糖相比,超声波降解后多糖具有更好的DPPH清除活力和羟自由基清除活力。王鹤等[4]采用超声波降解密花石斛多糖后发现,与未降解多糖相比,超声降解后的多糖不仅分子量和特性粘度降低了,还显著提高了多糖促进脾细胞增殖的活性。Yu等[76]采用超声波降解条斑紫菜多糖后发现,与未降解多糖相比,超声波降解后的多糖对胃癌细胞SGC7901和95D细胞的抑制能力都明显增强了。
离子辐射修饰主要是利用r射线、X射线及电子束等电离辐射诱导多糖发生物质聚合、交联、接枝或降解等物理化学变化以改变多糖的分子结构提高其生物活性,但近年来关于此方法的相关研究并不是很多。张慧等[77]为了改善阳离子淀粉的性质,采用微波辐射与半干法结合工艺制备阳离子淀粉,结果显示:相比半干法工艺,微波半干法对阳离子支链淀粉的降解作用更明显,微波半干法阳离子淀粉较半干法样品的溶解度、透光率和冻融稳定性提高,峰值黏度及终黏度降低。程德山等[78]采用Co60辐射对淀粉甲基丙烯酸羟乙酯接枝改性,制备接枝淀粉浆料,通过试验得出接枝改性的最佳工艺参数为:混合反应介质(水)含量28%,甲基丙烯酸羟乙酸与淀粉配比6%,辐射剂量率10 Gy/min,辐射剂量6 kGy。
3 生物修饰方法
随着科学技术的发展,通过生物修饰对多糖的合成途径进行控制或者改变多糖分子的主链结构提高其溶解度也可改变多糖生物活性。目前,对多糖结构进行生物修饰应用得比较广泛的方法有基因工程技术和酶法修饰两种。
众所周知,微生物具有繁殖速度快的特点,此特点为大量生产微生物活性多糖提供了可能。但研究发现,许多天然的微生物多糖并不具备理想的活性结构,因此对其进行结构修饰获取理想的活性结构具有重要意义。基因工程技术通过操纵微生物基因的表达或引入外源基因等,来控制多糖在微生物体内合成的途径从而获取所需的多糖。Jamas等[79]在一野生酵母菌中引入外源基因使胞内多糖结构发生变化,与修饰前的多糖相比,修饰后的多糖支链取代度不仅提高了,且空间结构也变得更加舒展,重要的是多糖的抗肿瘤活性得到了显著增强。尽管如此,基因工程技术也因其操作的不稳定性、外源基因获取困难等缺点而发展受阻,但从初期的发展情况来看,其在多糖结构修饰方面仍有着广阔的前景。
酶法修饰因其反应具有专一性强、操作简便、无或低副作用、高效性、环境友好及降解条件温和且易控制等优点在多糖的分子结构修饰中日益受到重视。糖苷酶是酶法修饰中使用最多的一种酶,它通过对多糖主链的降解作用,提高多糖的溶解度,从而利于多糖生物活性的发挥。余志等[80]以糖苷酶溶液为修饰酶,研究了酶法修饰茶多糖对环磷酰胺抑制免疫低下模型小鼠的免疫功能的影响,与修饰前多糖相比,修饰后的多糖能明显提高小鼠脾指数、腹腔巨噬细胞吞噬率和吞噬指数,能显著提高DTH试验耳肿程度、血清HC50、NK细胞活性,证实酶法修饰能增强绿茶多糖的免疫活性。贾俊强等[81]采用α-淀粉酶对蛹虫草多糖多糖进行酶法修饰,研究发现,酶法修饰后的蛹虫草多糖对DPPH自由基的清除率比修饰前提高了55.1%,证实酶法修饰能显著提高蛹虫草多糖的抗氧化活性。夏新奎等[82]采用α-淀粉酶对薤白多糖进行酶法修饰,并用邻苯三酚自氧化法测定修饰产物的抗氧化活性,结果表明,酶法修饰能显著增强薤白多糖的抗氧化活性。不过,目前酶法修饰技术在多糖结构修饰中的应用仅限于对某些多糖降解的酶类,积极开发其它如转移酶、合成酶等类型的酶,丰富酶法修饰技术在多糖结构修饰中的应用具有重要意义。
4 结论与展望
不同的方法具有不同用途,根据不同多糖的理化性质以及不同用途的需求,来选择适合的修饰方法才能得到更好的效果。
尽管多糖结构修饰的研究已取得了不小成果,对于多糖的结构修饰人们也已熟练掌握了多种方法,但其仍各自存在着不同的缺点,如化学修饰方法虽针对性强,能针对某个部位改变其结构形式及状态从而获得目标多糖的某种生物活性,但其使用的有机试剂后续处理困难容易造成环境的污染,且反应过程不易控制容易引入杂质使多糖产生副作用;物理修饰方法虽操作简便,对多糖的结构不易造成破坏且对固有的生物活性不产生影响,但禁锢了目标多糖新活性的开发和利用;生物修饰方法虽专一性强、操作简便及反应条件温和易控制,但方法比较单一,其中的酶法修饰技术酶类的选择更是少之又少;不仅如此,现有的结构修饰方法其机理机制的研究也存在着不够深入还比较模糊等缺点,这些因素都不同程度影响着多糖结构修饰研究的发展,间接也影响着多糖构效关系的发展。
因此,在科学技术的指导下,对于未来多糖结构修饰的研究,还需做到以下几点:对现有方法取长补短,尝试联合多种方法对多糖结构进行定向修饰;多开展多糖结构修饰方法的探讨,进一步弄清已有方法的机理机制;勇于创新,寻找新的适合于不同类型多糖的修饰方法;加强改性后多糖构效关系的研究,明确结构修饰的位点、数量等结构表征与活性之间的相关性的研究。总的来说,对于多糖结构修饰的研究目前还处于发展阶段;不过,随着多糖结构修饰方法和相关领域科学技术的日趋完善和提高,相信多糖的开发和利用会越来越好。
