浓香型窖泥中高产细菌素乳酸菌的 鉴定及特性
2019-03-28,,,,
,,,,
(四川理工学院生物工程学院,四川自贡 643000)
窖泥是酒体生香功能微生物的繁殖载体,常年处于低pH、高水分、高静压、兼性厌氧的窖池中,菌群与窖泥中营养成分进行相互作用和相互交换等,给窖泥微生物的生长繁殖提供了特殊的环境[1-2]。窖泥中的菌种资源比较丰富,不同学者从中分离得到能产生抗生素、淀粉酶、类细菌素、木糖醇等功能微生物[3]。
窖泥功能微生物主要是己酸菌、丁酸菌、甲烷菌等,唐瑞等[4]用窖泥中甲烷菌和己酸菌自然富集的程度来作为老窖泥的标志和窖泥质量优劣的标志。岳小青等[5]采用超浓缩己酸菌液制成的窖泥培养液,使窖泥中的功能微生物菌群得到激活和增加,显著提高了原酒液中己酸乙酯的含量。陈兴杰等[6]提出己酸菌、丁酸菌是窖泥混合菌群中的重要功能菌,对总有机酸和主要目标酸类成分的合成有贡献。而窖泥中的乳酸菌未引起足够的重视。浓香型白酒的主体香为己酸乙酯,如果料醅中的乳酸菌过多,将会产生过多的乳酸,进而生成乳酸乙酯较多,降低白酒的口感[7]。因此,研究窖池中乳酸菌代谢产物有助于工业微生物菌种资源的开发及应用。
据乳酸乙酯的生成途径可知,控制白酒中的乳酸乙酯含量需从控制乳酸菌的生成以及降解生成的乳酸或乳酸乙酯等方面入手[8]。乳酸菌在发酵过程中能够产生乳酸、乙酸、H2O2、细菌素等多种具有天然抑菌活性的代谢产物[9]。其中,细菌素是一些革兰氏阳性菌和革兰氏阴性菌在生长过程中产生的具有抗菌活性的蛋白质结构物质[10],大多数产细菌素的乳酸菌是从食品中分离出来的,因此被认为是安全的[11],本文研究的菌种是从浓香型白酒窖泥中筛选出来的具有高抑菌活性的乳酸菌,研究其生物学特性,推测细菌素对白酒窖泥中微生物的影响。
1 材料与方法
1.1 材料与仪器
乳酸菌 分离自泸州老窖的窖泥;大肠杆菌、枯草芽孢杆菌、酿酒酵母、米曲霉、保加利亚乳杆菌等 由本实验室-20 ℃保藏;蛋白胨、蛋白酶、牛肉膏等 北京奥博星生物技术有限责任公司;Nisin标准品 sigma公司;吐温-80、Triton X-100、SDS、EDTA等 国药集团化学试剂有限公司;其它药品均为分析纯;细菌基因组DNA提取试剂盒 天津普瑞思生物技术有限公司;MRS培养基:蛋白胨10.0 g、牛肉膏10.0 g、酵母膏5.0 g、柠檬酸氢二铵2.0 g、葡萄糖20.0 g、吐温-80 1.0 mL、乙酸钠5.0 g、磷酸氢二钾2.0 g、硫酸镁0.58 g、硫酸锰0.25 g、蒸馏水1 L,pH6.2~6.4;PDA培养基:马铃薯200 g、葡萄糖20 g、蒸馏水1 L,自然pH;YPD培养基:蛋白胨10 g,酵母膏10 g,葡萄糖10 g,蒸馏水1 L,自然pH;LB培养基:蛋白胨10 g,NaCl 10 g,酵母膏5 g,蒸馏水1 L。
PHS-3C酸度计 成都世纪方舟科技有限公司;C1000型PCR仪 伯乐生命医学产品(上海)有限公司;Gene Genius型凝胶成像系统 英国Syngene公司;UV-2450分光光度计 日本Shi-madzu公司;3K30台式高速冷冻离心机 美国 Sigma 公司。
1.2 实验方法
1.2.1 高抑菌活性乳酸菌的筛选
1.2.1.1 指示菌菌悬液的制备 将大肠杆菌接种于LB液体培养基中,37 ℃ 180 r/min摇床培养 1 d,稀释成106CFU/mL的指示菌菌悬液。
1.2.1.2 发酵上清液的制备 将菌株活化后,37 ℃静置培养8 h,制成终浓度为106CFU/mL的乳酸菌种子液,按体积分数5%接种量将菌株种子液接种到MRS液体培养基中,37 ℃静置培养24 h后,8000 r/min 4 ℃离心20 min,收集上清液,4 ℃保存待用。
1.2.1.3 抑菌试验 采用双层琼脂扩散法[12]进行抑菌试验,对课题组分离自白酒窖泥中的19株乳酸菌进行复筛。在无菌培养皿中倒入10 mL水琼脂培养基,冷却凝固后放上牛津杯,以体积分数7%接种量将指示菌菌悬液加入到冷却至50 ℃的LB固体培养基中,混匀,倾倒于底层水琼脂上,待其凝固后,取出牛津杯,即形成孔洞,在每个孔内加0.2 mL乳酸菌发酵上清液,4 ℃扩散30 min,37 ℃培养24 h。观察培养孔周围是否出现抑菌圈并用游标卡尺测量其直径,筛选出抑菌圈直径最大,即抑菌效果最强的菌株划线保存。
1.2.2 乳酸菌所产抑菌物质的确定
1.2.2.1 酸的排除 乳酸菌在发酵过程中能够产生乳酸、乙酸等对细菌有一定抑制作用。用 1 mol/L NaOH溶液将0.1 mol/L的乳酸、乙酸和盐酸的pH调至与发酵上清液相同的pH(pH3.68),以未处理的上清液作对照,采用1.2.1.3方法进行抑菌实验,检测抑菌效果。
1.2.2.2 过氧化氢的排除 乳酸菌在代谢过程中产生的过氧化氢属于强氧化剂,对细菌也有一定抑菌作用,将发酵上清液调至过氧化氢酶的最适pH7.3,将过氧化氢酶加入到发酵上清液中,使其终质量浓度为1 mg/mL,37 ℃水浴2 h后将pH调回3.68,以未作处理的发酵上清液作空白对照,采用1.2.1.3方案测试抑菌活性。
1.2.2.3 酶敏感性 用1 mol/L HCl或NaOH溶液将发酵上清液pH调至酶的最适pH(胃蛋白酶pH2.0,木瓜蛋白酶 pH5.5,蛋白酶K pH7.0,胰蛋白酶 pH8.1),按终质量浓度为1 mg/mL分别将胃蛋白酶、木瓜蛋白酶、蛋白酶K和胰蛋白酶加到发酵上清液中,37 ℃水浴2 h后,调回pH3.68,进行抑菌试验,以未处理发酵上清液做空白对照。计算出残余抑菌率[13],如式(1)。
残余抑菌率(%)=实验组抑菌圈直径/对照组抑菌圈直径×100
式(1)
1.2.3 一株高抑菌活性乳酸菌的鉴定
1.2.3.1 形态学观察及生理生化试验 将筛选出的抑菌活性最强的菌株在MRS固体培养基上进行划线分离纯化,37 ℃培养24 h,对单菌落进行革兰氏染色[14],观察其显微镜下个体形态,检测各项生理生化指标[15-16],包括:接触酶试验、明胶水解试验、葡萄糖产气试验和糖发酵试验等。
1.2.3.2 16S rRNA序列分析 将筛选得到的菌株提取DNA基因组,通过PCR扩增技术获取目的基因DNA片段,送往测序公司测序,PCR 反应条件:94 ℃预变性5 min;94 ℃变性30 s,50 ℃复性30 s,72 ℃延伸1 min,35 次循环;最后72 ℃延伸10 min。从Gene Bank中选择同源性亲近的几株菌株的16S rRNA基因序列,采用Clustalx 1.83软件进行序列多重比较,用Mega 5.0软件进行统计和聚类分析,构建系统发育树,并对所构建的系统发育树进行评估[17-18]。
1.2.4 抑菌动力学曲线 将筛选出的菌株以体积分数5%的接种量接种到MRS液体培养基中,37 ℃静置培养72 h。每隔2 h在600 nm波长下测定光密度值,以未接种的发酵液作空白参照;每隔2 h测定接种发酵液pH,每隔4 h测定发酵上清液对大肠杆菌的抑菌活性。以时间为横坐标,分别以吸光值、抑菌圈直径和pH为纵坐标,得到菌株抑菌动力学曲线,确定最佳培养时间。
1.2.5 发酵液中抑菌物质的生物学特性 根据文献[19-20]所述实验方法,并有稍微改动,对发酵液中的抑菌物质进行生物学特性的探究。
1.2.5.1 效价测定 将100 mg Nisin标准品(效价为106IU/g)溶于100 mL无菌的0.02 mol/L盐酸溶液中,配成103IU/mL的Nisin标准液。以0.02 mol/L盐酸进行梯度稀释,稀释成效价分别为1、5、10、50、100、500 IU/mL。以Nisin效价对数值为横坐标,抑菌圈直径为纵坐标,作标准曲线。
1.2.5.2 pH耐受性 取10支试管装等体积发酵上清液,用1 mol/L HCl或NaOH溶液将10支试管中的发酵上清液的pH分别调至2.0、3.0、4.0、4.5、5.0、6.0、7.0、8.0、9.0、10.0,37 ℃水浴1 h后,每支试管分成两份,一份将pH调回3.68,另一份不再调pH,比较将pH调回3.68和不调回的抑菌效果。
1.2.5.3 热敏感性 取等体积发酵上清液分别置于40、60、80、100 ℃水浴处理1 h以及121 ℃高温高压处理20 min后,冷却至室温,以未处理的发酵上清液对照,测定抑菌效果。
1.2.5.4 表面活性剂的影响 将表面活性剂吐温-80、吐温-20、Triton X-100、SDS、EDTA和尿素分别加入到等体积发酵上清液中,使各物质的终质量浓度为1 mg/mL,37 ℃水浴处理2 h,以未经表面活性剂处理的发酵上清液为对照测定抑菌活性。
1.2.5.5 紫外线敏感性 取5份等体积发酵上清液平铺于无菌平皿中,于20 W紫外灯下距离20 cm分别照射15、30、60、90、120 min,以未经紫外线照射为对照,测定抑菌活性。
1.2.5.6 抑菌谱测定 以金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、保加利亚乳杆菌、嗜酸乳杆菌、黑曲霉、米曲霉及酿酒酵母等16株菌为指示菌,按照双层琼脂扩散法,制作含不同指示菌的上层培养基,乳酸菌选用MRS培养基,霉菌选用PDA培养基,酵母菌选用YPD培养基,其它细菌选用LB培养基。检测待测发酵上清液的抑菌活性,于各指示菌最适生长温度条件下培养,测定其抑菌谱。
1.3 数据处理
实验操作重复三次,每个样品设3个平行,采用Origin 8.5和SPSS 20.0软件进行数据分析及图标绘制,测定结果以平均值±标准差表示。
2 结果与分析
2.1 产抑菌物质乳酸菌的筛选
利用双层琼脂扩散法,对课题组自白酒窖泥中已分离的19株乳酸菌进行抑菌试验,筛选结果如图1,17号菌株抑菌圈直径最小,为11.32 mm,16号菌株抑菌圈直径最大,达到20.85 mm,故选取16号菌株作为进一步试验的测试菌,并命名为LP16。
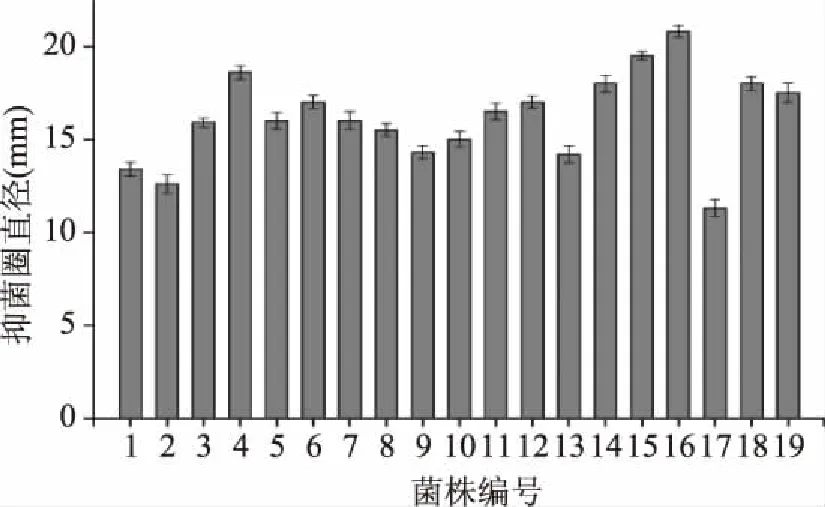
图1 不同菌株的抑菌效果Fig.1 The antibacterial effect of different strains
2.2 乳酸菌所产抑菌物质的确定
2.2.1 酸及过氧化氢的排除 由图2可看出,pH3.68的盐酸、乙酸和乳酸对大肠杆菌无抑制作用。图2中实验组用过氧化氢酶处理发酵上清液后,残余抑菌率为99.27%,仍有较强的抑菌效果。故可判断有机酸和过氧化氢不是菌株LP16所产生的抑菌物质,存在其他抑菌物质。

图2 酸及过氧化氢的排除Fig.2 The exclusion of acid and hydrogen peroxide注:1:未处理发酵上清液;2:盐酸;3:乳酸; 4:乙酸;5:过氧化氢酶处理。
2.2.2 蛋白酶敏感性 图3中发酵上清液经胃蛋白酶、木瓜蛋白酶、蛋白酶K和胰蛋白酶处理的结果显示其抑菌活性均有不同程度的降低。胰蛋白酶、蛋白酶K、木瓜蛋白酶和胃蛋白酶在37 ℃水浴2 h后,残余抑菌率分别为40.43%、43.48%、47.83%和51.30%。说明乳酸菌产生的抑菌物质能被蛋白酶分解而使得抑菌活性大幅减弱,表明发酵上清液中有蛋白质类抑菌活性物质,即细菌素,这与王净净等[21]报道的细菌素相符。
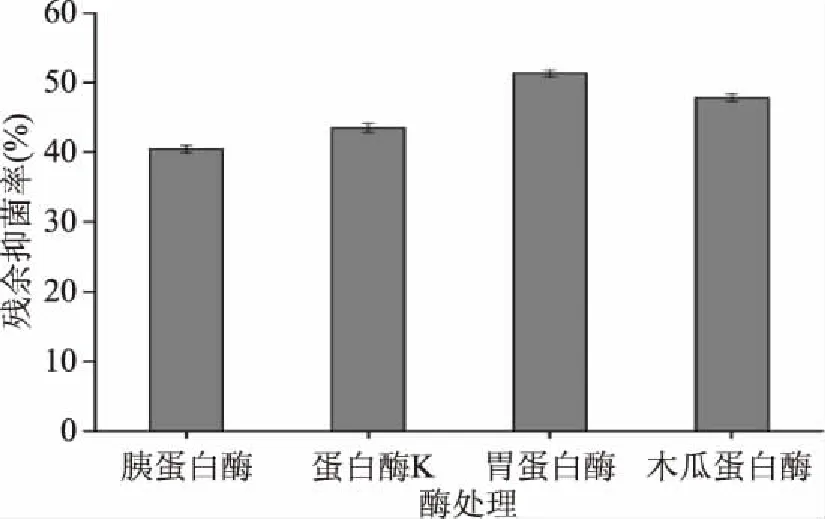
图3 菌株LP16的酶敏感性Fig.3 The enzyme sensitivity of strain LP16
2.3 产细菌素乳酸菌的鉴定
2.3.1 形态学观察 菌株LP16在MRS固体平板上呈乳白色、边缘光滑、圆形、微突起菌落。经革兰氏染色后,在显微镜下呈蓝紫色,为革兰氏阳性,菌体形态呈杆状,符合乳酸菌特征(图4)。
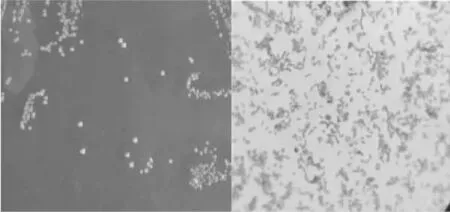
图4 菌落形态和镜检结果(100×10)Fig.4 The colony morphology and the micrograph (100×10)
2.3.2 生理生化试验 如表1中接触酶、明胶水解、淀粉水解、硫化氢试验呈阴性,说明该代谢过程中不能分泌产生明胶酶和淀粉酶来降解大分子物质,也不能产生过氧化氢和硫化氢;葡萄糖产气试验呈阳性,以及对葡萄糖、果糖、蔗糖、乳糖等发酵均呈阳性,说明该乳酸菌能够利用大部分糖。根据表1的结果,参照《伯杰细菌鉴定手册》和《乳酸细菌-基础、技术和应用》,可初步将菌株LP16鉴定为乳杆菌属。

表1 菌株LP16生理生化鉴定结果Table 1 Physiological and biochemical identification of strain LP16
2.3.3 乳酸菌16S rRNA测序 将所测得的序列构建系统发育树,结果如图5,本次所筛选的LP16乳酸菌序列与GenBank中已公布的副干酪乳杆菌序列同源性高达99%。从比对结果结合革兰氏染色等生理生化实验可以确定本次实验筛选的具有高效抑菌活性的菌株LP16为副干酪乳杆菌(Lactobacillusparacasei)。

图5 基于16S rRNA的LP16菌株系统发育树Fig.5 Phylogenetic tree based on the 16S rRNA sequence of strain LP16
2.4 抑菌动力学曲线
抑菌动力学曲线结果如图6。菌株LP16培养4 h后进入对数期,24 h后进入稳定期。菌株LP16产酸能力强,初始pH为6.5,最终pH稳定在3.5左右。从4 h开始具有抑菌活性,进入稳定期后抑菌活性也基本稳定,在36 h达到最高水平。故选取发酵时间为36 h。

图6 菌株LP16的抑菌动力学曲线Fig.6 The bacteriostasis kinetic curve of strain LP16
2.5 发酵液中抑菌物质的生物学特性
2.5.1 效价结果 以Nisin效价对数值为横坐标,抑菌圈直径为纵坐标,测得Nisin效价标准曲线回归方程y=2.1242x+13.775(R2=0.9955),菌株LP16发酵上清液效价可达2137.96 IU/mL。
2.5.2 pH耐受性 由图7结果可知,将pH调至2~10,37 ℃水浴保温1 h后pH不调回初始值直接作抑菌试验,分析出菌株LP16上清液在pH4.5时残余抑菌率只保留了62.5%,在pH5.0时丧失活性。然而保温1 h后将pH调回初始值,菌液再次出现抑菌活性,在pH2~10范围内残余抑菌率均在80%以上,保持稳定的抑菌活性。说明菌株LP16具有酸碱耐受性,但发挥抑菌作用需在酸性(pH<5)环境中。大部分细菌素在酸性条件下稳定,在中性或碱性条件下即会失活[22],但菌株LP16产生的细菌素具有宽泛的酸碱耐受性。

图7 不同pH时菌株LP16细菌素的抑菌效果Fig.7 The antibacterial effect of different pH on strain LP16 of bacteriocin
2.5.3 热敏感性 如图8可知,菌株LP16所产细菌素经40、60、80、100 ℃水浴1 h,甚至在121 ℃高温高压下处理20 min,都能保持90%以上的活性残余抑菌率,具有很好的热稳定性,该特性类似于大多数细菌素[20]。

图8 菌株LP16细菌素的热敏感性Fig.8 The heat sensitivity of bacteriocin produced by strain LP16
2.5.4 表面活性剂敏感性 表面活性剂常应用于食品工业中用于改善食品的品质,通常具有湿润、分散、乳化、起泡、保湿等作用[23]。菌株LP16所产抑菌物质对表面活性剂的敏感性结果如图9,尿素、吐温-20对菌株LP16发酵上清液的抑菌活性几乎没有影响,残余活性保持在90%左右,吐温-80、SDS、EDTA对细菌素的抑菌活性有促进作用,而Triton X-100对细菌素的抑菌活性有抑制作用,残余抑菌率为70.25%。

图9 不同化学试剂对菌株LP16细菌素的抑菌效果Fig.9 The antibacterial effect of different chemical reagent on strain bacteriocin of LP16
2.5.5 紫外线敏感性 表2中紫外线处理后的细菌素,在1 h内随着紫外线照射时间的延长,上清液抑菌效果呈缓慢降低趋势,与冉军舰等[24]报道的紫外线影响变化趋势前期相似,但其在1 h后活性就显著降低了,而菌株LP16的抑菌活性仍保持在80%以上,说明紫外照射不能使该细菌素发生变性,该细菌素对紫外线不敏感。
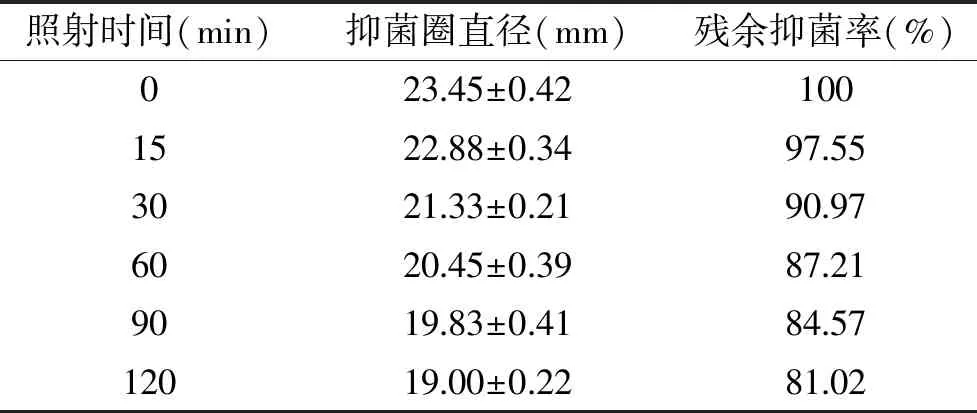
表2 紫外线敏感性Table 2 Sensitivity to ultraviolet light
2.5.6 抑菌谱测定 以革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌,革兰氏阴性菌大肠杆菌、霉菌、酵母菌、乳酸菌等16株菌为指示菌,检测菌株LP16上清液的抑菌谱。从表3可知其对革兰氏阳性菌金黄色葡萄球菌和枯草芽孢杆菌,以及革兰氏阴性菌大肠杆菌有较强的抑菌效果,也对部分乳酸菌有抑菌效果,但对霉菌和酵母菌等真菌没有抑菌效果。因此该细菌素存在于白酒窖泥中,不仅能抑制有害菌的生长,也不影响霉菌和酵母菌产酒的作用,同时能抑制部分乳酸菌生长,以减少乳酸的过多生成。

表3 菌株LP16上清液的抑菌谱Table 3 Antimicrobial spectrum of the fermentation supernatant of strain LP16
3 结论
乳酸菌在发酵过程中能够产生乳酸、乙酸、H2O2、细菌素等天然活性抑菌物质,因此通过排除酸、过氧化氢的干扰和蛋白酶处理试验,确定了菌株LP16产生的抑菌物质具有蛋白质属性,是一种细菌素。同时,通过形态学观察、生理生化鉴定和16S rRNA序列分析,确定该产细菌素菌株LP16为副干酪乳杆菌(Lactobacillusparacasei)。
细菌素生物学特性研究显示,菌株LP16所产细菌素具有良好的热稳定性,在121 ℃高温高压处理20 min仍有较高抑菌活性;同时也具有宽泛的酸碱耐受性,但是必须在酸性环境中才有抑菌效果。抑菌谱测定显示菌株LP16对部分革兰氏阳性菌和革兰氏阴性菌有抑菌效果,也对部分乳酸菌有抑菌效果,但对霉菌和酵母菌等真菌没有抑菌效果。浓香型白酒发酵过程中窖池温度控制在25~35 ℃以及低pH下,而霉菌和酵母菌是发酵不同时期的优势菌株,有利于产酒[3,25-26],因此,副干酪乳杆菌LP16产生的细菌素能在窖池中发挥一定抑菌作用抑制有害菌的生长,而不影响霉菌和酵母菌发挥产酒作用。浓香型白酒中乳酸乙酯的过多生成会影响酒的口感,菌株LP16产生的细菌素能抑制部分乳酸菌的生长,使乳酸的生成减少,为控制乳酸乙酯的产生提供理论思路。
