缺血后处理对糖尿病大鼠脑缺血再灌注后脑组织SOCS-3及TNF-α表达的影响
2019-03-28
糖尿病的发病率已呈现逐年上升的趋势,作为脑梗死的独立危险因素之一,有研究表明,糖尿病和(或)高血糖状态会使脑缺血再灌注(I/R)损伤进一步加重,但具体机制尚不明确[1]。缺血后处理(IP)作为一种新干预策略诱导缺血耐受,在脑缺血早期给予短暂的I/R处理,可明显减轻脑组织损伤,具有重要的内源性神经保护[2]。但是至今IP对脑I/R损伤的作用和机制,尤其是在合并糖尿病的脑I/R损伤中的具体机制仍未阐明。炎症负性调控细胞因子信号转导抑制因子3(SOCS-3)作为一种神经保护标志物,对肿瘤坏死因子α(TNF-α)等在内的多种炎性细胞因子起着负性调控作用,其在脑I/R损伤中的表达及作用机制是近年来研究的热点[3]。故本实验通过建立糖尿病大鼠局灶性脑I/R模型,观察IP对SOCS-3、TNF-α表达水平的影响,以进一步探讨其可能的作用机制。
1 对象与方法
1.1 研究对象 (1)实验动物及分组:选用115只健康雄性SD大鼠,体质量160~180 g,由西南医科大学实验动物中心提供。将其随机分为2组:糖尿病组(105只)及普通组(10只)。建立糖尿病模型后,将糖尿病大鼠随机分为sham组、I/R组和IP组各35只,各组以脑缺血90 min再灌注后的不同时间点(3 h,6 h,12 h,24 h,48 h,72 h)分为6个亚组,除24 h组为10只(其中5只用于TTC染色测定脑梗死体积)外,其余每个亚组5只。(2)主要试剂:链脲佐菌素(STZ,美国Sigma公司);兔抗大鼠SOCS-3多克隆抗体、兔抗大鼠TNF-α多克隆抗体(美国 BIoworld公司);DAB显色剂(北京中杉金桥生物技术有限公司)。
1.2 研究方法 动物模型制备:普通组予以普通饲料喂养,糖尿病组参考林心君等[4]的高脂高糖配方饲料予以喂养4周,进行2次STZ腹腔注射[25 mg/(kg·m2),间隔2 d],制备糖尿大鼠病模型。经10%水合氯醛腹腔注射麻醉大鼠,成功后将其仰卧固定于解剖架上,充分并暴露颈部组织。I/R组依照改良Longa[5]法制作大鼠右侧大脑中动脉I/R模型,缺血90 min后轻拔出栓线实施再灌注;IP组采用孙静等[6]的方法,于缺血90 min后拔出栓线5 mm,进行灌注15 s/闭塞15 s,重复3次后拔出拴线实现永久灌注。sham组仅暴露右侧颈总动脉及分叉处,不行线栓,其余步骤同手术组。大鼠造模清醒后根据Longa[5]的评分原则评价造模是否成功,不符合标准的予以剔除,再后续补足。
1.3 观察指标
1.3.1 神经功能缺损评分:在缺血再灌注术后各时间点,依据Garcia[7]原则对大鼠神经功能进行评分,18分为最高分,3分为最低分,得分越低则神经功能障碍越重。
1.3.2 TTC染色测定术后24 h脑梗死体积:选取各组术后24 h大鼠(5只)予以麻醉处死,立即断头取脑,并去除低位脑干及小脑,冠状切片约(2 mm)行TTC避光染色,正常脑组织为红色,梗死脑组织为苍白色。对各切片拍照后用Image Pro Plus 5.1图像分析处理图片,以公式V=(A1+…+An)t/2测定脑梗死体积,其中t为切片厚度(mm),A为梗死体积(mm3)。
1.3.3 免疫组织化学法检测脑组织SOCS-3、TNF-α的表达:各组大鼠分别于造模后不同时间(3 h,6 h,12 h,24 h,48 h,72 h)予以麻醉处死,立即断头取脑,并去除低位脑干及小脑。将所取新鲜脑组织于4%的多聚甲醛中固定,石蜡包埋,切片(厚3μm),置于载玻片上,4 ℃保存。将备用切片参照试剂盒具体说明进行操作,于400倍高倍镜下观察,胞质、胞核呈棕黄色为SOCS-3、TNF-α表达阳性的细胞,分别选取5个不重复视野进行阳性细胞计数,取平均值。
1.3.4 TUNEL法检测神经元凋亡细胞表达:将备用切片参照TUNEL染色试剂盒具体说明进行操作,于400倍高倍镜下观察,胞核呈棕色为阳性凋亡细胞,分别选取5个不重复视野进行阳性细胞计数,取平均值。
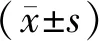
2 结果
2.1 糖尿病模型 参考林心君等[4]的糖尿病大鼠成模标准:随机血糖≥16.7 mmol/L和(或)2次禁食血糖(FBG)≥11.1 mmol/L,测大鼠尾静脉血糖浓度,糖尿病组比普通组大鼠显著增高(P<0.05),表明糖尿病大鼠造模成功。
2.2 神经功能缺损评分 sham组无神经功能缺损症状,I/R组和IP组再灌注后不同时间点神经功能评分均低于sham组(P<0.05),与I/R组比较,IP组各时间点评分显著增高(P<0.05),且2组神经功能缺损评分均在24 h时最低。见表1。
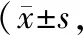
表1 各组不同时间点神经功能缺损评分比较分,n=5)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05
2.3 术后24 h脑梗死体积 根据TTC染色结果,sham组中未见梗死灶,I/R和IP组均可见苍白色梗死灶,且IP组梗死灶体积较I/R组显著减小[(163.60±12.10) mm3比(198.20±9.73) mm3,P<0.05]。
2.4 各组大鼠脑组织SOCS-3和TNF-α的表达 根据免疫组化检测结果,SOCS-3和TNF-α在sham组中可见微量表达,但无动态变化,其在I/R组中的表达于3 h开始升高,24 h达高峰,之后逐渐下降,在72 h仍有少量表达,IP组表达趋势与I/R组相同,但IP组中各时间点SOCS-3表达较I/R组明显升高(P<0.05),TNF-α表达较I/R组明显降低(P<0.05),且I/R和IP组各时间点表达均高于sham组(P<0.05)。见表2,3。
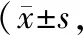
表2 各组不同时间点脑组织SOCS-3阳性细胞数比较个/视野,n=5)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05

表3 各组不同时间点脑组织TNF-α阳性细胞数比较个/视野,n=5)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05
2.5 各组大鼠凋亡细胞表达 根据TUNEL法检测结果,sham组仅见极少的凋亡细胞,I/R组中凋亡细胞于3 h开始升高,24 h达高峰,之后逐渐下降;IP组中表达趋势与I/R组相似,但IP组各时间点较I/R组表达明显减少(P<0.05);且I/R和IP组中各时间点凋亡细胞表达均较sham组显著升高(P<0.05)。见表4。
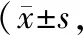
表4 各组不同时间点脑组织凋亡细胞数比较个/视野,n=5)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05
3 讨论
糖尿病是一组由遗传及环境等多因素引起的,以高血糖为特征的代谢性疾病。作为临床多发病、常见病,糖尿病与脑缺血损伤密切相关,临床研究证实,糖尿病不但能诱发脑缺血,而且会使脑缺血损伤进一步加重,糖尿病合并脑缺血病人预后更差[8], 故本实验以糖尿病大鼠为基础建立脑I/R模型更符合脑缺血的自然发病进程。恢复血流是脑缺血的治疗原则,但血流恢复后会造成不可避免的I/R损伤。Zhao等[9]研究结果显示, 在脑I/R时行IP,脑梗死体积及神经元凋亡显著减少,可实现缺血保护作用。本实验参考孙静等[6]的脑I/R模型,反复3次的再灌注15 s/缺血15 s为IP发挥神经保护的最佳时间,经反复预实验,这种IP措施能产生神经保护作用。
脑I/R损伤是多机制参与的病理生理过程,包含炎症反应、自由基生成、细胞凋亡等,其中炎症级联反应起着重要的作用。TNF-α是一种前炎性反应因子,具有细胞毒性和促炎性作用,是脑缺血损伤转向炎症损伤的核心基础。在脑I/R时,炎症反应被激活,TNF-α等大量炎性细胞因子释放,激发血管内皮细胞释放舒缩血管活性物质,破坏血脑屏障,造成神经元损伤,同时还可启动炎性级联反应,进一步加重I/R损伤,故抑制炎性因子的表达对减轻脑I/R损伤有重要意义。SOCS-3作为一种内源性抑制因子,通过抑制JAK/STAT途径,对TNF-α等大量炎性因子的信号转导起负性调控,可达到抑制炎性因子表达及细胞凋亡的作用。
Bate等[10]的研究发现,在脑缺血侧脑组织呈现SOCS-3 mRNA高表达,并在12 h达高峰,在24 h仍有一定表达。Raghavendra等[11]的研究发现,若反义减少SOCS-3的表达,梗死体积明显增高,神经功能缺损加重。而予以腺病毒载体过度的SOCS3表达后,梗死体积明显缩小[12]。故认为SOCS-3在I/R损伤中起保护作用。本实验结果与以往研究基本相同,发现I/R后SOCS-3表达增高,IP能上调其表达。Yin等[13]研究发现,缺血侧脑组织TNF-αmRNA在24 h出现高峰,随后逐渐下降。He等[14]研究发现,在大鼠脑I/R后3 h,TNF-α开始表达并在24 h达高峰,减少其表达或抑制其活性可减轻脑损伤,提示TNF-α可能与脑I/R损伤有关。且在此之前有学者在脑I/R模型中用TNF-α抗体中和TNF-α后,大鼠神经功能缺损有明显改善[15]。本实验研究结果显示,I/R后TNF-α表达增高,IP能减少其表达,与上述文献报道相符,而且TNF-α与SOCS-3变化趋势相同,说明脑IP可通过内源性神经保护机制上调SOCS-3表达,减少TNF-α表达,减轻炎症反应。同时TUNEL法测得凋亡细胞结果显示,I/R 组在3 h 可检测到凋亡细胞的表达,随着再灌注时间延长,凋亡细胞表达增多,于24 h 达到高峰,IP组凋亡细胞的表达明显减少,结合上述 TNF-α的表达可发现,凋亡细胞表达趋势与 TNF-α趋于一致,且24 h梗死体积测定结果显示,IP组梗死体积较I/R组明显缩小,说明在I/R后TNF-α等炎性因子表达增加,可通过激活JAK/STAT通路,引起组织损伤及细胞凋亡,同时I/R损伤本身也增加SOCS-3表达,抑制炎症反应,IP通过增加SOCS-3表达,负性调节JAK/STAT通路,减少TNF-α过量表达,从而抑制脑组织炎症反应,减少细胞凋亡,缩小梗死体积,达到脑保护作用。
综上所述,TNF-α在脑I/R中起重要作用,IP可通过增加SOCS-3表达抑制TNF-α表达,从而激发内源性脑保护,减轻脑I/R损伤。但由于本实验采用糖尿病大鼠制作脑I/R模型,与既往相似研究相比炎性因子表达较高。有研究发现,糖尿病会使脑内毒性物质蓄积、脑I/R损伤中重要蛋白表达改变以及内源性保护性物质生成减少,可使脑组织在诱发缺血耐受时,达不到产生缺血耐受的阈值而弱化脑IP保护作用[16-17],但具体机制尚不清楚,还有待进一步研究。
