口腔鳞状细胞癌中MAFbx基因的表达和甲基化状态及其临床意义
2019-03-27张素欣段玉芹李天客
尹 克 张素欣 段玉芹 陈 中 李天客
口腔鳞状细胞癌(OSCC)是最常见的头颈部恶性肿瘤之一,具有较强的侵袭性,常导致局部浸润或早期淋巴结转移[1],且约60%的头颈部癌症患者就诊时已到中晚期,致死率较高[2]。因此,OSCC 的早期诊断及治疗对于患者的生存和发展及术后生活质量的提高至关重要。研究[3~5]表明,MAFbx 可能具有潜在的肿瘤抑制功能,可以作为组蛋白甲基转移酶(EZH2) 抑制剂诱导乳腺癌细胞凋亡。卵巢癌细胞MAFbx 的表达失活可能与其启动子区甲基化有关。但是在OSCC 中关于MAFbx基因的作用及甲基化状态的研究尚未见报道。本研究通过检测OSCC 及相应癌旁组织中MAFbx基因表达及甲基化状态,分析其表达与甲基化的相关性,探讨MAFbx在OSCC发生及发展中的作用及其与患者预后的关系,为OSCC 患者的靶向治疗提供新思路。
材料和方法
1.临床资料:随机选取本院2010~2012年间的OSCC 患者手术切除标本,共53 例。上述标本均经病理证实为口腔鳞癌组织和相应的正常口腔黏膜。每例标本均为术后半小时内采集完成,液氮保存用于DNA 和RNA 的提取。其中男性31例,女性22例,年龄37~76 岁,中位年龄61 岁。吸烟25 例,不吸烟28 例;饮酒25例,不饮酒28例;Ⅰ期5例(9.43%),Ⅱ期30例(60.38%),Ⅲ期14 例(26.42%),Ⅳ期4例(7.55%);有淋巴结转移34例(64.15%),无淋巴结转移19例(35.85%)。本研究中所有研究对象签署知情同意,并经医院伦理委员会通过。上述病例以患者术后出院为观察起点,结合复诊病历,利用电话、电子通讯等手段对患者及其家属进行随访,随访截止于2017年12月。
2.主要试剂:RPMI 1640 培养液、胰酶(美国Gibco公司),5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycytidine,5-Aza-dC)(Sigma公司);蛋白酶K(Merck公司);DNA 亚硫酸氢盐纯化试剂盒(德国QIAGEN 公司);组织RNA 提取试剂盒(天根生化科技有限公司);逆转录试剂盒(Invitrogen 公司);本研究所用引物均在北京赛百盛公司合成。
3 细胞培养:SCC-15和OC3细胞购自ATCC 细胞库,用含有10%胎牛血清的RPMI 1640 培养,置于5% CO2的培养箱常规培养。取待细胞处于对数生长期时,加入5-Aza-dC(终浓度10μmol/L)作为实验组,以未经5-Aza-dC 处理的细胞作为对照组。加药后继续培养细胞48h,其中每24h 更换培养液,之后换全血清培养基继续培养24h 后收集细胞并提取DNA 及RNA。
4.RT-qPCR 检测口腔癌细胞系及OSCC 组织中MAFbx 的表达:按TRIzol 试剂说明书提取细胞系中的RNA,按照组织RNA 提取试剂盒说明书提取53例组织中的总RNA,并参照逆转录试剂盒说明书将RNA 逆转录成cDNA。用于检测MAFbx 表达的引物为:上游:5’-AAGTCTGTGCTGGTCGGGAA-3’,下游5’-AGTGAAGGTGAGGCCTTTGAAG-3’(产 物123bp);内参照GAPDH 的引物序列为:上游5’-AGGTGAAGGTCGGAGTCAACG-3’,下 游 5’-AGGGGTCATTGATGGCAACA-3’(产 物226bp)。qPCR 反应条件:94℃预变性1min;94℃变性30s,58℃退火30s,72℃延伸30s,共40 个循环。以2-ΔΔCt表示MAFbx基因的相对表达量,ΔCt =CtmRNA-CtGAPDH,ΔΔCt=ΔCt病例组-ΔCt对照组。
5.BS-MSP 法检测MAFbx 甲基化:采用常规酚/氯仿法提取5-Aza-dC 处理前后口腔癌细胞系和OSCC 患者组织的基因组DNA,按照亚硫酸氢盐转化试剂盒,每个样本中均取2μg DNA,进行亚硫酸氢盐转化。运用UCSC (University of California Santa Cruz)基因序列数据库和Genebank 结合进行序列检索,在线软件Methprimer 预测基因CpG 岛分布情况,发现在MAFbx基因启动子及部分第一外显子区存在两个CpG 岛。本研究应用BS-MSP 对启动子区CpG 岛进行甲基化分析。并结合引物设计软件设计第一轮PCR 引物,上下游引物序均不含有CG位点。在此片段范围内设计MSP 引物,引物扩增范围分别为:-475bp 到-288bp。以第一轮扩增片段为模板加入MSP 引物再进行扩增。第一轮PCR 引物序列为:上游:5'-TTGGTTAGTGATAGTTAAGG-3';下游5'-TAACTTTATTTATAAACT-3'(产物519bp)。MSP引物序列为:甲基化引物序列:上游5'-TTAGTTTTGCGGACGGTTCGGGAGG-3',下游5'-ACGCTTAAAAAAATACGCCCCGATC-3'(产物188bp); 非甲基化引物序列:上游5'-TTAGTTTTGTGGATGGTTTGGGAGG-3',下游5'-ACACTTAAAAAAATACACCCCAATC-3'(产物188bp)。PCR 反应条件为:95℃预变性10min 后,95℃变性45s,退火45s,72℃延伸1min,35 个循环后,72℃延伸7min。阳性对照选用经甲基化酶(Sss I)处理的基因组DNA,灭菌双蒸水取代DNA 模板进行PCR 作为阴性对照。并随机选取10%标本进行重复。
6.统计学处理:采用SPSS 软件包(22.0版)进行数据统计学分析。计量资料采用t检验,以表示;计数资料采用检验和校正检验;相关性分析采用spearman 分析,均为双侧检验。预后分析采用Kaplan-Meier 生存曲线。以P<0.05或P<0.01 表示差异有统计学意义。
结 果
1.口腔癌细胞系中MAFbx 的表达及甲基化状态(图1):5-Aza-dC 处理前后SCC-15 和OC3 细胞中MAFbx 的相对表达量分别为(0.265±0.021 vs 0.534±0.015)和(0.094±0.001 vs 0.455±0.039),差异均有统计学意义(P<0.05)。5-Aza-dC 处理前2种OSCC 细胞系中MAFbx基因均有甲基化条带扩出,经过5-Aza-dC 处理后,OC3 细胞系中MAFbx甲基化程度降低,非甲基化程度增加,SCC-15 细胞系中MAFbx 表现为非甲基化状态。
2.OSCC 组织及相应癌旁组织中MAFbx基因的mRNA 的相对表达量(图2,表1):OSCC 组织中MAFbx 的相对表达量为(1.000±0.001),显著低于癌旁正常组织(1.813±0.392)差异有统计学意义(t=-12.973,P<0.01)。
该基因的表达量与患者的TNM 分期[t=3.019,P<0.01)]和淋巴结转移[t=-3.231,P<0.01)]有关,而与患者的性别、年龄、吸烟、饮酒无关(P>0.05)。

图1 OSCC 细胞系中MAFbx基因mRNA 表达(A)及甲基化状态(B)
3.MAFbx在OSCC 组织中的表达与患者预后的关系(图3):对53 例OSCC 患者进行随访,共8 人失访,失访率为15.1%。结果表明,MAFbx 低表达组(与癌旁组织相对表达量相比低于2 倍者为低表达)患者生存率为17.6%(28/34),平均生存时间为(30.79±3.01)个月;MAFbx 高表达组患者生存率为47.4%(10/19),平均生存时间为(47.73±4.48)个月。两组生存率与生存时间比较差异有统计学意义(χ2=7.642,P<0.05;t=-2.653,P<0.05)。
4.OSCC 组织和相应癌旁正常组织中MAFbx基因启动子区的甲基化状态(图4,表1):OSCC 组织中甲基化率为64.15%(34/53),显著高于其对应的癌旁组织24.53%(13/53)(χ2=16.858,P<0.01)。分析53 例OSCC 患者的各临床病理参数发现,该基因启动子区的甲基化状态与患者的TNM 分期和淋巴结转移有关(P<0.05),而与患者吸烟、饮酒、性别及年龄无关(P>0.05)。

图2 RT-qPCR 法检测OSCC 组织中MAFbx基因的mRNA 表达

表1 OSCC组织中MAFbx基因表达水平及甲基化状态与患者临床病理资料的关系
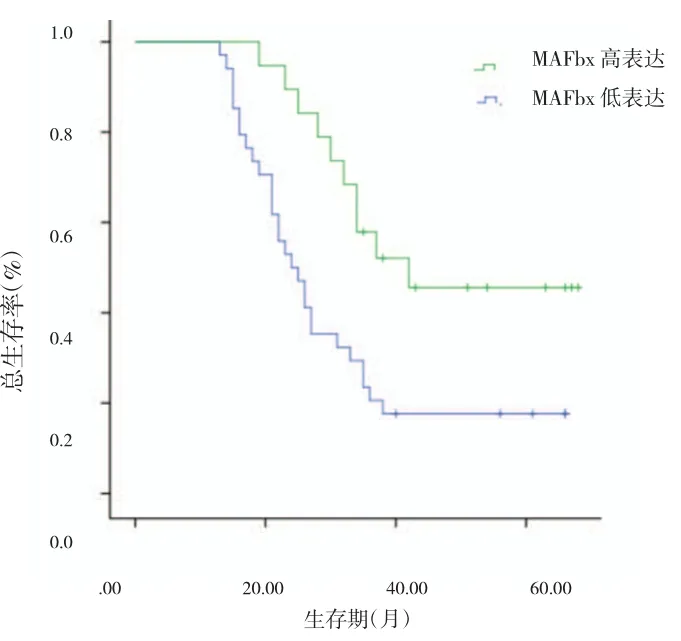
图3 MAFbx高表达组和低表达组患者的生存曲线
同时,53 例OSCC 组织中,发生MAFbx 甲基化的组织中其mRNA 相对表达量显著低于未发生甲基化的组织[(0.054±0.033)vs(0.090±0.047),t=2.948,P<0.01]。

图4 BG-MSP法检测OSCC组织中MAFbx基因甲基化状态
讨 论
MAFbx(也称为atrogin-1)是F-box 蛋白家族的成员,最初被鉴定为肌肉特异性F-box 蛋白,并且构成参与肌肉萎缩的蛋白连接酶复合物,在泛素化和靶蛋白活化或降解中起关键作用[6,7]。该基因定位于人染色体8q24.13,v-akt 鼠胸腺瘤病毒致癌基因(蛋白激酶B,AKT)信号通路对MAFbx 具有负向调节作用,且MAFbx 可能作为一种新型细胞凋亡调节因子,在多种肿瘤中表达沉默,促进肿瘤的发生[8,9]。
近年来研究表明,MAFbx 启动子区甲基化可能是导致其表达沉默的重要机制之一,在肿瘤的发生发展过程中起重要作用[10]。DNA 甲基化作为人体中表观遗传事件之一,其甲基化模式的改变可能在肿瘤发生中起重要作用[11,13]。研究发现,异常的DNA甲基化是肿瘤发生过程中最早的分子事件之一,在正常细胞向肿瘤细胞转化的过程中就可以被检测到并且在某些条件下还可以被调节或逆转[12]。因此,基因的异常DNA 甲基化检测可能在恶性肿瘤早期筛查中具有潜在的应用价值。
Chou 等[14]在对卵巢癌的研究中发现,MAFbx在卵巢癌细胞系中表达缺失,其在卵巢癌中低表达可能与其DNA 启动子区异常高甲基化有关;MAFbx高甲基化与晚期卵巢癌患者预后不良有关;MAFbx低表达可能增加卵巢癌细胞对顺铂的耐药性。在对乳腺癌、结肠癌及食管癌的研究中,MAFbx基因启动子区甲基化是导致其表达沉默的重要抑制机制[15~17]。Guo 等[17]的研究发现,MAFbx在食管癌中甲基化率高达52.27%,其启动子区甲基化与患者预后不良有关。本研究结果显示MAFbx在OSCC 细胞系及组织中的表达显著下调,且MAFbx 低表达与OSCC 患者不良预后有关。同时我们在编号为GSE38823 的表达谱芯片中发现5-Aza-dC 处理SCC-15 细胞系后,MAFbx基因的表达较处理前上调。因此,本研究组推测MAFbx基因在OSCC 表达下调可能与DNA 甲基化有关,并可通过甲基化转移酶抑制剂处理后发生逆转。本研究中选取口腔鳞癌系SCC-15 和OC3,应用5-Aza-dC 处理后发现MAFbx 的mRAN 表达显著上调。为了降低甲基化检测的假阳性率,我们还应用BG-MSP 的方法进一步验证OSCC 细胞系及OSCC 组织中的甲基化情况,结果显示MAFbx在OSCC 组织中呈高甲基化状态,应用5-Aza-dC 处理后细胞中呈现非甲基化状态,提示甲基化可能是该基因在OSCC 中表达失活的重要机制之一。
此外,MAFbx 作为一种E3 泛素连接酶,参与EMT 相关的分子标志物表达和潜在的表型变化过程[7]。在乳腺癌中,MAFbx基因可以靶向抑制KLF4,从而抑制肿瘤细胞体外生长和增殖[18]。MAFbx 过表达可以显著增强5-FU 诱导的AGS/5-FU 和SGC-7901/5-FU 细胞凋亡,增加两种胃癌细胞系对药物的敏感性[19]。因此,对于该基因在OSCC 发生中作用机制的研究,可能为OSCC 的治疗及预后评估提供新的分子靶点。
