金属蛋白酶家族系主要基因位点多态性与缺血性脑血管病的相关性分析
2019-03-27,,,,
,,,,
基质金属蛋白酶(metalloprotease,MMPs)是一组含可降解细胞外基质(ECM)的蛋白酶,导致血管内结构蛋白含量改变及血管重构。MMPs破坏血管基质和脑血管完整性进而损伤血脑屏障,导致脑损伤进一步加重,其认为是脑血管病发病过程重要的因子[1]。近期有学者研究发现,MMP-9不同基因型对大动脉粥样硬化作用不同,Peigne等[2]研究结果显示:SNP(rs391242,C-1562T)T纯合子及杂合子较C/C纯合子更能诱导proMMP-9合成,增强MMP-9活性,通过血管重构增加脑动脉硬化程度,同时发现T纯合子及杂合子人群与C/C纯合子人群相比动脉僵硬度显著增加,桡动脉及颈动脉收缩压及脉压显著升高。本研究分析不同组别病人MMP-1/C-161T、MMP-9/C1562T和MMP-3启动子SNP-1171基因型和等位基因频率的相关性。
1 资料与方法
1.1 一般资料 选取2016年3月—2017年3月于我院就诊的短暂性脑缺血发作(TIA)病人100例作为TIA组,同时选取脑梗死病人100例为卒中组。同时纳入我院健康体检者100名为对照组。TIA组,男56例,女44例;年龄45~62(53.1±12.3)岁;卒中组,男58例,女42例;年龄47~69(54.1±12.9)岁;对照组,男52名,女48名;年龄44~71(55.1±11.8)岁。3组一般资料比较,差异无统计学意义(P>0.05)。
1.2 各组纳入及排除标准 TIA组纳入标准:①符合TIA诊断标准;②年龄>40岁;③排除其他脑部血管性疾病、恶性肿瘤、自身免疫性疾病等。TIA诊断标准:局部神经症状和体征发病24 h内(多数1 h内)完全消失;发作急速(2~3 min);符合TIA发作时神经系统的症状和体征。卒中组纳入标准:①临床表现符合急性脑血管病;②发病2周之内;③头颅CT、MRI确诊为急性脑血管病;④既往无明确脑血管病史;⑤年龄≥40岁;⑥排除其他脑部血管性疾病、恶性肿瘤、自身免疫性疾病等。对照组纳入标准:①年龄≥40岁;②排除脑血管病、恶性肿瘤、其他自身免疫性疾病等。
1.3 MMP-1、MMP-3和MMP-9基因型测定方法 MMP-1基因型测定,①DNA提取与扩增:采用酚-氯仿抽提法由外周血有核细胞提取基因组DNA,运用聚合酶链式反应(PCR)扩增PPAR-γ2基因Pro12Ala多态性片段。上游引物序列(F):5′-CAAGCCCAGTCCTTTCTGTG-3′;下游引物序列(R)5′-AGTGAAGGAATCGC TTTCCG-3′。反应条件:95 ℃预变5 min,95 ℃变性45 s,54 ℃退火30 s,72 ℃延伸40 s,35个循环,末次循环72 ℃ 7 min。反应在PCR扩增仪上完成(美国Bio-Rad生产)。②多态性检测:采用聚合酶链式反应-限制性片段长度多态性分析(PCR-RFLP)方法,PCR产物纯化后经限制性内切酶HpaⅡ(美国Promegar公司生产)酶切,酶切位点为C/C GG。37 ℃水欲酶解4 h,经8%非变性聚丙烯酰胺凝胶电泳,EB染色后读取基因型。MMP-3基因型测定:MMP-3基因rs3025058位点基因新包括5A纯合子、6A纯合子、5A/6A杂合子。基因型检测方法同上。上游引物序列(F):5′-CTTCCTGGAATTCACATCACTGCCACCACT-3′;下游引物序列(R)5′-TTCCCCCATEAAAGGAATGGAGAACC-3′。MMP-9基因型测定,①基因组DNA的提取:取EDTA抗凝血3 mL,采用饱和酚-氯仿法提取外周血白细胞基因组DNA。②MMP-9基因C21562T多态性检测:应用PCR-RFLP技术。引物序列参考文献设计,由上海生化生物工程公司合成,上游引物:5′-GCCTGGCACATAGATGGCCC-3′;下游:5′-CTTCCTA GCCAGCCGGCATA-3′。PCR反应体系:基因组DNA100 ng,KCl 50 mmol/L, tris-HCl 10 mmol/L,pH 8.3,MgCl22.5 mmol/L、dNTP 0.25 mmol/L、TaqDNA聚合酶1 U,上下游引物各0.5 mol/L。PCR反应条件:95 ℃预变性5 min,95 ℃变性20 s,50 ℃退火30 s,72 ℃延伸40 s,进行35个循环,最后一次循环结束后72 ℃延伸7 min。PCR反应产物用Sph I酶切,37 ℃消化过夜,酶切产物行3.0%琼脂糖凝胶电泳,溴化乙啶染色,紫外灯下观察结果、摄片。所有参与研究对象均签署知情同意书。
1.4 统计学处理 采用SPSS 20.0统计学软件进行数据分析,计数资料采用Fisher′s检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组MMP-1/c-161T基因型和等位基因频率比较 在C-161T位点上,野生CC组,杂合子CT及突变纯合TT上TIA组和卒中组与对照组比较,差异有统计学意义(P<0.05);TIA组和脑卒中组等位基因上C基因频率显著高于对照组(P<0.05)。详见表1、图1。
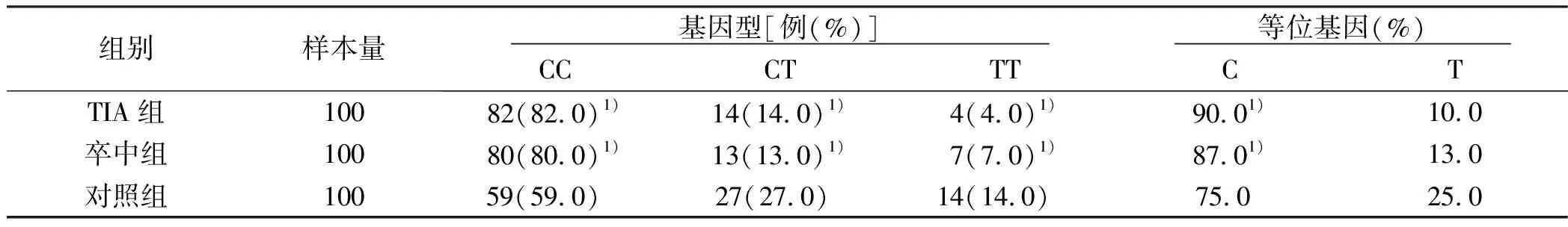
表1 3组MMP-1/c-161T基因型和等位基因频率比较
与对照组比较,1)P<0.05

注:M为模板DNA;1、2为CC纯合性;3、4为CT杂合性;5、6为TT纯合型
2.2 3组MMP-9/C1562T基因型和等位基因频率比较 3组纯合型CC、杂合子(CT)和纯合突变型TT3种基因型比较,差异无统计学意义(P>0.05);3组等位基因分布比较,差异无统计学意义(P>0.05)。详见表2、图2。
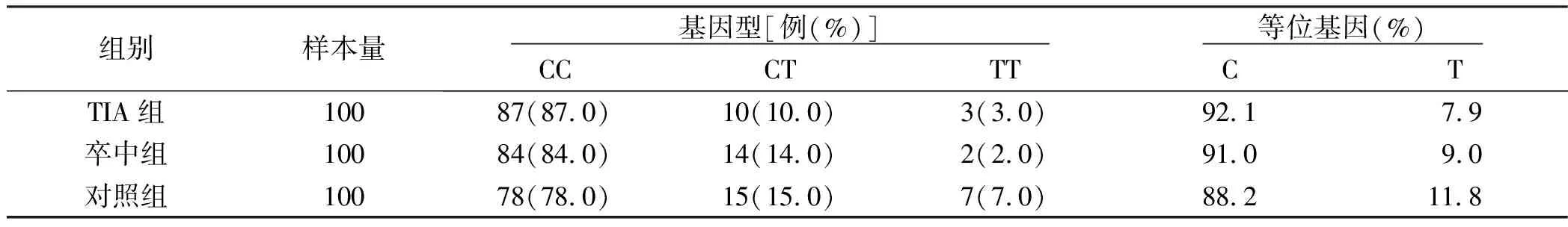
表2 3组MMP-9/C1562T基因型和等位基因频率比较

注:M为模板DNA;1-4、6为CC基因型;5为CT基因型;7为TT基因型
2.3 3组MMP-3启动子SNP-1171基因型和等位基因频率比较 3组MMP-3启动子SNP-1171在rs3025058点位上三种基因型(5A/5A、5A/6A和6A/6A)比较,差异无统计学意义(P>0.05);等位基因频率比较,差异无统计学意义(P>0.05)。详见表3、图3。
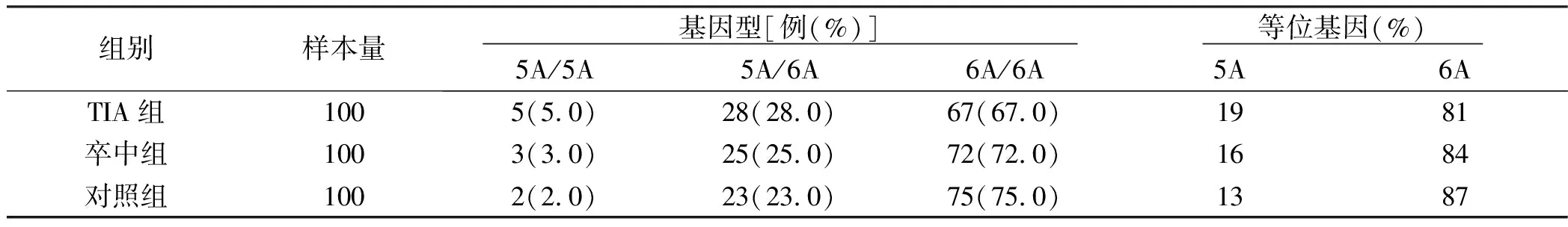
表3 3组MMP-3启动子SNP-1171基因型和等位基因频率比较
注:2、3、4、7和9为6A/6A纯合子;5和6为5A/6A为杂合子;8为5A/5A纯合子
3 讨 论
在我国,随着老龄化社会的到来和生活方式的改变,脑血管病已成为第一位致死原因[3]。MMPs是一组能降解ECM的蛋白酶,根据结构和底物特异性不同分为间质胶原酶(MMP-1、MMP-2、MMP-13、MMP-18)、Ⅵ型胶原酶、明胶酶(MMP-2、MMP-9)、基质溶解素(MMP-3、MMP-7、MMP-10)等,与脑血管病发病密切相关[4]。由于MMPs可导致血管重构,认为在血管疾病发生、发展及转归过程中发挥重要作用。近年来,MMPs特别是MMP-9在脑缺血损伤作用日益受到重视[5]。由于MMPs能破坏血管基质和血管的完整性,损伤血脑屏障,导致脑损伤进一步加重,认为是脑血管病发病过程的重要因子[6-7]。MMP-3是MMP家族中的一种关键酶,能影响其他MMPs的活性和作用,在保持大血管内基质稳态方面发挥重要作用[8],其单核苷酸多态性研究表明,SNP(rs3025058,5A/6A)与冠状动脉粥样硬化程度及心肌梗死的危险性密切相关[9-10]。有报道显示,MMP-1是金属蛋白酶家族表达相对较高的肠胶原酶,能降解人体内丰富的Ⅰ型和Ⅲ型胶原组织。动物研究显示,该基因可加快动脉粥样硬化过早进入不稳定状态[11-13]。本研究结果可见,TIA组和卒中组与对照组MMP-1/c-161T基因型和等位基因频率情况比较,差异有统计学意义(P<0.05);TIA组和卒中组与对照组MMP-9/C1562T基因多态性和基因频率比较,差异无统计学意义(P>0.05)。分析该基因与缺血性脑血管疾病可能不存在相关性,该结果有待进一步研究。相关资料显示,MMP-9与血管弹性密切相关,认为管腔内压力高诱导MMPs直接参与颈动脉粥样硬化的加重过程,MMP-9在高血压病早期血管重构中起重要作用[14-15]。本研究TIA组和卒中组与对照组MMP-3启动子SNP-1171基因型和等位基因频率比较,差异无统计学意义(P>0.05)。部分研究资料显示,血管组织MMP-3水平及蛋白水平在5A纯合子表达最高,在6A纯合子中表达最低,5A纯合子人群与5A/6A杂合子及6A纯合子相比,动脉粥样硬化程度显著增加,患高血压病的发病率明显增高[16-17]。该基因与缺血性脑血管病的相关性值得进一步研究和证实。
综上所述,MMP-1基因多态性可能与缺血性脑血管疾病相关,但本研究中未发现MMP-3和MMP-9基因多态性与缺血性脑血管病存在明显相关性,有待进一步研究。
