丙酮酸乙酯对缺氧缺血性脑损伤新生大鼠海马神经元凋亡及PI3-K/Akt信号通路的影响
2019-03-27,
,
缺氧缺血性脑损伤(hypoxic ischemic brain injury,HIBI)是新生儿死亡和神经功能缺损的常见原因[1-2]。0.1%~0.2%新生儿出现围生期窒息引起HIBI,约20%死亡,高达40%幸存者出现脑性麻痹、智力障碍或癫痫等[3]。已有研究证实,多种复杂病理事件,如细胞凋亡、炎症、氧化应激和缺氧缺血脑损伤后兴奋性毒性等均导致神经元死亡并引发神经功能障碍[4-5],细胞凋亡是HIBI神经细胞死亡的主要形式[6]。因此对凋亡发生机制及抗凋亡药物研究成为目前研究HIBI治疗的新方法。丙酮酸乙酯(ethyl pyruvate,EP)是丙酮酸酯的稳定亲脂性酯衍生物,具有抗氧化和清除自由基能力。已有研究提出EP通过多种机制,如炎症反应抑制、自由基清除、抗神经元凋亡等参与对HIBI神经损伤的保护作用,然而其保护作用所涉及相关机制及具体分子靶标有待阐明。本研究通过建立新生大鼠HIBI模型,探讨EP对HIBI新生大鼠海马神经元凋亡的影响,并探讨可能机制,以期为HIBI治疗提供依据。
1 材料与方法
1.1 实验动物及分组 昆明动物研究所提供新生7 d龄Wistar大鼠幼仔105只,体重(13.6±1.7)g,雌雄比例约1∶1。将大鼠随机分为3组,每组35只。假手术组(sham组)仅进行中位颈部切口,未进行缺氧缺血模型处理;模型组(HIBI组)根据动物模型制备方法进行缺氧缺血处理;丙酮酸乙酯处理组(EP组)于缺氧缺血处理30 min前进行3 mg/kg EP腹膜内注射[7]。EP购自Sigma-Aldrich,使用生理盐水配制溶液。
1.2 HIBI模型 根据参考文献[8],将大鼠用3%~4%异氟烷麻醉后,分离其左颈总动脉并进行6-0手术结扎。经2 h恢复期后,将幼仔置于37 ℃水浴密闭缺氧箱中,持续给予8%O2和92%N2混合气体进行缺氧处理2.5 h。
1.3 海马超微结构 缺氧缺血后24 h,每组取5只大鼠幼仔迅速断头处死。取出脑组织,于4 ℃先用2.5%戊二醛溶液处理,之后用1%锇酸固定,以乙醇和丙酮梯度脱水后,环氧树脂包埋,获得超薄切片后,进行乙酸双氧铀和硝酸铅双重染色,在透射电子显微镜下观察切片并拍照。
1.4 2,3,5-三苯基四氮唑-水合物(TTC)染色 缺氧、缺血后48 h,每组随机取6只大鼠断头处死后取出脑,置于4 ℃的0.15 mol/L磷酸缓冲盐溶液中冷冻5 min后,应用Rat Brain Matrix(Zivic Instruments,USA)由前极向后沿冠状面每隔2 mm取5个切片。将切片浸入溶解在0.15 mol/L磷酸缓冲盐溶液的2%TTC(Sigma-Aldrich,USA)中,室温孵育30 min,之后用4 ℃磷酸缓冲盐溶液冲洗2次,再用4 ℃ 10%甲醛溶液中避光固定。正常脑组织TTC染色为红色,梗死区域脑组织为白色,使用数码相机获得切片图像后,使用Image J软件测定梗死面积。以梗死面积占同侧脑组织总面积的百分比作为统计参数。
1.5 TUNEL检测 缺氧缺血后36 h,每组随机取8只大鼠断头处死后,取出脑在无菌条件下解剖海马,使用Mcllwain切片机(Science Products GmbH,Switzerland)将海马组织切成6 μm切片,于4%多聚甲醛中固定过夜,并在20%蔗糖磷酸缓冲盐溶液浸渍2 d后,于30%蔗糖磷酸缓冲盐溶液浸渍2 d,除去组织中的水分。根据制造商说明书,应用ApopTag®荧光素原位细胞凋亡检测试剂盒(EMDMillipore,S7110)通过使用末端脱氧核苷酸转移酶(TdT)修饰基因组DNA进行海马神经元细胞凋亡的原位检测。TUNEL标记后,用DAPI(1∶500 000,Abcam 104139)标记细胞核,并在激光扫描光谱共焦显微镜下进行检查。对3组海马组织TUNEL阳性运动神经元的平均数进行计数。
1.6 双重免疫荧光染色 在室温下将1.5中脑组织切片用含5%FBS和0.1%Triton X-100的PBS封闭2 h后。将切片在室温下与兔抗大鼠切割半胱天冬酶-3(cleaved caspase-3)多克隆抗体(1∶300)、大鼠抗神经元特异性核蛋白(NeuN)抗体(1∶300)于4 ℃孵育过夜。将切片用磷酸缓冲盐溶液洗涤3次,每次5 min,在相应二抗体(1∶500)中室温孵育2 h,之后用DAPI复染2 min。经过3次洗涤后,用Fluoromount G(Electron Microscopy Sciences,USA)盖上,并干燥过夜。使用ZEISS HB050倒置显微镜系统进行荧光显微镜成像,并由Image-Pro Plus 6.0软件处理。
1.7 免疫组织化学染色 缺氧缺血24 h后,每组随机取8只大鼠幼仔断头处死后取脑组织,在4%多聚甲醛中固定过夜。行常规脱水和石蜡包埋后,在大脑海马区域获得约4 μm厚度连续冠状切片,脱蜡、干燥后,于常温下保存,行海马磷酸化(p)-蛋白激酶(Akt)、Bcl-2免疫组织化学染色。DAB显色试剂盒购自上海基因科技有限公司,p-Akt、Bcl-2抗体购自Cell Signaling Technology。免疫组织化学阳性细胞计算方法如下:在光学显微镜下随机选择3个海马区域视野(放大倍数×400),拍摄数字图像并进行染色,根据视野内的平均光密度值(MOD)值进行计算。
1.8 蛋白免疫印迹 缺氧缺血24 h后,每组随机取8只大鼠幼仔断头处死后取脑组织,从左侧海马组织中提取总蛋白。使用补充有PMSF(Riche)的RIPA蛋白提取试剂裂解组织提取蛋白质。4 ℃下12 000 r/min离心10 min后,通过10%SDS-PAGE分离上清液,将分离的蛋白质转移到硝酸纤维素膜上。将膜在磷酸缓冲盐溶液和5%脱脂乳中封闭1h,并用兔抗大鼠p-Akt、Bcl-2单克隆抗体(1∶200)和内部对照兔抗大鼠GAPDH单克隆抗体(1∶200)4 ℃孵育过夜。将膜用HRP缀合的二抗在室温下孵育1 h。使用Quantity One软件(Life Technologies)评估相对蛋白表达水平。
2 结 果
2.1 3组大鼠海马超微结构变化 sham组神经元结构基本正常,神经元细胞核呈椭圆形,核染色质均匀分布;细胞可见线粒体、糙面内质网和高尔基体。HIBI组观察可见神经元气蚀变化,核不规则,核基质气蚀;细胞质中线粒体发生气蚀及肿胀,嵴断裂,细胞质基质、神经纤维均显示气蚀变化;轴突神经纤维出现明显断裂和溶解。EP组神经元核呈椭圆形,核内染色质分布均匀,线粒体稍有气蚀和裂缝;富含糙面内质网且排列规律。详见图1。
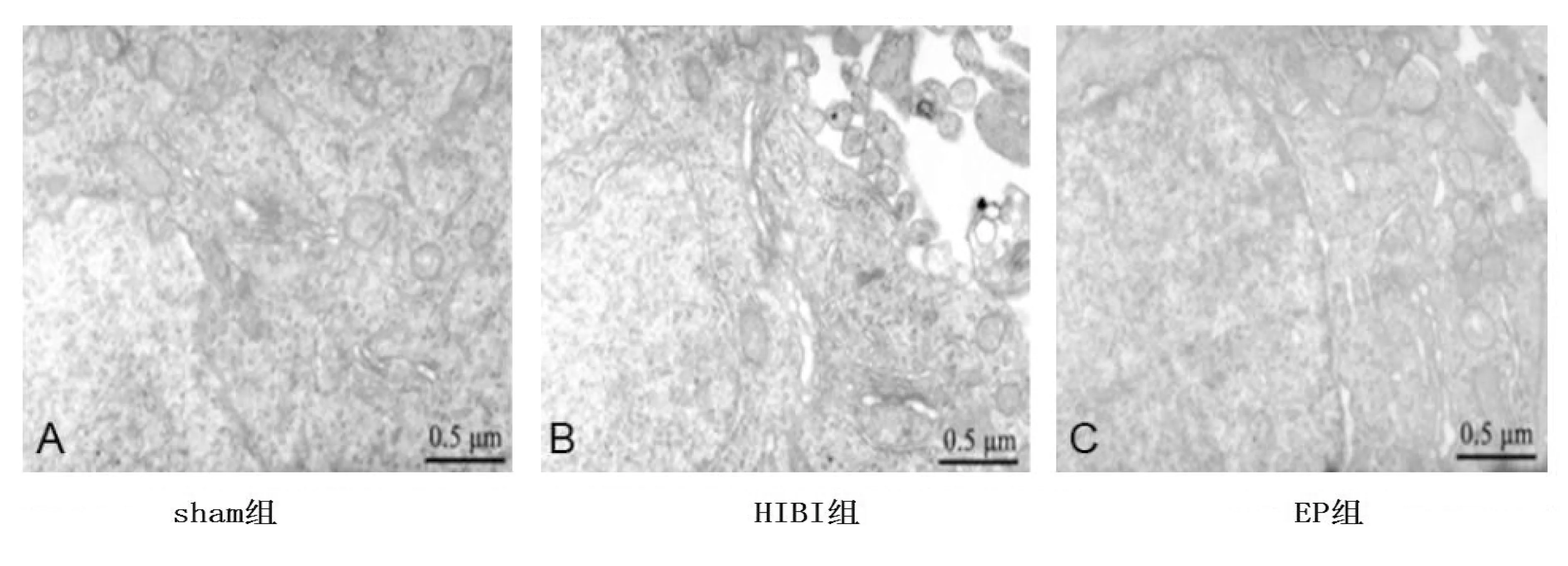
图1 3组海马超微结构变化(乙酸双氧铀和硝酸铅双染,20 000×)
2.2 EP处理改善HIBI损伤后新生大鼠脑梗死情况 应用TTC染色检查脑梗死面积,分析EP对脑组织损伤的影响。HIBI组大脑皮层、纹状体和海马等区域显示大片明显的白色梗死区域,表明HIBI组脑组织损伤,EP组脑组织损伤显著改善。详见图2 A。对脑组织梗死面积定量分析发现,与sham组比较,HIBI组梗死面积显著增加(P<0.05);与HIBI组比较,EP组梗死面积显著减少,差异有统计学意义(P<0.05)。详见图2 B。

与sham组比较,*P<0.05;与HIBI组比较,#P<0.05
2.3 EP处理改善HIBI损伤后新生大鼠海马神经元凋亡 TUNEL测定显示,细胞死亡的荧光斑点主要对应于神经元细胞体的分布,见图3 A。定量分析显示,sham组TUNEL阳性细胞极少,而HIBI组阳性细胞显著高于sham组,差异有统计学意义(P<0.05);与HIBI组比较,EP组阳性细胞显著降低(P<0.05),见图3 B。双重免疫荧光染色显示,HIBI导致神经元数量减少,NeuN/cleaved caspase-3共定位阳性细胞(黄色)比例增加;EP组NeuN/cleaved caspase-3共定位阳性细胞比例降低,见图3 C。定量分析显示,HIBI组双标记阳性细胞数显著高于sham组,差异有统计学意义(P<0.05);与HIBI组比较,EP组双标记阳性细胞数显著减少,差异有统计学意义(P<0.05),见图3 D。
2.4 海马p-Akt、Bcl-2的免疫组织化学染色 3组海马组织均观察p-Akt、Bcl-2蛋白阳性表达,且阳性染色均位于细胞质中。sham组大鼠海马神经细胞质p-Akt蛋白呈现弱阳性表达,且Bcl-2阳性细胞分布稀疏。HIBI组p-Akt蛋白阳性表达极弱,且Bcl-2阳性细胞数较少,染色浅,分布稀疏。EP组p-Akt和Bcl-2阳性表达均较强,Bcl-2免疫反应性颗粒集中分布,呈深染色。详见图4 A。比较3组MOD值可见,HIBI组p-Akt和Bcl-2的MOD值均高于sham组,但差异无统计学意义(P>0.05);与HIBI组比较,EP组p-Akt和Bcl-2的MOD值显著高于HIBI组,差异均有统计学意义(P<0.05)。详见图4 B、图4 C。
2.5 海马p-Akt、Bcl-2蛋白表达水平 蛋白免疫印迹显示,与sham组比较,HIBI组p-Akt和Bcl-2蛋白表达水平增加,但差异无统计学意义(P>0.05);与HIBI组比较,EP组p-Akt和Bcl-2蛋白表达水平显著增加,差异有统计学意义(P<0.05)。详见图5。

A:HIBI损伤后,TUNEL染色(绿色)和DAPI(蓝色)显微照片,刻度尺为200 μm。B:TUNEL阳性细胞(绿色)定量分析。C:代表性双重免疫荧光定位神经元(NeuN,绿色)和cleaved caspase-3(红色),箭头代表共定位细胞,刻度尺为100 μm。D:NeuN/cleaved caspase-3共定位阳性细胞(黄色)定量分析。与sham组比较,*P<0.05;与HIBI组比较,#P<0.05

A:大鼠海马组织p-Akt和Bcl-2蛋白免疫组织化学分析;B:海马组织p-Akt的MOD值;
C:海马组织Bcl-2的MOD值。与sham组比较,*P<0.05;与HIBI组比较,#P<0.05
图4免疫组织化学检测海马组织中p-Akt、Bcl-2蛋白表达

A:p-Akt、Bcl-2蛋白免疫印迹电泳图;B:p-Akt蛋白相对表达;C:Bcl-2蛋白相对表达。与sham组比较,*P<0.05;与HIBI组比较,#P<0.05
3 讨 论
海马是HIBI动物模型对损伤最敏感的部位。有研究报道,缺氧缺血可引起新生大鼠海马部位大量神经元凋亡,且凋亡持续时间较长[9-10]。本研究采用经典的Rice法制作缺血HIBI模型,通过透射电子显微镜观察新生大鼠海马区组织结构,sham组神经元结构基本正常,而HIBI组神经元呈气蚀性改变,提示HIBI导致海马神经元损伤。TTC染色显示,HIBI组新生大鼠缺血半球表现出明显的脑梗死现象。提示HIBI模型建立成功,且引起海马神经元损伤。
为确定缺血缺氧后脑组织海马神经元凋亡情况,本研究应用TUNEL法,并通过标记神经元内细胞凋亡标记物cleaved caspase-3和成熟神经元标记物NeuN进行双重免疫荧光染色,发现HIBI组凋亡阳性细胞数目显著增加,且凋亡细胞主要位于神经元。提示HIBI是通过使海马神经元凋亡导致脑组织损伤。
已有研究显示,EP对新生大鼠HIBI的脑组织有保护作用[11]。本研究结果发现,EP组神经元气蚀性变化减少,神经元受损情况改善脑梗死面积显著低于HIBI组,提示EP处理对新生大鼠脑组织损伤有保护作用。TUNEL检测和双重免疫荧光染色结果显示,EP组TUNEL阳性染色的凋亡细胞显著降低,且NeuN/cleaved caspase-3共定位阳性细胞比例显著降低,表明EP对神经元的保护作用主要是通过减少神经细胞凋亡。
大量动物实验证明,EP减少细胞炎症因子分泌、抑制细胞凋亡,改善由于氧化应激引起的细胞损伤,从而对多种内脏器官起到保护作用。然而,EP对缺血缺氧后神经细胞凋亡抑制作用的相关机制尚不完全明确。
目前认为,磷脂酰肌醇3-激酶(PI3-K)/Akt信号通路作为经典的抗凋亡、促存活信号转导途径,在HIBI后神经元细胞凋亡过程中起重要调控作用[12]。当PI3-K构象发生改变时,Ser473和Thr308磷酸化产生p-Akt。有研究发现,脑缺血时Akt被激活[13]。Li等[14]通过建立新生大鼠缺血缺氧模型发现,模型组大鼠大脑神经元p-Akt阳性表达增加,复氧后4 h表达最高,之后逐渐降低,12 h左右逐渐下降至正常水平,表明在缺血缺氧后,PI3-K/Akt信号通路被激活,p-Akt表达增加,主要参与早期脑组织应激反应。本研究在HIBI 24 h后,通过免疫组织化学和蛋白免疫印迹检测发现,sham组海马组织p-Akt阳性细胞数目较少,且蛋白表达较弱, HIBI组p-Akt阳性细胞数目和蛋白表达增加,提示缺血缺氧过程中PI3-K/Akt信号通路激活,参与脑缺血缺氧引起的应激反应过程。然而,HIBI组p-Akt蛋白表达的增加与sham组比较,差异无统计学意义(P>0.05),可能与检测时间有关。冯美江等[15]通过脑室预注射PI3-K/Akt特异性抑制剂发现,凋亡细胞显著增加,提示PI3-K/Akt特异性抑制剂可阻断海马缺血耐受导致的神经元保护作用,逆向证明PI3-K/Akt通路参与神经元保护作用过程。本研究EP组p-Akt阳性细胞数目和蛋白表达显著高于sham组和HIBI组,提示EP可能通过活化PI3-K/Akt信号通路,改善缺血缺氧引起的脑组织损伤。
凋亡是由基因调控的程序性和主动性细胞死亡,由相关信号转导途径和凋亡基因共同决定。已有研究证实,p-Akt能通过调节其下游与抗细胞凋亡或促细胞存活相关因子Bcl-2、Bad或Bax等表达,参与抗凋亡过程[16-19]。Bcl-2是抗凋亡家族成员中重要的抗细胞凋亡基因,其可通过与Bax结合形成异构二聚体或调节胞内Ca2+浓度等多种方式发挥抗凋亡作用[20-23]。有研究证实,Bcl-2表达下调导致细胞凋亡[24-25]。本研究结果可见,EP组Bcl-2蛋白表达显著高于HIBI组。提示EP通过上调Bcl-2表达而发挥其抗细胞凋亡作用,且这一作用与PI3-K/Akt信号通路的激活有关。
综上所述,缺血缺氧造模24 h后,新生大鼠表现出脑组织损伤且海马神经元凋亡。EP处理通过激活PI3-K/Akt信号通路、促进Bcl-2表达,缓解HIBI引起的神经元凋亡,从而发挥脑保护作用。然而缺血缺氧引起脑组织损伤是一个复杂的生理过程,所涉及信号通路及蛋白仍需进行深入探究,以期为HIBI的治疗提供理论依据。
