猪源肠外致病性大肠杆菌的分离鉴定及致病性
2019-03-26宋祥军邱明宇朱雪婷涂健刘红梅邵颖祁克宗
宋祥军 ,邱明宇,朱雪婷,涂健,刘红梅,邵颖,祁克宗
(安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室,安徽 合肥 230036)
肠外致病性大肠杆菌(extraintestinal pathogenicEscherichiacoli,ExPEC)能够引起不同宿主肠外组织的感染,可导致不同宿主发生脑膜炎、败血症以及泌尿系统感染等疾病.对粪便的微生物筛查研究表明,ExPEC是一种肠道菌落,与共生大肠杆菌不同,ExPEC拥有的致病性毒力因子能够在宿主肠道外引起多种肠外疾病[1-4].近年来,猪源ExPEC的分离率在逐年上升,ExPEC作为养猪业的主要病原体之一,其引发的疾病对养猪业可造成重大的经济损失[5].随着工业化养猪业的发展,猪源ExPEC爆发的增长趋势已成为我国亟需解决的问题[6].一般对于猪病的防治措施,包括开发具有良好前景的疫苗和使用合理有效的抗生素[7].目前,临床上发生猪源ExPEC感染时,首选的治疗方法是使用抗生素.但由于抗生素在畜禽养殖业中的盲目使用,使得猪源ExPEC的耐药性迅速增加,耐药谱越来越广,整体耐药水平升高,导致临床上可供使用的有效抗生素越来越少,给临床治疗带来了很大的困难和挑战.
本试验通过对安徽省合肥地区送检的感染ExPEC仔猪进行剖检,通过无菌操作采集其肠外组织心脏、肝脏等,进行细菌的分离纯化培养与16s rDNA PCR测序鉴定,将确定为猪源ExPEC的菌株进行种系发育分群试验、毒力基因检测、药敏试验以及小鼠致病性试验,进一步了解该病原菌的致病性和流行病学规律,以期为该病的预防和临床治疗提供科学依据.
1 材料与方法
1.1 试验材料
无菌采集合肥周边地区送检的感染ExPEC仔猪的心脏、肝脏、脾脏、肺脏、肾脏,大肠杆菌药敏质控株ATCC 25922由安徽农业大学动物科技学院兽医病理生物学与疫病防控安徽省重点实验室保存,6~8周龄昆明小鼠购自安徽医科大学实验动物中心.
LB肉汤培养基、琼脂粉、琼脂糖、GelRed核酸染色液、5×TBE均购自上海生工生物工程技术服务有限公司;麦康凯培养基(MAC)、伊红美蓝培养基(EMB)、三糖铁培养基(Triple Sugar Iron Agar)均购自青岛高科园海博生物技术有限公司;药敏纸片购自杭州微生物试剂有限公司;比浊管购自温州市康泰生物科技有限公司;革兰氏染液购自北京索莱宝科技有限公司.
1.2 试验方法
1.2.1 猪源肠外大肠杆菌的分离纯化与鉴定 将采集的肠道外组织无菌接种于麦康凯培养基,37 ℃培养12~18 h;再挑取红色圆形菌落接种于伊红美蓝培养基,37 ℃培养12~18 h,挑取紫黑色带金属光泽的单菌落接种于LB固体培养基上进行纯化.取纯化后细菌适量涂布于载玻片上,进行革兰氏染色镜检[8].将初步鉴定为大肠杆菌的菌落进行16S rDNA PCR测序鉴定[16].
1.2.2 猪源肠外大肠杆菌PCR分群 根据文献,合成系统进化分群有关基因chuA、yjaA、TspE4C2的引物[9],引物如表1所示,引物由上海生工生物工程技术服务有限公司进行合成.

表1 目的基因、引物、目的片段大小
1.2.3 猪源肠外大肠杆菌毒力基因检测 按GenBank公布的有关基因序列,合成11对ExPEC的毒力基因[10]:kpsMII、iutA、papC、sfaS、focG、afa、papA、hlyD、fyuA、ireA和vaT,引物序列见表2,引物由上海生工生物工程技术服务有限公司合成.
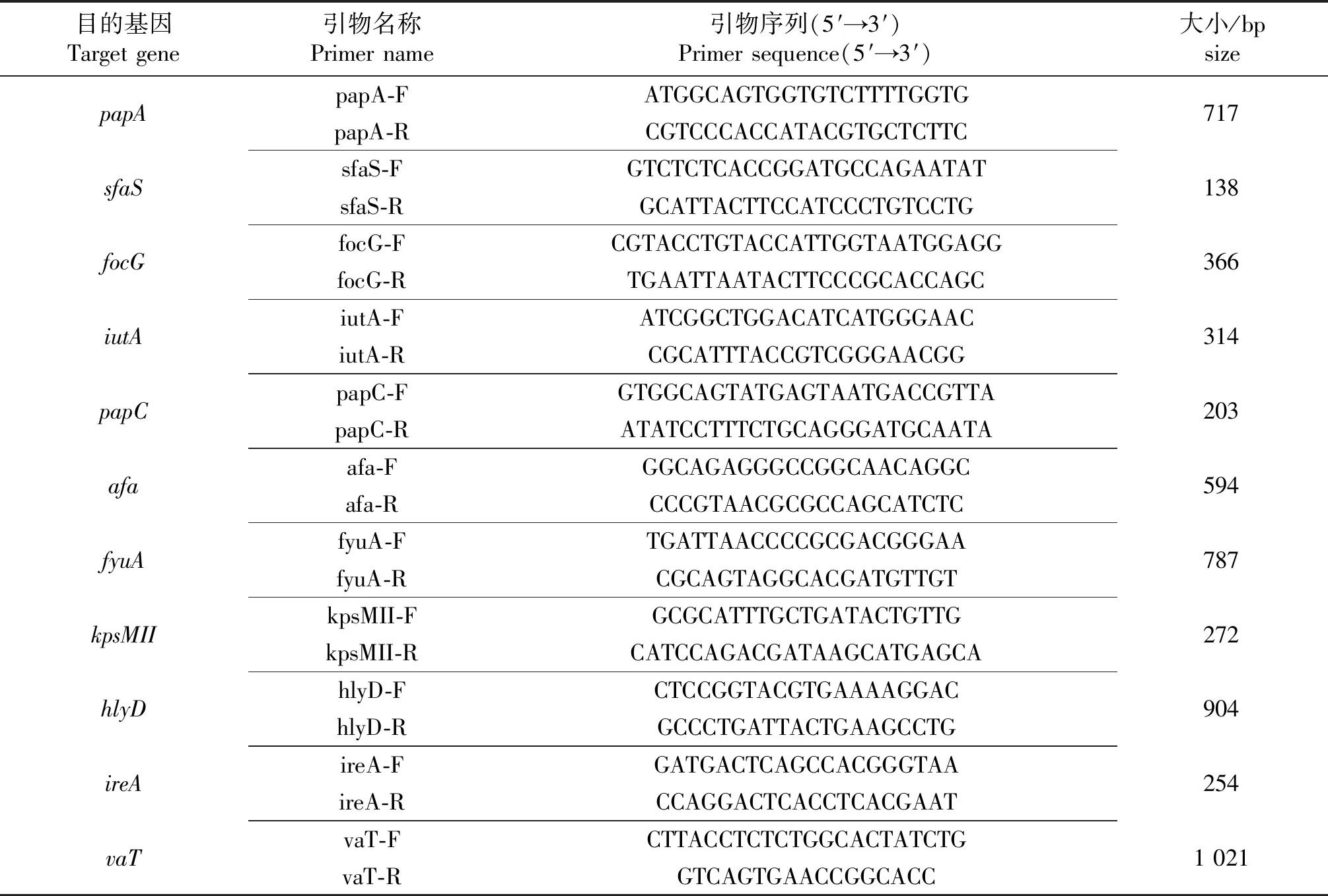
表2 毒力基因、引物、目的片段的大小
1.2.4 药物敏感试验 采用纸片扩散法对分离到的30株猪源ExPEC进行药敏试验.将ExPEC菌株接种于LB固体培养基,37 ℃静置培养12 h,挑取单菌落至LB液体培养基中,37 ℃、200 r/min培养3~4 h后,取适量菌液与MH琼脂培养基混匀,倒板,冷却、凝固后,贴药敏纸片,37 ℃培养24 h,用游标卡尺测定抑菌圈直径,读取并记录结果.
1.2.5 小鼠致病性试验 分别选取含有3个以上的毒力基因的菌株(Ex-P3、Ex-P5、Ex-P8、Ex-P14、Ex-P22、Ex-P23、Ex-P24、Ex-P26、Ex-P27、Ex-P30),将66只昆明小鼠进行随机分组,每组6只,设置1组对照组,以菌液浓度为2×107CFU/mL,向小鼠腹腔注射0.5 mL/只,对照组注射PBS缓冲液(0.5 mL/只),注射后观察记录1周内小鼠的死亡情况.
1.2.6 菌株Ex-P27基因组圈图 利用高通量测序技术对Ex-P27菌株进行全基因组测序以获取基因组序列图谱,采用 Circos v0.69(http://circos.ca/)软件进行基因组圈图的绘制,通过基因组圈图可以更直观的了解基因在正、反义链上的分布情况、基因的GC含量、基因组岛、同源基因等信息.
2 结果与分析
2.1 猪源ExPEC的分离株培养特性以及16S rDNA PCR测序鉴定
分离的菌株在麦康凯培养基上呈现圆形红色、湿润光滑菌落;在伊红美蓝培养基上呈紫黑色带金属光泽的圆形菌落;在LB固体培养基上呈灰白色、光滑湿润的菌落.镜检可见菌体被染成红色、两端钝圆、单个、成对或成链状排列,无芽孢.通过PCR扩增细菌16S rDNA基因进一步鉴定上述筛选的大肠杆菌,扩增片段大小为1 450 bp,经1.2%的琼脂糖凝胶电泳检测发现,30株菌目的片段大小均与预期一致(图1);将PCR产物送往上海生物工程技术服务有限公司纯化并测序,序列结果在NCBI-BLAST搜索比对,鉴定标准按照同源性≥97%判定,可以确定筛选的大肠杆菌为猪源ExPEC.

M:DL2 000 DNA Marker;A:1为阴性对照;2~24为检测菌株;B:1为阴性对照,2~8为检测菌株.M:DL2 000 DNA Marker;A:1 for negative control,2~24 for detected strains;B:1 for negative control,2~8 for detected strains.图1 16s rDNA PCR扩增Figure 1 16s rDNA PCR amplification
M:DL2 000 DNA Marker;A:1~3为菌株1(B1),4~6为菌株2(A),7~9为菌株3(D),10~12为菌株4(B1),13~15为菌株5(D),16~18为菌株6(A),19~21为菌株7(A),22~24为菌株8(D);B:1~3为菌株9(B2),4~6为菌株10(B2),7~9为菌株11(B1),10~12为菌株12(B1),13~15为菌株13(B1),16~18为菌株14(A),19~21为菌株15(D),22~24为菌株16(B1);C:1~3为菌株17(B1),4~6为菌株18(B2),7~9为菌株19(B1),10~12为菌株20(B1),13~15为菌株21(B1),16~18为菌株22(B2),19~21为菌株23(B2);22~24为菌株24(D);D:1~3为菌株25(D),4~6为菌株26(B1),7~9为菌株27(B1),10~12为菌株28(B1),13~15为菌株29(B1),16~18为菌株30(B1),19~21为阴性对照.M:DL2 000 DNA Marker;A:1~3 for strain 1(B1),4~6 for strain 2(A),7~9 for strain 3(D),10~12 for strain 4(B1),13~15 for strain 5(D) ,16~18 for strain 6(A),19~21 for strain 7(A),22~24 for strain 8(D);B:1~3 for strain 9(B2),4~6 for strain 10(B2),7~9 for strain 11(B1),10~12 for strain 12(B1),13~15 for strain 13(B1),16~18 for strain 14(A),19~21 for strain 15(D),22~24 for strain 16(B1);C:1~3 for strain 17(B1),4~6 for strain 18(B2),7~9 for strain 19(B1),10~12 for strain 20(B1),13~15 for strain 21(B1),16~18 for strain 22(B2),19~21 for strain 23(B2);22~24 for strain 24(D);D:1~3 for strain 25(D),4~6 for strain 26(B1),7~9 for strain 27(B1),10~12 for strain 28(B1),13~15 for strain 29(B1) ,16~18 for strain 30(B1),19~21 for negative control.图2 基因chuA(279 bp)、yjaA(211 bp)、TspE4C2(152 bp)的PCR扩增Figure 2 PCR amplification of genes chuA,yjaA and TspE4C2
2.2 系统发育分群的分群
分群结果显示,30株猪源ExPEC有4株菌是属于A群,15株菌属于B1群,5株菌属于B2群,6株菌属于D群.30株猪源ExPEC的系统分群结果如图2所示.
2.3 毒力基因的检测
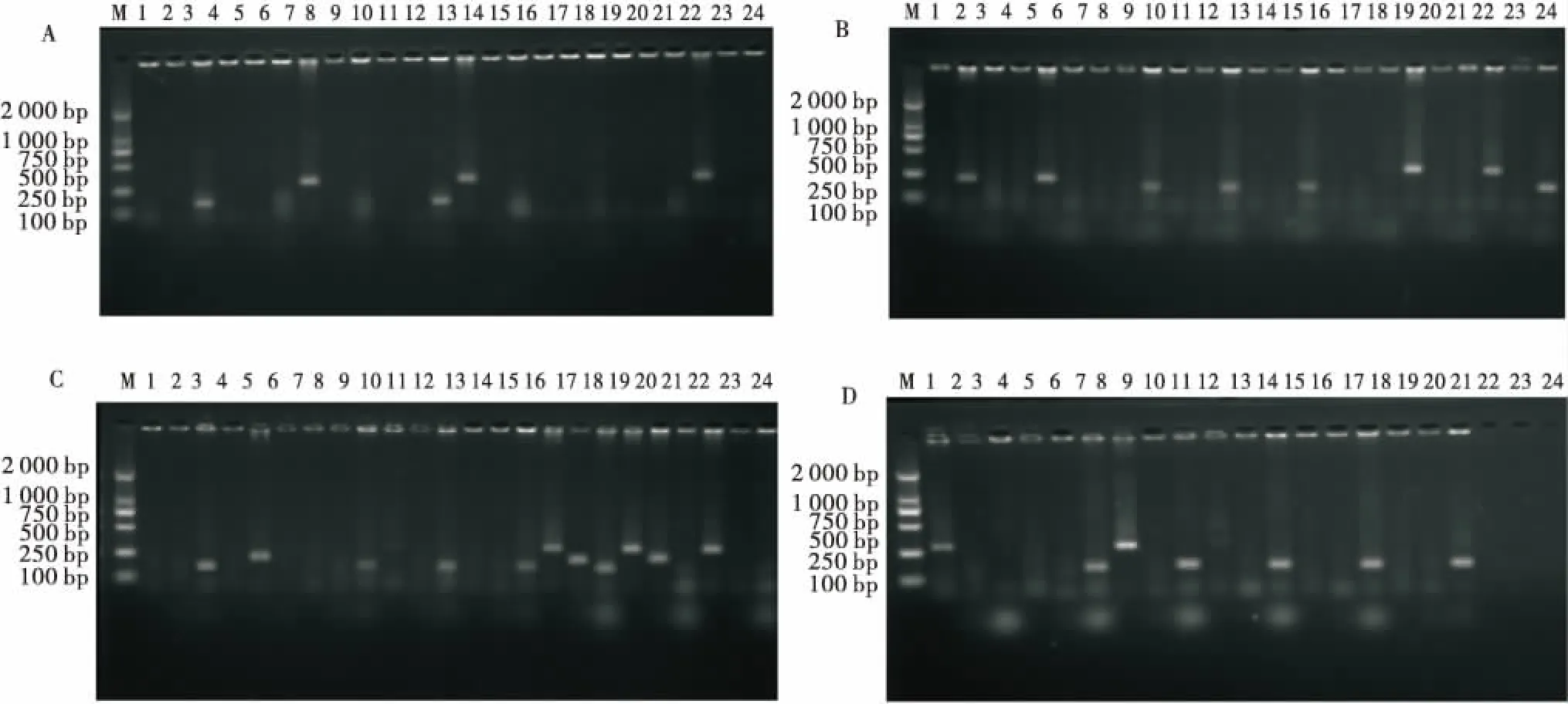
30株猪源ExPEC中,检测合成的11种毒力基因结果显示,vaT、iutA、kpsMII、hlyD、fyuA、ireA、afa7种毒力基因,检出率分别为70.00%、33.33%、23.33%、20.00%、16.67%、3.33%、3.33%,而papC、sfaS、focG、papA这4种毒力基因并未扩增出目的条带.检出目的基因片段大小与阳性菌株扩增片段大小相符,毒力基因检测结果的部分PCR图,如图3所示.

M:DL2 000 DNA Marker;A、B、C、D、E、F、G:1为阴性对照;A为毒力基因afa(594 bp)的扩增图,2~10为检测样品,4为检测出的阳性菌株;B为毒力基因fyuA(787 bp)的扩增图,2~13为检测样品,2~5为检测出的阳性菌株;C为毒力基因ireA(254 bp)的扩增图,2~10为检测样品,8为检测出的阳性菌株;D为毒力基因kpsMII(272 bp)的扩增图,2~9为检测样品,6~9为检测出的阳性菌株;E为毒力基因vaT(1 021 bp)的扩增图,2~10为检测样品,3、5、6、8泳道为检测出的阳性菌株;F为毒力基因iutA(314 bp)的扩增图,2~9为检测样品,2、4、7泳道为检测出的阳性菌株;G为毒力基因hlyD(904 bp),2~10为检测样品,4泳道、6~9泳道为检测出的阳性菌株.M:DL2 000 DNA Marker;A,B,C,D,E,F,G:1 for a negative control;A:amplification of virulence gene afa (594 bp),2~10 for a test sample,4 for detection of the positive strain;B:amplification map of the virulence gene fyuA (787 bp),2~13 for the test sample,2~5 for the positive strain detected;C:for the expansion of the virulence gene ireA (254 bp) ,2~10 for the detection of samples,8 for the detection of positive strains;D:amplification of the virulence gene kpsMII (272 bp),2~9 for the detection of samples,6~9 for the detection of positive strains;E:amplification map of the virulence gene vaT (1 021 bp),2~10 for the detection sample,lanes 3,5,6,and 8 for the positive strains detected;F:the amplification of the virulence gene iutA (314 bp),2~9 shows the samples tested,lanes 2,4 and 7 for positive strains detected;G:virulence gene hlyD (904 bp),2~10 for the test sample,lanes 4 and 6~9 for detected the positive strain.图3 毒力基因的PCR检测Figure 3 The result of PCR detection of virulence genes
2.4 药敏试验
对分离到的30株致病性大肠杆菌进行的常用22种抗生素的敏感性试验,结果表明分离株对受试药物存在不同程度的多重耐药性,其中对氨苄西林、林可霉素、多西环素、利福平、杆菌肽的耐药率最高,达到100%,对多粘菌素B的耐药率最低为0%,但敏感率最高为93.33%,对米诺环素的中介率最高为63.33%,统计结果如表3所示.
2.5 致病性试验
将本试验中临床分离到的含有3个及以上毒力基因的猪源ExPEC菌株腹腔注射接种小鼠,连续观察1周的发病小鼠死亡情况为:Ex-P3(2/6)、Ex-P5(1/6)、Ex-P8(1/6)、Ex-P14(1/6)、Ex-P22(3/6)、Ex-P23(2/6)、Ex-P24(2/6)、Ex-P26(1/6)、Ex-P27(3/6)、Ex-P30(2/6),对照组(0/6).死亡率最高的为Ex-P22和Ex-P27组小鼠,而Ex-P27组小鼠发病症状更严重,表现为采食量下降、行为能力减弱、颤抖、精神萎靡不振,被毛杂乱,因此选择此菌株做测序验证.
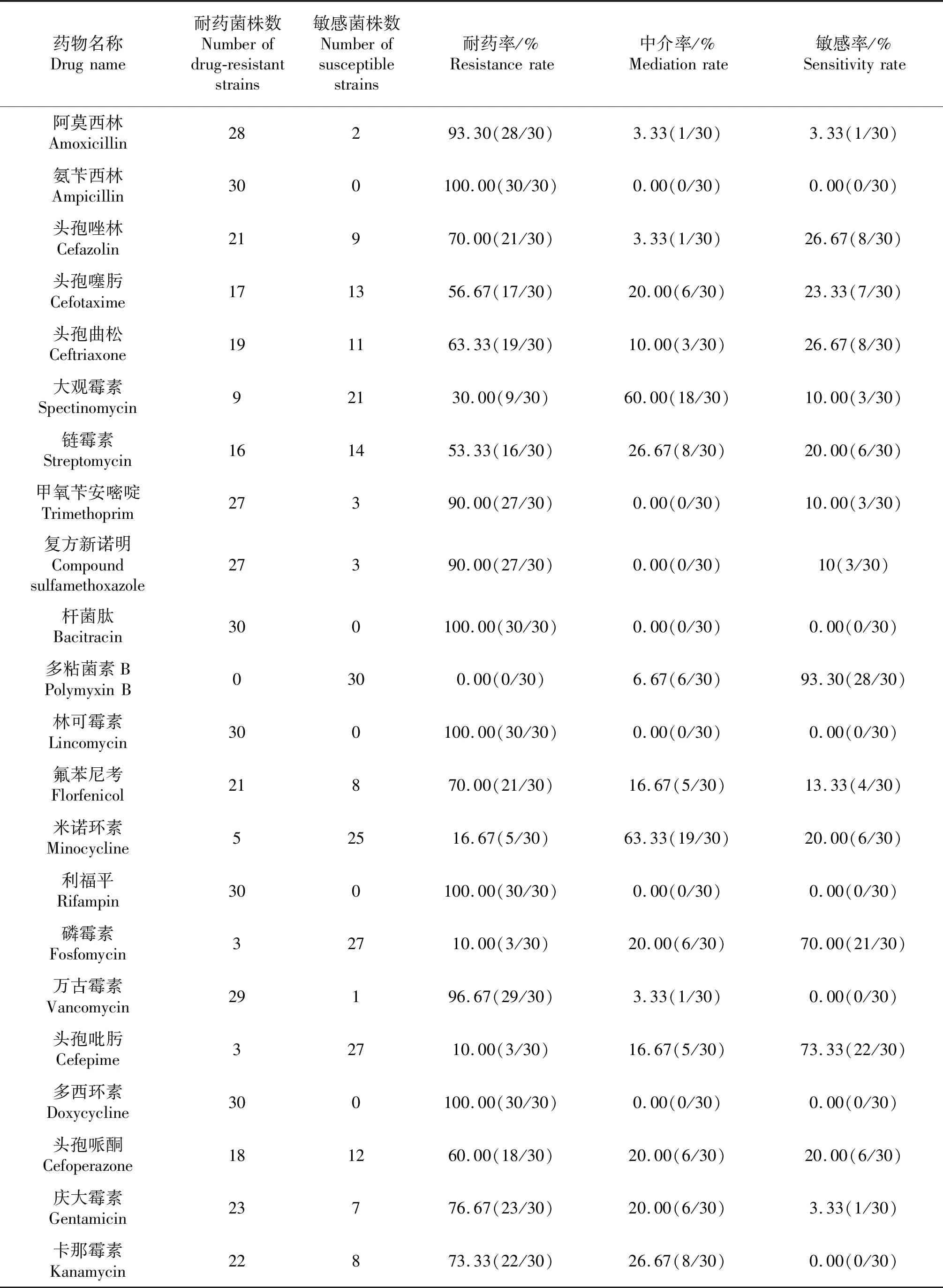
表3 30株猪源肠外致病性大肠杆菌的药敏试验
2.6 菌株Ex-P27基因组圈图
对菌株Ex-P27的高通量测序结果,预测到4 995个编码基因,其总长5 365 154 bp,平均长度1 074 bp.非编码RNA预测中,rRNA有9个,分布在7个家族;tRNA有86个,分布在22个家族.利用已预测到的基因组信息,如重复序列、GC含量等,应用Circos v0.69(http://circos.ca/)软件绘制出菌株Ex-P27基因组圈图(图4).由外向内第2圈和第3圈上,不同的颜色标识CDS不同的COG的功能分类,第5圈向外的红色部分表示该区域GC含量高于全基因组平均GC含量,相反地,向内的蓝色部分表示GC含量低于平均水平,峰值高低表示与平均GC含量差值大小.如图4所示,红色和蓝色部分交替频繁,但峰值相近,说明该菌株GC含量波动频繁,但波动幅度不大.
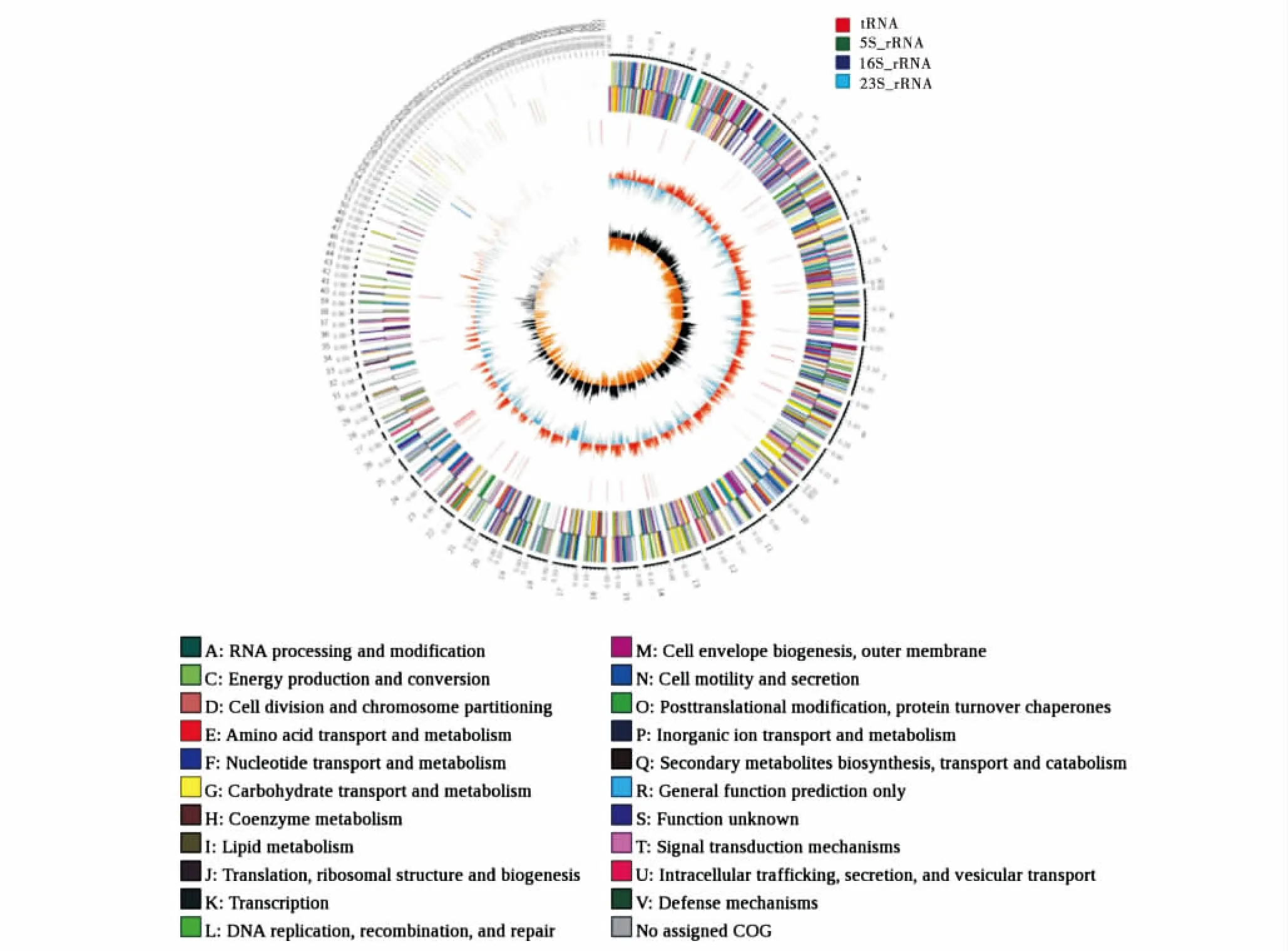
图4 Ex-P27分离株基因组圈图Figure 4 Genome circle map of Ex-P27 strain
3 讨论
猪源ExPEC现已成为威胁我国养猪业的主要细菌性疾病之一,本研究分离到的猪源ExPEC来源于合肥周边送检的病猪,通过无菌采集病猪的肠道外的组织分离到的细菌,经纯化培养及PCR测序鉴定分离了30株猪源ExPEC.
大肠杆菌的系统发育进化群是采用两步三重PCR,根据基因chuA、yiaA和TspE4序列将种系发育群分为4个群,分别为A、B1、B2、D.本试验结果显示,30株猪源ExPEC,B1群菌株为最多,其次是B2和D群,A群所占菌株最少.有研究报道,不同种群的毒力和致病性不同[11],并发现对人具有致病性的ExPEC主要是B2群的菌株,D群的致病性次之.A群和B1群的菌株多是属于共生型的,一般情况下不致病.ExPEC的致病性主要是通过某些毒力因子和宿主的相互作用,导致宿主发病.本试验选取11种猪源ExPEC的毒力基因,用于进一步验证种系发育群和毒力基因之间的关系,选取的毒力基因主要包含P-菌毛基因PapA、PapC;S菌毛:sfa;FIC菌毛:foc;非菌毛粘附素:afa;鳌铁蛋白受或外膜蛋白受体体:iutA、ireA属于摄铁系统;荚膜多糖基因:kpsMII素;分泌的毒素:α-溶血素hly;毒力岛基因vaT;HPI核心区主要结构基因fyuA.有一些研究者认为从肠外组织中分离到的大肠杆菌都可以定为ExPEC,也有些学者认为当分离到的菌株中含有2个及其以上的毒力基因时,便可认为是ExPEC.本研究中针对11种毒力基因的检测结果显示,vaT、hlyD、iutA、kpsMII、fyuA、ireA、afa的检出率较高,分别为:70.00%、20.00%、33.33%、23.33%、16.67%、3.33%、3.33%.Zhu等研究发现从中国分离的64株猪ExPEC的ompA,fimH,vat,traT和iutA非常普遍[10],其中vat、iutA基因与我们的研究相一致.vaT是1种自转运体液泡毒素,与ExPEC肾脏感染有关,且在APEC感染禽肺脏和气囊过程中表达量升高[12-14];Highland等研究发现荚膜多糖基因kpsMII在从小猫肺脏分离的ExPEC中有表达[15];人源致病性ExPEC的fyuA基因检出率达到65.6%,而犬和猫的致病性ExPEC检出率高达80%[16-17];研究发现APEC的iutA缺失株与野生型相比,致病性明显降低[18];其中毒力基因fyuA在UPEC中检出率高达78%,fyuA突变株的毒力低于野生型[19-20].小鼠的致病性试验结果显示,致病能力最强的菌株均含有毒力基因iutA、fyuA以及毒力基因vaT,其中fyuA、vaT是毒力岛基因.马增军等[21]报道在分离到的猪源ExPEC中,检测到含有毒力基因ler、astA、irp2、fyuA和iutA的菌株中,同时含有iutA、fyuA基因,且毒力岛基因ler的菌株致病力最强,本试验的研究结果显示,同时含有ireA、fyuA、vaT基因的菌株致病能力也很强.
本试验分离到的猪源ExPEC菌株,某些菌株的抗生素的耐药情况非常严重,猪源ExPEC对多西环素的耐药率可高达100%,这一结论与王斌等[22]的报道相吻合,对氨苄西林、复方新诺明的耐药率也高达90%以上,这与何莹等[23]的报道基本吻合.试验发现多粘菌素B对猪源ExPEC具有较好的抑菌效果,且猪源ExPEC对头孢吡肟较为敏感,但对头孢噻肟、头孢哌酮、头孢唑林等头孢类药物敏感性次之,这与张青娴[24]的报道有所差异.2009年四川省规模化养殖场猪源大肠杆菌对阿莫西林、氨苄西林、复方新诺明的耐药率分别为100.00%、100.00%、96.09%,本试验分离的30株猪源ExPEC对氨苄西林的耐药率达到了100%,对阿莫西林以及复方新诺明的耐药率也分别达到了93.3%、90.0%;为了调查猪源ExPEC的耐药性,张青娴、徐引娣等在2016~2017年间分离了59株ExPEC,并对20种常用抗生素进行了药物敏感试验,其研究结果显示:对复方新诺明的耐药率高达100%,对利福平、链霉素、庆大霉素的耐药率也高达80%以上,本试验的药敏结果为,利福平、链霉素、庆大霉素的耐药率分别为100%、53.33%、76.67%.米诺环素、磷霉素对ExPEC具有较好的抑菌效果,但有些个别菌株对米诺环素、磷霉素不敏感,氨基糖苷类除大观霉素外,其余药物对肠外致病性大肠杆菌的抑菌效果都不明显,对磺胺类、林可胺类以及四环素类等抗生素也都呈现了不同程度的耐药性,且大部分菌株都呈现了10重以上的耐药,且大都表现为多重耐药.大多数抗生素对猪源ExPEC已经不起作用,或者作用不大,呈现严重的耐药性,因此,在临床治疗时对抗生素的选择一定要慎重,并且要把人用药与兽用药物区分开,尽量避免交叉用药.在治疗疾病的过程中,要针对性用药,不应盲目使用抗生素[25].本试验进一步说明了猪源ExPEC的耐药率之高,耐药谱之广泛,因此,在临床生产实践中,一定要合理用药,以降低ExPEC的耐药性.
4 结论
本研究从临床病例分离猪源大肠杆菌,经鉴定30株为猪源ExPEC,分群鉴定确定主要分布在B1群,耐药性试验发现分离菌株对氨苄西林、林可霉素、多西环素、利福平、杆菌肽的耐药率达到100%,毒力基因检测发现主要毒力基因为vaT、iutA、kpsMII、hlyD.致病性试验中死亡率最高的为Ex-P27分离株,经过高通量测序获得了基因组图谱.本试验通过对猪源ExPEC进行的部分生物学特性和致病性研究,为指导猪源ExPEC的防治与临床用药提供依据.
