饮食失节对SD大鼠胃肠激素水平及肠道菌群的影响
2019-03-26李雁王晓喜陈琦杜玉枝毕宏涛魏立新尚靖
李雁,王晓喜,陈琦,杜玉枝,毕宏涛,魏立新,尚靖,3
(1.中国科学院西北高原生物研究所,青海省藏药药理学与安全性评价研究重点实验室,青海 西宁 810000;2.中国科学院大学,北京 100049;3.中国药科大学中药学院,江苏 南京 210000)
功能性消化不良(functional dyspepsia,FD)是最常见的功能性胃肠疾病之一.据报道,在西方国家成年人中,其患病率达到15%[1],而在我国,其患病率达到23.5%[2].该病发病机制复杂多样,且其诱发因素庞大繁杂,其中不良饮食就是导致该病产生不可忽略的一个因素,例如营养成分不均、饮食模式单一、饮食不规律等都会直接或者间接的引起机体出现胃肠动力障碍,导致胃排空速度减慢,胃排空延迟,从而出现消化不良症状[3],基于二者之间的联系,大量通过饮食失节建立功能性消化不良动物模型的研究由此展开[4-5],并且都证明饮食失节在功能性消化不良发生发展过程中具有重要作用.而现代人生活水平提高,生活方式改变,不均衡饮食、暴饮暴食、饮食不规律等饮食失节现象随即大量出现,使得功能性消化不良发病率急剧上升,为了探究二者更精准的联系,本研究旨在利用饥饱失常法刺激SD大鼠[6],从胃肠激素水平以及肠道菌群多样性方面,探究该法对SD大鼠胃肠激素以及肠道菌群的影响,进而初步评价饮食失节在功能性消化不良产生过程中的作用.
1 材料与方法
1.1 试验材料
SPF级SD大鼠,雄性,体质量(220±50)g,由甘肃中医药大学提供,试验动物质量合格证编号:SYXK(甘)2015-0005,饲养温度20~25 ℃,湿度40%~60%,光照时间12 h;动物试验经中国科学院西北高原生物研究所试验动物伦理委员会批准.
胃动素、胃促生长素素ELISA试剂盒(上海将来实业股份有限公司,批号:201808);NO含量测定试剂盒(南京建成生物科技有限责任公司,批号:20180823);甲基橙(国药集团化学试剂有限公司,批号:20140102);碳酸氢钠(分析纯,天津市永大化学试剂有限公司,批号:20130320);水合氯醛(分析纯,天津市大茂化学试剂厂,批号:20180518);生理盐水(国药准字H61020014,批号:1708146B,西安京西双鹤药业有限公司);PBS(博士德生物工程有限公司,批号:09B16B30).
酶标仪(Enspire SJZX-40,Singapore Perkin-Elmer);离心机(3-18ks,Gremany Sigma);高通量组织匀浆研磨器(Scientz-48,宁波新芝);电子天平(AL104,METTLER TOLEDO);722分光光度计(上海精密科学仪器有限公司);紫外-可见分光光度计(UV-1801,北京瑞利分析仪器公司);超声波清洗器(SB-5200 DTD,宁波新芝);数显恒温水浴锅(HH-4,常州智博瑞仪器制造有限公司);电热恒温干燥箱(DHG-9140A,上海一恒科学仪器有限公司);自动纯水机(UPH-1-40L,四川优普超纯仪器有限公司).
1.2 试验方法
1.2.1 造模及分组 SD雄性大鼠24只,体质量(220±50) g,称重后随机分为2组,正常饮食组(A)与饥饱失常组(B),A组大鼠正常饲养,B组大鼠单日正常饮食,双日禁食,连续试验15 d.
1.2.2 体质量及进食量的测定 每日上午9∶30给予2组大鼠一定的鼠食(固体,天平称量),至次日上午 9∶30测定剩余量,2者差值即为该组大鼠每日进食量,饥饱失常组大鼠测定单日进食量即可.分别于试验前,试验7 d后,试验15 d后称得大鼠体质量,得到试验期间2组大鼠体质量变化情况.
1.2.3 胃排空测定(胃内甲基橙残留率) 胃排空测定方法参照文献报道[7-8],2组大鼠于试验结束后禁食不禁水12 h,并给每只大鼠灌胃3 mL 0.1%甲基橙溶液,45 min后测定大鼠胃内甲基橙残留量,计算得到大鼠胃内甲基橙残留率.
1.2.4 胃动素(MTL)、胃促生长素(Ghrelin)含量的测定 选择乙二胺四乙酸二钾(EDTA-K2)作为抗凝剂,将血液置于含有抗凝剂的采血管中混匀,并在4 ℃下,以3 000 r/min离心20 min,收集上清即为待测血浆.MTL、Ghrelin含量测定采用Elisa法,按试剂盒说明书进行试验.
1.2.5 胃窦NO含量的测定 自大鼠胃幽门括约肌处取得适量胃窦部组织,并用蒸馏水冲洗干净后用滤纸吸干多余水分后准确称质量,按1∶9(M/V)的比例,加入PBS,冰水浴条件下破碎组织得到匀浆液,4 000 r/min离心15 min,取上清液,以硝酸还原酶法测定组织匀浆上清液的NO含量,试验操作严格按照试剂盒说明书进行.
1.2.6 肠道菌群的测定 取2组大鼠新鲜粪便,送样至上海美吉生物医药科技有限公司进行测序.
1.3 数据处理
2 结果与分析
2.1 动物健康状态的变化
试验之前,2组大鼠活泼好动、毛发整洁有光泽,精神状态上佳;试验7 d后,A组大鼠未见异常,B组大鼠打斗剧烈,易怒易惊,粪便增多且湿软;试验15 d后,A组大鼠状态仍未见异常,B组大鼠从刚开始的打斗剧烈容易暴怒逐渐转变为打斗减弱,对环境变化敏感,抱团蜷缩,消极对待打斗甚至停止挣扎,粪便增多导致便溏,肛周污秽,与文献报道一致[9].
2.2 大鼠体质量的增长
2组大鼠体质量变化如表1所示,试验7 d后,B组大鼠体质量小于A组,且差异显著(P<0.05);试验15 d后,B组大鼠体质量仍显著小于A组(P<0.01),但2者差值明显增加.
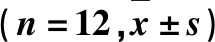
表1 大鼠体质量的变化
*表示差异显著(P<0.05);**表示差异极显著(P<0.01).
* indicates significant difference(P<0.05);** indicates extremely significant difference(P<0.01).
2.3 单日进食量的变化
2组大鼠单日进食量具有极显著差异,结果如图1所示,A组大鼠单日进食量逐渐减少,减少幅度较小;B组大鼠单日进食量大幅增加后保持较小幅度的增加;试验期间,与A组相比,B组大鼠进食量显著增加(P<0.01).
2.4 胃排空速度及胃窦NO含量的变化
本研究中,以大鼠胃内甲基橙残留率反应胃排空速度,结果如表2所示,与A组相比,B组大鼠胃内甲基橙残留率增加41.96%,该差异极显著(P<0.01);大鼠胃窦组织NO含量则与胃内甲基橙残留率呈相反趋势,B组大鼠胃窦组织中NO含量较A组降低57.48%,具有极显著性差异(P<0.01).

**表示差异极显著(P<0.01).** indicates extremely significant difference (P<0.01).图1 试验期间大鼠单日进食量(n=7)Figure 1 The food intake of rats during the experiment (n=7)
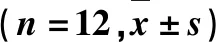
表2 大鼠胃内甲基橙残留率及胃窦NO的含量
** 表示差异极显著(P<0.01).
** indicates extremely significant difference(P<0.01).
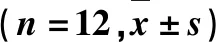
表3 大鼠血浆胃动素、胃促生长素含量
**表示差异极显著(P<0.01).
** indicates extremely significant difference(P<0.01).
2.5 血浆胃动素(MTL)、胃促生长素(Ghrelin)含量的变化
如表3所示,试验15 d后,相比A组,B组大鼠血浆MTL含量较低,但无显著性差异;B组大鼠血浆Ghrelin含量相比A组增加9.76%,差异显著(P<0.5).
2.6 肠道菌群多样性的变化
2.6.1 OUT水平肠道菌群的变化 胃肠道作为人体最重要的消化吸收器官,内含数量庞大的肠道菌群,与胃肠道功能及疾病的发生具有紧密的联系.计算2组共有的OUT数量,并通过Veen图直观呈现2组大鼠共有和独有OUT数量,结果如图2所示,在OUT水平,A组与B组共有的OUT种类具有有538种,A组大鼠单独含有的OTU有104种,B组大鼠单独含有的OTU有57种,2组大鼠菌群OUT数目不同,说明饥饱失常刺激会导致大鼠肠道菌群出现变化,使其紊乱,但上述差异并不具有显著性,说明大鼠在受到饥饱失常刺激后,大鼠菌群虽然发生变化,但是菌群主体维持相对稳定.
2.6.2 科水平肠道菌群的变化 如图3所示,在科水平比较2组大鼠菌群相对丰度,结果显示B组大鼠Lactobacillaceae,Bifidobacteriaceae,Enterobacteriaceae3科菌群相对丰度较A组分别增加44.26%(P<0.001)、1.33%(P<0.05)、1.16%(P<0.05),而与A组相比,B组大鼠Bacteroidales_S24-7_group,Ruminococcaceae,Verrucomicrobiaceae3科菌群相对丰度分别降低14.65%(P<0.01)、13.17%(P<0.001)和1.74%(P<0.05),以上差异均具有显著性.

图2 OTU水平的肠道菌群Veen图Figure 2 Veen diagram of intestinal flora at OUT level
2.6.3 MTL/Ghrelin含量与肠道菌群丰度关联分析 为了探究胃肠激素与肠道菌群之间的关联,本研究在门水平做了RDA分析,结果如图4所示,在门水平,Bacteroidetes(拟杆菌门)细菌相对丰度与MTL含量呈正相关,且相关性较强,而与Ghrelin含量呈现负相关;Firmitues(厚壁菌门)则相反,其相对丰度与MTL含量呈负相关,与Ghrelin含量呈现正相关.
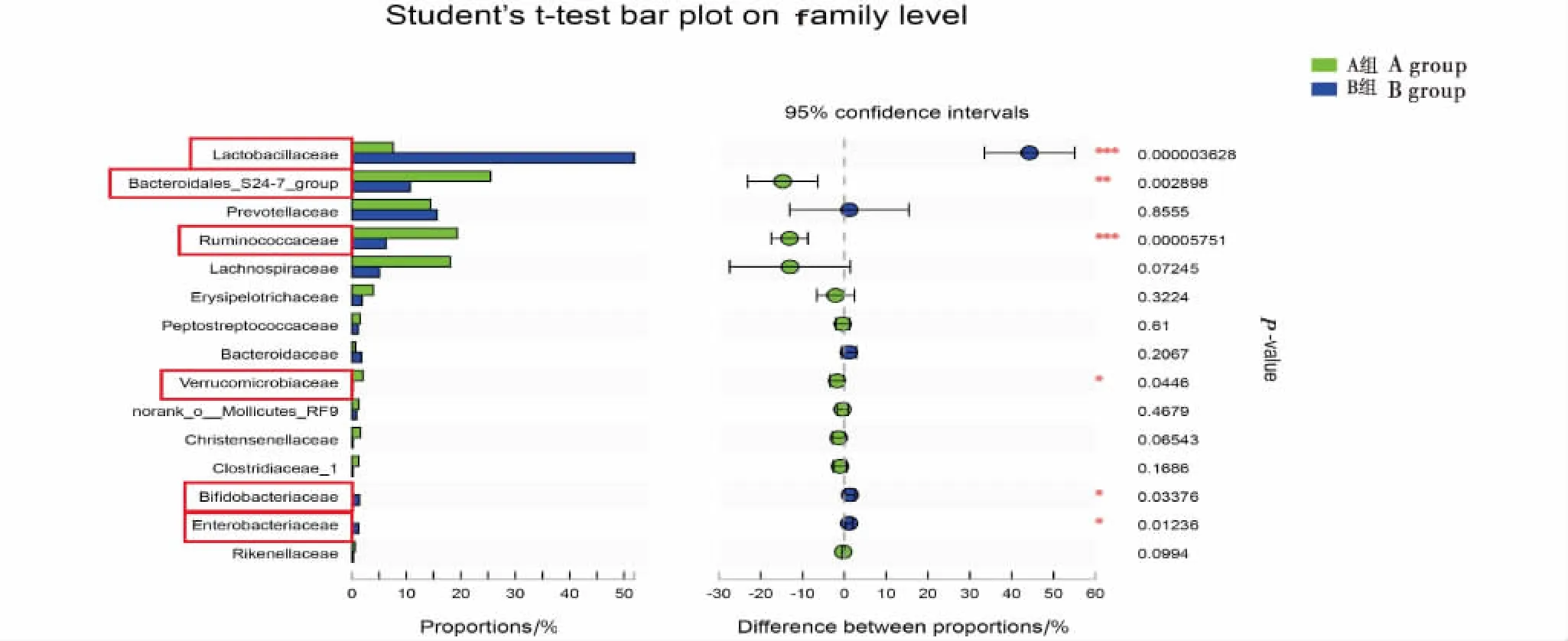
* 表示差异显著(P<0.05);**表示差异极显著(P<0.01);*** 表示差异极显著(P<0.01).* indicates significant difference(P<0.05);** indicates extremely significant difference(P<0.01);*** indicates extremely significant difference(P<0.001).图3 科水平两组大鼠肠道菌群的比较分析Figure 3 Comparative analysis of intestinal flora between two groups on family level

图4 MTL/Ghrelin含量与肠道菌群丰度关联分析Figure 4 Correlation analysis of MTL/Ghrelin contents and intestinal flora abundance
3 讨论
饮食因素与机体健康紧密相关,例如,高脂饮食会使正常SD大鼠肠道菌群结构发生改变,引起肥胖与高胆固醇症的形成[10-11],研究发现饮食失节与功能性消化不良的发生具有密切的联系,它会使机体胃肠动力出现障碍,引起早饱、上腹疼痛、恶心、体质量下降,倦怠懒动等消化不良症状[12-13],但其FD发生过程中对大鼠胃肠激素与肠道菌群的影响有待研究.本研究中,通过对SD大鼠进行饥饱失常刺激后测定大鼠体质量、进食量、胃排空速度、胃肠激素水平以及肠道菌群变化来初步评估饮食失节在功能性消化不良发生中的作用.结果显示,B组大鼠活动明显减少,反应迟钝,易受惊,扎堆蜷缩,粪便增多且湿软,进食量明显增加而体质量则增加缓慢甚至出现负增长[14-15],测定2组大鼠胃排空速度,结果显示B组大鼠胃排空速度明显减慢(P<0.01),即说明饮食失节会导致大鼠胃肠蠕动障碍,使其功能减弱.
FD作为一种临床上最为常见的功能性胃肠疾病,其准确发病机制目前为止尚不明确.近年来,大量研究表明,胃肠动力障碍是FD发病的主要原因,而广泛存在于消化系统的胃肠激素参与了胃肠道的运动调节作用,有研究者发现,胃肠激素水平变化引起患者胃肠功能障碍,其临床表现以胃排空延迟,胃排空速度减慢为主.MTL是参与调节胃肠道运动的重要神经递质,主要由十二指肠、空肠上段粘膜内的M细胞分泌,在大多数哺乳动物上消化道均有表达,在消化期间呈周期性释放,作用于消化道平滑肌上的MTL受体,具有增强平滑肌收缩,加速胃内容物排空速度,缩短小肠传输时间,从而发挥调节胃肠动力的作用[16],有研究者认为,FD患者存在胃排空延长、胃收缩减弱及Ⅲ期收缩缺乏的症状均与MTL含量下降有关,FD患者胃排空功能障碍与MTL含量紧密相关[17].Ghrelin是由胃体X/A样内分泌细胞分泌,存在于胃肠道,主要是在胃中合成,能够增强胃肠动力及腺体分泌,具有保护胃粘膜的作用[18].研究发现,Ghrelin可通过刺激迷走神经实现促进胃酸分泌的作用,同时,Ghrelin可通过调节胃肠激素水平变化来实现调节胃肠功能运动的作用.Date等[19]研究发现,给小鼠注射Ghrelin后,小鼠体内NO含量增加,而采用NOS抑制剂可以阻断感觉神经传导,进而阻断Ghrelin对胃粘膜的保护作用.另外,也有研究显示,Ghrelin可引起胃部不成熟的MMCⅢ相发生,并诱发胃强烈的收缩运动,从而引起MTL分泌的紊乱.NO是广泛存在于胃肠道的非胆碱能非肾上腺素能神经递质,是对胃肠道运动具有抑制作用,主要介导胃容受性舒张的反射活动,还具有对抗乙酰胆碱和MTL对胃的收缩作用,影响胃的缩张,蠕动和排空,其水平过高过低都会导致胃肠动力障碍[20-21].本研究中,B组大鼠血浆MTL含量与A组无差异,但Ghrelin含量上升9.76%,差异显著(P<0.05),胃窦NO含量较A组减少57.48%,差异极显著(P<0.01),以上结果说明饮食失节对FD大鼠MTL含量变化并无影响,而能明显增加大鼠Ghrelin含量,以增强胃肠动力,改善胃肠功能紊乱状态.而在本研究中,B组大鼠胃窦组织NO水平显著低于A组,这与之前报道FD大鼠体内NO含量增加不符,推测可能是由于该组大鼠胃肠动力过弱,机体不再产生抑制性神经递质减弱胃肠运动引起的.
肠道菌群是指生活在肠道中的大量微生物,二者仅仅相依,维持机体肠道及其他各器官功能正常,肠易激综合症(IBS)[22]、克罗恩病[23]以及各种肠道疾病中[24-26],肠道菌群平衡都会被打破,菌群紊乱,引起肠道菌群平衡紊乱的诱因复杂多样,其中饮食是最容易接触肠道菌群的因素.在本研究中,SD大鼠在受到饥饱失常刺激后,肠道菌群发生改变,在OTU水平,B组大鼠肠道菌群种类明显不同于A组.双歧杆菌在胃肠道中具有改善胃肠道功能的作用,缓解肠道炎症和肠易激综合征症状等[27],本研究中B组大鼠肠道中双歧杆菌相对丰度提高1.33%,推测B组大鼠胃肠功能出现障碍.丁酸盐在机体内能够通过肠-脑神经回路降低食欲,并且激活棕色脂肪细胞发挥功能使机体体质量减轻[28],本研究中B组大鼠两种与丁酸盐产生相关的菌Bacteroidales_S24-7_group和Ruminococcaceae相对丰度较A组分别降低14.65%、13.17%,推测这2种菌丰度下降导致该组大鼠体内丁酸盐产生减少,引起大鼠食欲增加,进食量与体质量增加,与上述研究结果一致.另外,B组大鼠肠道内两种与机体糖代谢相关的菌Lactobacillaceae,Enterobacteriaceae相对丰度也增加.基于胃肠激素水平与肠道菌群多样性的变化,本研究在门水平对2者之间的关联进行分析,结果发现,与肥胖关系紧密的厚壁菌门细菌相对丰度与Ghrelin含量呈正相关,而与MTL含量呈负相关,而拟杆菌门则正好相反.根据以上结果可得饮食失节能导致机体肠道菌群发生明显变化,其原因可能是胃肠激素水平变化引起胃肠动力减弱甚至消失,导致肠内容物大量滞留,导致细菌过度繁殖,进而出现肠道菌群失调现象,这种改变可能进一步促进功能性消化不良症的形成.
4 结论
综上,饮食失节在一定时间内能够导致大鼠体质量减轻,进食量增加,且出现胃肠道功能障碍,胃排空速度减慢,Ghrelin含量上升,NO含量下降,并使其大鼠肠道菌群多样性发生变化,这可能是不良饮食导致功能性消化不良的原因之一,具体研究有待深入探索.
