乏脂肪型肾血管平滑肌脂肪瘤1例
2019-03-26朱海冬高嘉林曲永亮王志伟王远涛
朱海冬,高嘉林,曲永亮,王志伟,王远涛
(吉林大学第一医院 泌尿外二科,吉林 长春130021)
肾血管平滑肌脂肪瘤(AML)和肾细胞癌(RCC)分别是肾脏最常见的良性和恶性肿瘤,由于两者治疗方式的差异很大,因此术前的鉴别诊断至关重要。肾AML通常由平滑肌细胞、变形血管和不同比例的脂肪组织组成。大多数情况下,典型的肾AML可以通过用彩色多普勒超声(Doppler ultrasound)、计算机断层扫描(CT)或核磁共振成像(MRI)来诊断,上述检查中见到脂肪影像即可确诊。然而,大约4%-5%的乏脂肪型肾AML通过上述检测技术无法诊断[1]。非典型的或“乏脂肪型”的肾AML和RCC之间在影像学上难于鉴别,容易导致良性的肾AML被误诊为恶性的RCC。
1 病例报告
患者,女性,42岁,无业,已婚。因体检发现右肾占位1天入院。无结节性硬化相关疾病病史及体征。无尿频、尿急、尿痛,无肉眼血尿及发热。查体无泌尿外科阳性体征。实验室检查、肺部CT、消化系彩超检查未见异常。泌尿系统超声检查示右肾集合系统内可见大小约6.0 cm×4.3 cm×4.0 cm低回声,边界清,形态欠整,部分凸出肾外。CDFI:其内及周边可见血流信号。肾脏多排CT平扫及三期增强提示:右侧肾窦见团块状混杂密度影,大小约4.3 cm×6.1 cm,CT值约33-57Hu,与右侧肾盂分界欠清;右侧部分肾盏扩张。动脉期右侧肾窦内肿物明显不均匀强化,随时间延迟强化程度减低。影像诊断:①右侧肾窦凸向肾门占位性病变,考虑肾癌可能性大,不除外肾盂癌,继发右肾轻度积水。肾盂分泌造影提示注入对比剂后,右侧各组肾盏及肾盂饱满,肾盂形态欠规整(图1A-F)。余未见异常。膀胱镜检查:双侧输尿管口喷尿清亮,膀胱内未见异常。综合上述情况,临床诊断为“右肾癌(T1b期)”,于全麻下行后腹腔镜右肾癌根治性切除术。术中无特殊情况。病理检查:右肾切除标本,大小约12.1 cm×7.2 cm×4.9 cm。肾门处可见大小6.1 cm×4.8 cm×4.6 cm的浅黄色肿瘤,边界清晰,部分区域出血。右输尿管未见肿瘤累及(图2A)。HE染色(×200倍)镜下见肿瘤由成片的上皮样细胞组成,胞质透亮或嗜伊红色(图2B)。免疫组化染色示HMB45、SMA、Vimentin阳性。Cytokeratin、CD10、PAX8阴性(图2C-H)。诊断为肾血管平滑肌脂肪瘤。目前术后随访3个月,肾功能良好,未见复发。
2 讨论
肾AML是一种相对少见的肿瘤,其发病率不足0.2%[2],是最常见的良性肾脏肿瘤。该疾病于1911年由Fischer率先报道,1951年由Morgan命名[3]。既往其被认为是一种错构瘤,但最近的证据表明肾AML是一种单克隆而非多克隆来源的肿瘤。现在,AML被认为来源于神经嵴的血管周围上皮样细胞,属于“血管周围上皮样细胞肿瘤”家族的一员[4]。当前,AML被进一步划分为不同的肿瘤亚型,每种亚型都有其独特的病理特征、影像学特点、临床表现[4]。
偶发的肾AML好发于40-60岁的中年女性,女性与男性的比例约以4∶1,一般单发于一侧肾脏,多无症状于体检时发现[1]。AML可伴有结节性硬化症(TSC),此类肿瘤往往为多灶性,且肿瘤体积更大。临床上大约20%-30%的肾AML患者发生TSC,大约50%的TSC患者发生肾AML[1,3]。好发年龄为30-40岁,女性与男性的比例约为2∶1,且多为双侧发病,往往有血尿、腰痛、肾功能不全等临床表现。
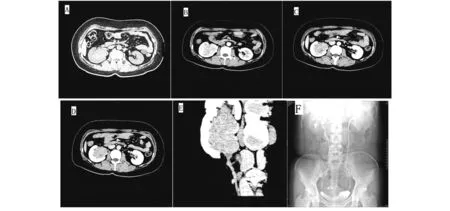
图1 A为CT平扫,B为动脉期,C为静脉期,D为分泌期,E为重建影像,F为肾盂分泌造影
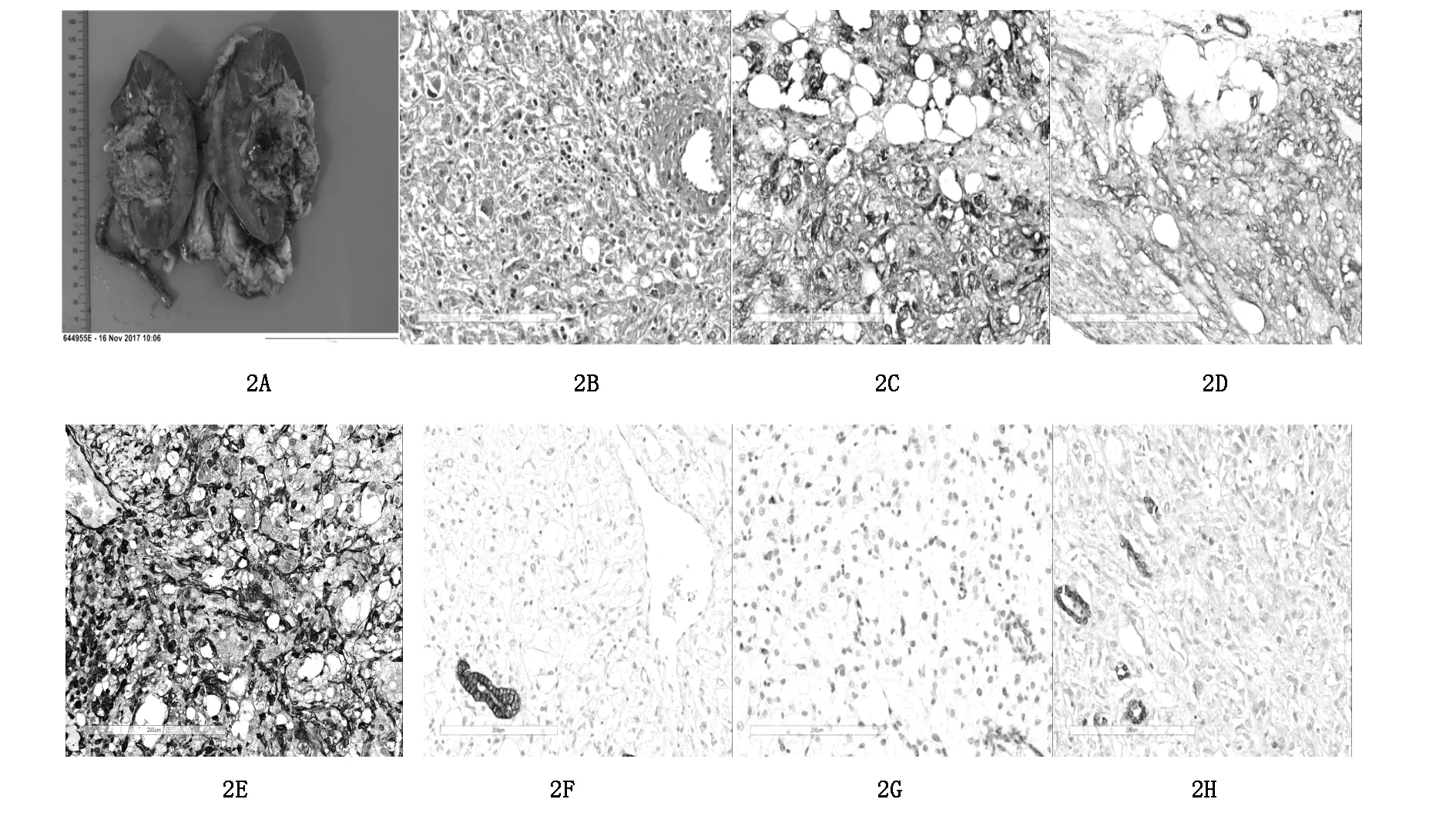
图 2A 肾脏大体标本,2B为HE染色×200倍,2C为HMB45染色×200倍,2D为SMA染色×200倍,2E为Vimentin染色×200倍,2F为Cytokeratin染色×200倍,2G为CD10染色×200倍,2H为PAX8染色×200倍
上皮源性肾AML约占所有AML的8%,往往为乏脂肪型肾AML,且更常见于TSC患者。上皮源性肾AML偶尔会表现出侵袭行为,有33%-40%有恶性变倾向[1, 3,5]。
当肾脏肿瘤缺乏侵袭特征或钙化的情况下,超声提示其为强回声,CT提示其CT值小于-10HU,或者MRI提示存在脂肪影像即可确诊为良性的肾AML。但是,当肾AML的影像学检查未见脂肪影像时,就会被误诊为其他肾脏疾病,特别是RCC。无法见到脂肪影像的原因或者是肿瘤不含有脂肪,或者是脂肪成分极少,传统的影像检测方法无法探及脂肪。这种非典型或乏脂肪型的肾AML占全部肾AML的4%-5%,与RCC难于鉴别,尤其是在病灶小于3-4厘米时[1]。为了减少不必要的影像学检查、手术,术前对乏脂肪型的肾AML的诊断极为重要。
传统超声检查对诊断乏脂肪型AML的灵敏度和特异性极差,无法鉴别肾AML与RCC。最近,增强超声由于具有持续显示肾脏肿瘤的微观和宏观血流的能力,且造影剂毒性小和过敏反应少的优点而获得临床医生的推崇[6-8]。总体来说,与RCC相比,肾AML属于相对少血供、同质的肿瘤,在皮髓质期为均质低强化,分泌期延迟强化,表现为强或等强化。简言之,属于慢进慢出。而RCC更多是异质的、富血供的肿瘤,具有快进快出的特点。此外,假包膜的存在(病灶边缘增强)是RCC的一个共同的特点[8,9]。尽管增强超声能够提供肾肿瘤的血流信息,但是肾AML和RCC之间仍难于鉴别。因此肾脏CT或MRI检查对肾肿瘤性质进一步评估是必要的[8]。
典型的肾AML其CT平扫值小于-10HU,且增强CT时肿瘤无增强。然而,乏脂肪型肾AML,即使采用薄层扫描(2毫米)时其CT值仍>45HU或者处于-10-45HU[4]。因此,乏脂肪型肾AML常常误诊为RCC。现在已经有人阐述乏脂肪型肾AML的CT影像学特征,用以鉴别其与RCC。Yang等确定了四个对诊断乏脂肪型肾AML有指导意义的参数:1)角接口(也被称为“冰淇淋锥模式”,由Kim等人提出[10]);2)低密度环(由微少脂肪产生的影像);3)均匀强化模式;4)平扫CT值为高密度(> 38.5 HU)。以上任何一个单一因素都对RCC有很强的阴性预测意义[3]。Zhang等人也发现乏脂肪型肾AML的CT平扫存在高CT值及瘤内血管等影像特点[11]。Kim等将肿瘤长短径比值,排泄早期增强值,均匀增强存在与否,CT平扫衰减系数、性别和年龄等多种因素结合起来,建立了CT评分系统,用于鉴别乏脂肪型肾AML和RCC,具有较高的准确性、灵敏性和特异性[12]。他们随后证实CT平扫时肿瘤-肾衰减差异>0.75和肿瘤长短轴比值>1.23能够简单而准确的预测乏脂肪型肾AML[13]。也有人通过肿瘤内血容量来鉴别乏脂肪型肾AML和RCC[14]。虽然CT技术将来有望鉴别乏脂肪型肾AML与RCC,但MRI的价值也不应被忽略。
MRI是继超声与CT之后鉴别乏脂肪型肾AML与RCC的检查方法。目前可采用多种MRI技术来诊断乏脂肪型AML。包括脂肪抑制技术、化学位移成像(CSI)、弥散加权成像(DWI)相关的表观弥散系数(ADC)图谱和动态对比增强(DCE)模式等。Chung等发现,评价肾肿瘤时T2加权成像(T2WI)脂肪抑制比无脂肪抑制更有意义,肿瘤与肾比值对于鉴别乏脂肪型肾AML及其他肿瘤具有极高的诊断价值[15]。具体而言,当肿瘤与肾脏信号强度(SI)比值≤0.9时,诊断肾AML的敏感性和特异性分别为90.9%和71.1%。而Hindman等报道乏脂肪型肾AML和RCC的肿瘤与肾脏信号强度(SI)比值无临床意义[16]。包括DWI相关的ADC图谱和DCE模式也无法完全鉴别乏脂肪型肾AML和RCC[17,18]。目前为止,乏脂肪型AML尚无特征性的MRI影像。
虽然对较小的肾脏肿瘤行经皮肾脏穿刺活检尚未成为常规检测方法,但目前已有单位报告穿刺活检的经验[6,19,20]。这些结果表明,接近90%的活检得到了有意义的结果,74%-100%的活检能准确的鉴别肿瘤的良恶性。但由于抽样误差或无法区分肿瘤类型,估计约有20%的肾脏小肿瘤的活检是无意义的。而活检最常见的结果是肾恶性肿瘤,且上述肾脏恶性肿瘤中90%是RCC[6]。不典型的乏脂肪型肾AML几乎完全由平滑肌组成,没有脂肪。当活检普通病理染色无法鉴别良恶性时,免疫组化染色可确定肾AML的诊断,其HMB-45、Melan-A染色强阳性,而其他大多数肾脏肿瘤为阴性[2]。
综上所述,乏脂肪型的肾AML与恶性的RCC的术前鉴别仍然是影像学的难题,通常需要通过活检或手术切除来进行病理组织学诊断。
由于乏脂肪型肾AML术前诊断困难,对于高度怀疑的乏脂肪型肾AML,可选择经皮肾脏穿刺活检加以诊断。如果明确诊断为乏脂肪型AML,对于肿瘤直径小于4厘米的患者可以保守治疗或射频消融术治疗[21,22],也可以选择行保留肾单位肾部分切除术(NSS)。当肿瘤直径大于4厘米时,可选择行NSS或肾切除手术;肿瘤持续出血时,可选择超选择性肾动脉栓塞治疗,待出血减轻或停止后,行NSS或肾切除手术[23]。对于高度怀疑的乏脂肪型AML,不接受或者位置无法行经皮肾脏肿瘤穿刺活检的患者,可依据肿瘤大小、位置等因素分别采取上述方法治疗。基本的治疗原则是能够保留肾脏的,尽量行NSS手术,无法保留肾脏的行肾切除术。
