SPE净化-液质联用测定氨基糖苷类药物残留
2019-03-25陶大利白鹤李琴
陶大利,白鹤,李琴
(农业部乳品质量监督检验测试中心(哈尔滨),哈尔滨150090)
0 引 言
氨基糖苷类抗生素(Aminoglycosides AGs)对革兰氏阴性和阳性菌均有很好的抑杀作用,属于广谱的抗生素[1]。由于这类抗生素具有高效、价廉的特点,是目前在畜牧业、农业、水产养殖业常用的一类兽药[2]。AGs对人体有较大的毒副作用,许多国家和地区都对此类药物做出相应要求美国食品药品监督管理局(FDA)及许多国家和机构针对该类药物在食品中规定了明确的最大残留限量[3],我国在农业部235号公告中也对氨基糖苷类中的部分药物也有明确的最大残留限量[4]。
目前有关AGs类药物检测的方法主要有微生物法[5]、免疫分析法[6]、仪器分析法[7-8]。特别是液相色-谱串联质谱技术在AGs药物检测中的应用,使其在定性定量的准确度和灵敏度方面都起到了很大的推动作用。本文以新霉素、链霉素、卡那霉素、大观霉素为检测对象,建立了快速简便、灵敏度高、特异性强的UPLC-MS/MS的检测方法。
1 实 验
1.1 材料
1.1.1 仪器与试剂
超高效液相色谱-串联质谱仪(ACQUITY UPLC XEVO TQ),配电喷雾离子源,精密电子天平,XS205DU,高速冷冻离心机(sigma 3-30K),自动固相萃取仪(GX-274),色谱柱(ACQUITY CORTECS HILIC 100mm×2.1mm,1.6μm),固相萃取柱(WCX 150 mg/6cc),氮吹仪(TS-18821)。
1.1.2 标准品、试剂
硫酸新霉素批号154704质量分数80.0%;硫酸链霉素批号157741质量分数90.3%;硫酸卡那霉素批号172706质量分数90.1%;硫酸大观霉素批号105688质量分数98.0%。
甲醇(梯度级)、乙腈(梯度级)、甲酸(分析纯)、乙二胺四乙酸二钠(分析纯)、三氯乙酸(分析纯)、氨水(分析纯),实验用水为自制的符合GB/T 6682规定的一级水。
1.1.3 标准溶液、试剂配制
提取液:10%三氯乙酸(含0.4mEDTA),称取100 g三氯乙酸溶解于1 000 mL水中,再加入0.15 g EDTA。标准溶液准确称取10~20 mg硫酸新霉素、硫酸链霉素、硫酸卡那霉素、硫酸大观霉素,用一级水溶解并准确定容至100 mL,需按证书含量换算并校正为新霉素、链霉素、卡那霉素、大观霉素的浓度值。4℃避光保存于塑料瓶中(AGs类易与玻璃制品发生吸附)。
1.2 检测方法
1.2.1 样品提取
称取15 g均质生鲜乳,置于50 mL塑料离心管中,加入10 mL提取液涡旋,超声波提取5 min,转速10 000 r/min离心10 min,上清液转入另一个50 mL离心管中,再用10 mL提取液重复提取,合并两次上清液,用2 mol/L氢氧化钠溶液调p H值到8.0±0.2,用一级水定容至40 mL混匀,再放入离心机转速10 000 r/min离心10 min,上清液备用。取10 mL上自动固相萃取仪净化。
1.2.2 样品净化步骤
WCX柱依次用5 mL甲醇、5 mL水活化,取10 mL上样,10 mL一级水(分2次加入)淋洗、5 mL甲醇淋洗,用20%甲酸甲醇洗脱,45℃氮气吹干,用1 mL体积分数为70%的乙腈水溶液,过0.22μm滤膜上机测试。
1.2.3 液相色谱条件
色谱柱为CORTECSHILIC 100×2.1 mm,1.6μm;柱温为30℃;进样量为10μL;流动相A体积分数为0.2%甲酸水,流动相B体积分数为0.1%甲酸乙腈;梯度洗脱程序如表1所示。
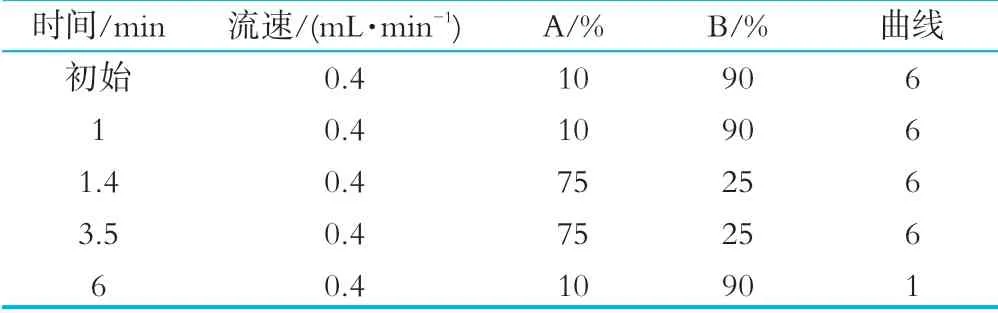
表1 梯度洗脱程序
1.2.4 质谱条件
毛细管电压:3.00 kV;脱溶剂气温度:450℃;脱溶剂气流量:700 L/h;碰撞气(Ar)流量为0.21 mL/min;离子扫描方式:正离子;MRM多反应监测;定性、定量离子对及锥孔电压、碰撞能量分析参数如表2所示。
1.2.5 标准曲线绘制
吸取各标准溶液用70%乙腈水配制成50~2 000 ng/mL标准工作曲线,再分别按照1.2.1和1.2.2步骤处理6个基质空白样品,分别用不同浓度的标准工作液溶解基质过0.22μm滤膜,制成基质标准曲线。
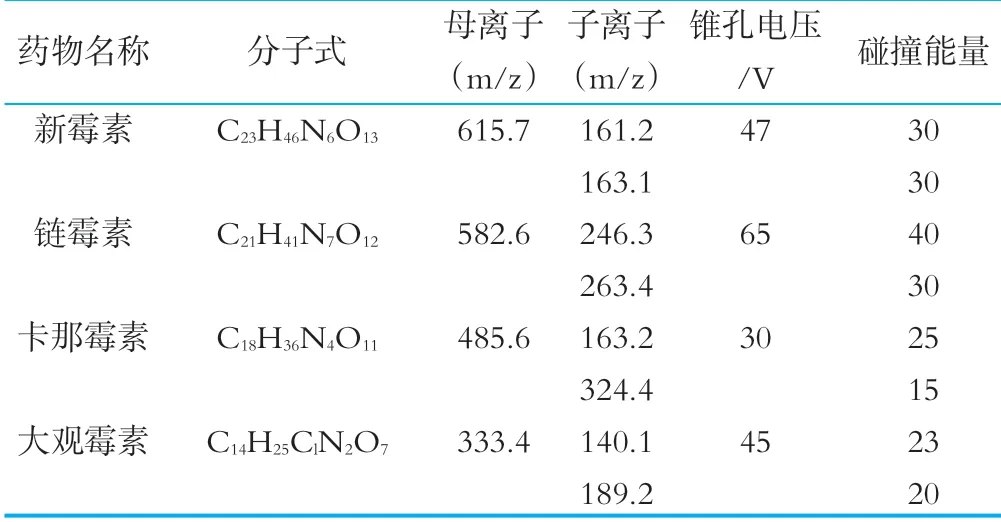
表2 4种氨基糖苷类药物质谱分析参数
2 结果与讨论
2.1 仪器条件的优化
2.1.1 色谱柱的选择
本研究选取了4款不同色谱(BEH C18,HSS T3,BEH HILIC,CORTECSHILIC)柱进行了比较,发现目标物在BEH C18和HSST3上几乎没有保留,这与氨基糖苷类药物含有多个氨基和羟基基团而具有较强的极性,无法用非极性较强的反向色谱柱保留有关。在国标[10]和龚强等[11]采用流动相中加入七氟丁酸,通过离子对试剂的疏水性来降低被测目标物的极性,从而实现在反向色谱柱保留。但七氟丁酸对质谱的灵敏度有较大影响,特别是再做ESI-检测时,仪器的灵敏度影响极大,因此不宜采用。HILIC色谱柱被称作是一种反反向的作用机理,由于固定相表面无任何键合相,氨基糖苷类药物的极性基团易与硅胶固定相相结合,分析过程有较强的保留,由于CORTECSHILIC色谱柱比BEH HILIC色谱柱的粒径更小,分离的峰更尖锐,所以本研究采用CORTECS HILIC色谱柱。
2.1.2 流动相的优化
由于CORTECSHILIC的作用机理与反向C18相反,当流动相中有机相比例大时,目标物在色谱柱上保留就强,随着水的比例的增加,实现目标物与干扰物的分离,目标物可以逐一的洗脱下来。本研究实验了有机相选用甲醇和乙腈,水相选用水、甲酸水溶液、甲酸铵水溶液,实验发现使用乙腈比甲醇的灵敏度更高,在水相中王帅兵等[12]、刘雪红等[13]采用高浓度甲酸铵(200 mmol/L)做流动相,经过测试发现高浓度的甲酸铵会使目标物产生很强的离子抑制现象,4种目标物的灵敏度很低,同时卡那霉素和新霉素严重拖尾,不能满足测试要求;通过对流动相的优化,发现降低缓冲盐浓度会使灵敏度逐渐升高,峰形逐渐改善,通过实验在0.2%甲酸水和0.1%甲酸乙腈的条件下,灵敏度最佳、峰形对称。4种物质MRM(质量浓度800 μg/L)谱图如图1所示。
2.2 样品前处理的优化
2.2.1 样品的提取
由于氨基糖苷类药物易溶于水,而不易溶于有机试剂,所以样品的提取宜采用水或含盐的水溶液,大量文献中采用三氯乙酸溶液提取,生鲜乳基质复杂,含有大量的蛋白质和脂肪,通过实验发现三氯乙酸对生鲜乳中目标物具有良好的提取效率,同时利用其酸性可以有效的沉淀蛋白质和脂肪,获得澄清的溶液,为下一步的净化提供条件。
2.2.2 样品的净化
为满足质谱检测的要求,降低检测的干扰和防止质谱的污染,本方法采用固相萃取的方法对样品净化,通过参考文献,选取C18固相萃取柱、HLB固相萃取柱、WCX固相萃取柱进行试验,在使用C18和HLB固相萃取柱的试验中为增加目标物在固相萃取柱中的保留,样液中添加七氟丁酸和庚烷磺酸钠离子对试剂,测试发现4种目标物回收率仍然不足50%;而WCX固相萃取柱是弱阳离子固相萃取柱,可以通过改变溶液的PH值使固定相带电荷和不带电荷来实现对强碱性物质(氨基糖苷类药物)的吸附和洗脱,从而实现样品的净化,具有高度的选择性。在洗脱步骤中戴辉[14]等用5%甲酸甲醇洗脱,刘雪红[13]等用10%乙酸甲醇洗脱,本研究考察了洗脱液中甲酸体积分数对洗脱效果的影响,分别用体积分数5%,10%,15%,20%,25%甲酸甲醇溶液洗脱,使用量为5 mL,绘制回收率的趋势如图2所示。由图2可以看出,当甲酸过低时不足以将目标物洗脱完全,当甲酸的量达到20%以上时回收率趋于稳定,但甲酸的沸点为102℃,过多的甲酸给氮吹带来困难,所以甲酸的使用量不宜过大,本文选用质量分数为20%甲酸甲醇做洗脱液。

图1 4种氨基糖苷类药物标准溶液(MRM)色谱

图2 不同体积分数浓度甲酸甲醇对回收率趋势图
2.3 方法的线性关系与定量限
用空白基质配制的4种氨基糖苷类药物的标准曲线,链霉素、卡那霉素、大观霉素质量浓度分别为50,100,200,500,1 000,2 000 ng/mL;新霉素质量浓度为100,200,500,1 000,2 000,4 000 ng/mL。以质量浓度为横坐标,以目标物峰面积为纵坐标绘制标准曲线,链霉素、卡那霉素、大观霉素质量浓度在50~2 000 ng/mL之间,新霉素质量浓度在100~4 000 ng/mL之间线性关系良好,相关系数均在0.99以上。以定量离子信噪比大于3计算检出限,以信噪比大于10计算定量限,链霉素、卡那霉素、大观霉素检出限为10μg/kg,定量限为20μg/kg,新霉素检出限为20μg/kg,定量限为40μg/kg。
2.4 准确度和精密度
采用生鲜乳中添加4中目标物的方法进行加标回收率的测定,分别添加定量限、2倍定量限、10倍定量限3个水平,每个浓度水平进行5次重复测试,以加标回收率评价准确度,以相对标准偏差评价精密度,如表3所示。
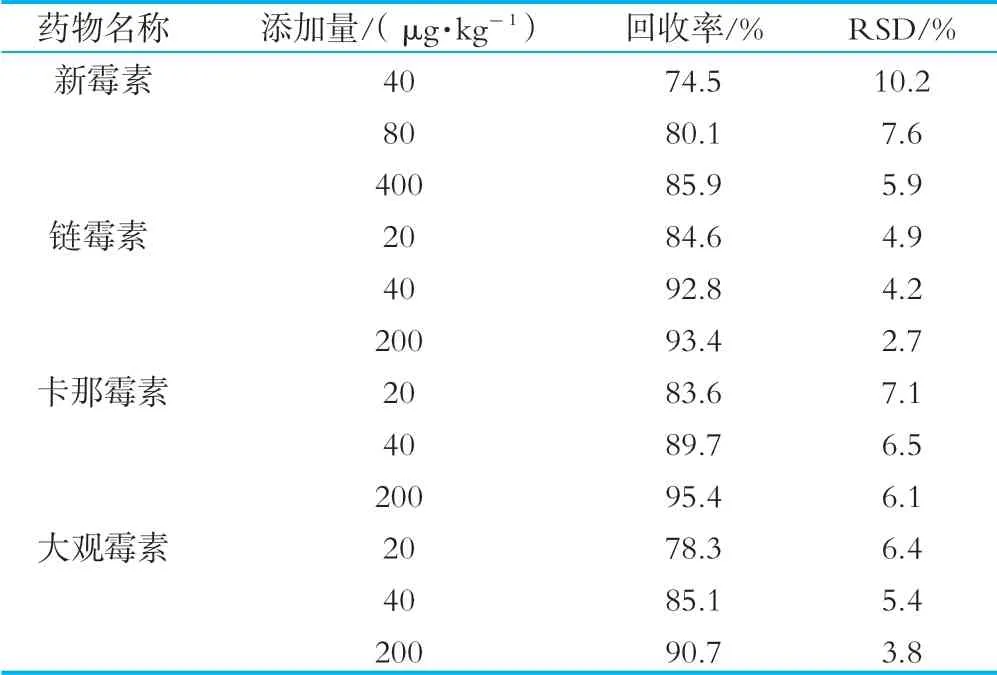
表3 4种氨基糖苷类药物的平均回收率及相对标准偏差
3 结 论
本方法建立了采用固相萃取净化,超高效液相色谱-串联质谱法测定生鲜乳中4种氨基糖苷类药物的方法。优化了样品的净化、色谱及质谱的条件,避免在流动相中使用高浓度缓冲盐和离子对试剂,减少了对仪器的污染。该方法操作简单灵敏度高,能够满足生鲜乳中对氨基糖苷类药物风险评估的确证要求。
