立体定向体部放射治疗对早期胰腺癌患者生存期的影响
2019-03-25耿杨杨刘妮龙朱晓斐汤寅赵宪芝张火俊
耿杨杨 刘妮龙 朱晓斐 汤寅 赵宪芝 张火俊
海军军医大学附属长海医院放疗科,上海 200433
外科手术虽然被认为是胰腺癌唯一根治性的治疗方式,但超过80%的患者初诊时已为晚期不可切除。放射治疗因其可降低局部复发率以及具有潜在的根治作用而被用于胰腺癌的治疗。立体定向体部放疗(stereotactic body radiation therapy,SBRT)相较于常规放疗具有治疗精确度高、靶区外剂量跌落快、疗程短的优势,在大幅度提高肿瘤照射剂量的同时,又可以尽可能降低周围正常组织受照剂量[1]。本研究旨在探讨SBRT治疗早期可切除胰腺癌的疗效与安全性。
资料与方法
一、一般资料
回顾性分析2012年1月至2016年12月间上海长海医院行SBRT治疗的103例早期胰腺癌患者的临床资料,其中男性65例,女性38例,年龄32~88岁,中位年龄67岁。TNM分期为T1-2N0M0。入组标准:(1)经病理学活检及影像学检查结果证实为早期胰腺癌;(2)因基础疾病、一般情况较差、患者或家属拒绝手术等首选放化疗者;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2分;(4)白细胞计数≥3.5×109/L,中性粒细胞计数≥1.5×109/L ,血红蛋白≥100 g/L,血小板计数≥100×109/L ,且肝肾功能指标在正常范围内。排除标准:(1)既往有上腹部放射治疗病史者;(2)合并其他肿瘤包括壶腹癌、胆管癌、十二指肠肿瘤等;(3)存在放化疗禁忌证;(4)同时进行其他治疗。
103例患者中接受联合放化疗者68例,单独放疗者35例。记录患者的体重变化、肿瘤部位、肿瘤临床分期、肿瘤最大径、Charlson年龄并发症指数(Charlson age-comorbidity index,CACI)[2]、全身炎症反应指数(systemic inflammation response index,SIRI)[3]、营养预后指数(prognostic nutritional index,PNI)[4-5]、SBRT前后CA19-9水平(治疗前CA19-9≥74 U/ml且治疗后下降程度≥50%为高水平应答组,治疗前CA19-9≥74 U/ml但治疗后下降程度<50%为高水平无应答组,治疗前CA19-9<74 U/ml为低水平应答组)[6-7]、中位等效生物剂量(biological effective dose,BED10)。
二、治疗方法
放射治疗采用G4射波刀立体定向放射治疗系统。 大体肿瘤体积(gross tumor volume,GTV)包含病灶周围可能存在的亚临床病灶,计划治疗体积(planning tumor volume,PTV)为GTV外放2~5 mm,但若肿瘤紧邻胃肠道,即间隙<3 mm时,GTV可不进行外放。至少90% PTV需被处方剂量线包绕。治疗参数:中位处方剂量37(24.4~46.8 )Gy,中位单次处方剂量7.2(3.7~9.2 )Gy,中位照射次数5(4~8)次,BED1061.9(39.3~88.3)Gy。
化学药物治疗采用以吉西他滨为基础,联合药物包括奥莎利铂、替吉奥(S-1)或S-1及尼妥珠单抗。
三、随访与评价
治疗后每3个月随访1次,复查上腹部增强CT、MR或PET-CT来评估肿瘤的治疗反应。总生存期定义为患者开始接受放疗至死亡或随访截止时间。无疾病进展生存期(progression free survival,PFS)定义为患者开始接受放疗至第一次出现复发或任何原因引起死亡的时间。急性放疗不良反应根据肿瘤放射治疗组(Radiation Therapy Oncology Group,RTOG)急性放射病评分标准进行评估,晚期放疗不良反应根据RTOG和欧洲癌症治疗研究组织(European Organization for Research on the Treatment of Cancer,EORTC)制定的晚期放射反应评分标准。
四、统计学处理
采用SPSS 25.0软件进行统计学分析。利用Kaplan-Meier法计算总生存期和PFS,以M(95%CI)表示,计数资料采用Chi-square检验或Fisher准切概率法。单因素生存分析由log-rank检验完成,将单因素生存分析中有统计学意义的指标进行多因素Cox回归分析。P<0.05为差异有统计学意义。
结 果
一、影响患者总生存期及PFS的单因素及多因素分析
截止随访日期,103例患者中32例(31.1%)生存,71例(68.9%)死亡。103例患者的中位生存期为17.7(16.1~19.3)个月,中位PFS为13.0(10.7~15.3)个月,1年和2年生存率分别为86.3%和24.6%。单因素分析结果显示,联合化疗、BED10及治疗后CA19-9下降程度是影响患者总生存期的独立危险因素(表1)。多因素回归分析结果显示,联合化疗、BED10≥60 Gy及治疗后CA19-9下降>50%的患者有生存获益(表2)。
97例(94.2%)患者最终出现疾病进展,仅6例(5.8%)患者在末次随访时未发生复发或转移。1年和2年PFS生存率分别为54.5%和6.3%。单因素分析结果显示,联合化疗、BED10≥60 Gy及放疗后CA19-9下降>50%是影响PFS的独立危险因素(表1)。多因素回归分析结果提示,联合化疗、BED10≥60 Gy及治疗后CA19-9下降>50%与较长的PFS明显相关(表2)。
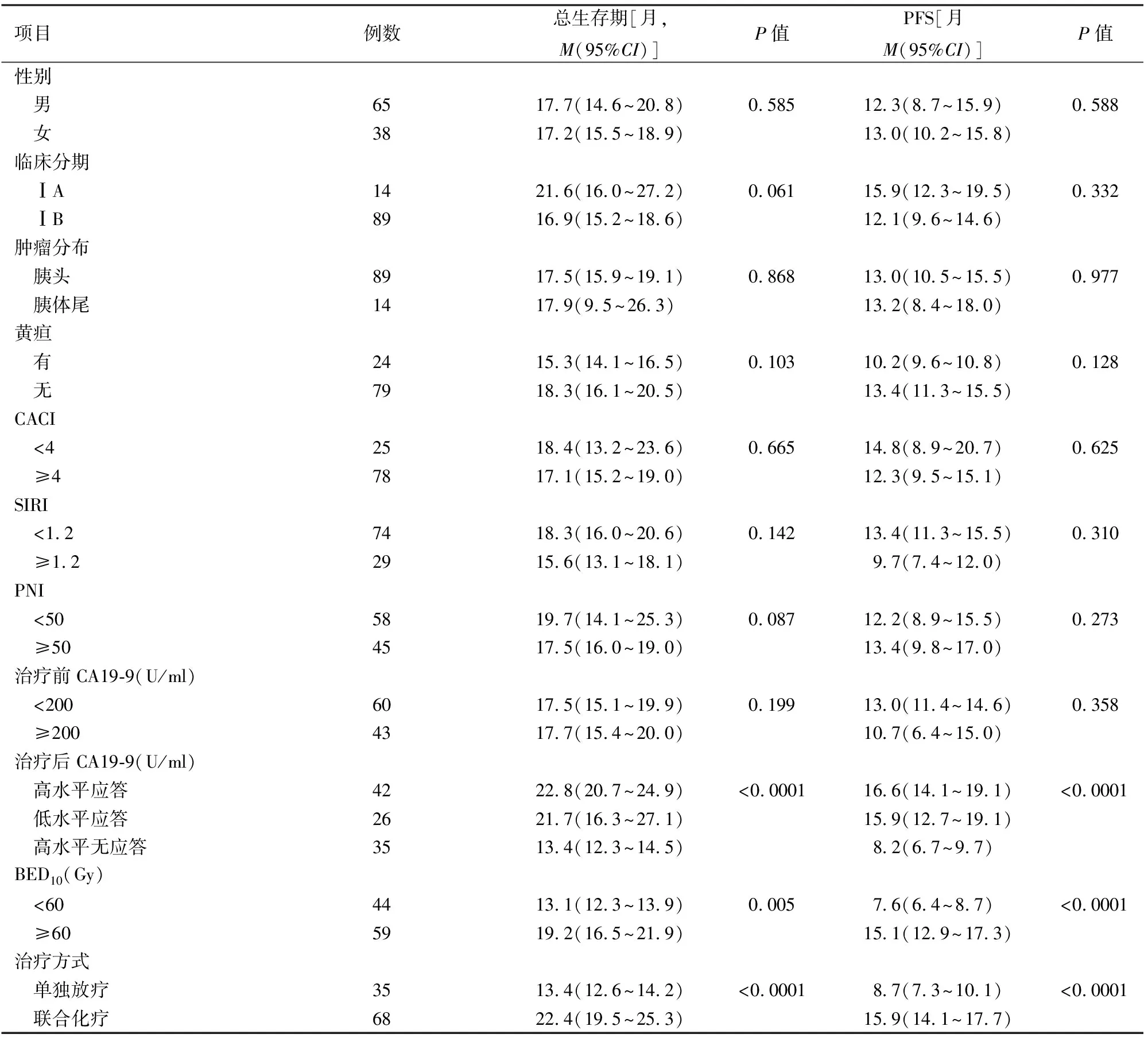
表1 影响早期胰腺癌患者总生存期及PFS的单因素分析
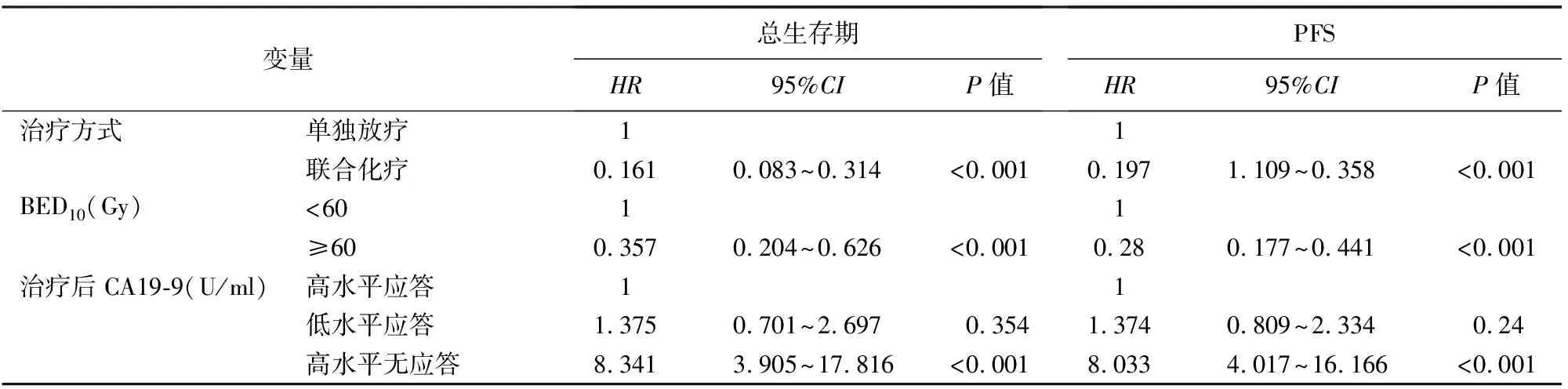
表2 影响早期胰腺癌患者总生存期及PFS的多因素分析
二、放疗不良反应
除1例患者在接受BED10为39.284 Gy放疗时出现不能忍受的腹痛而终止放疗,其余患者均完成治疗计划。16例患者出现1~2级腹痛,无3级以上急性反应及晚期放疗不良反应发生。
讨 论
目前对于早期可切除但临床无法接受手术治疗的胰腺癌患者尚无统一的治疗规范,放疗联合化疗可能是这些患者首选的治疗方法。SBRT较常规放疗具有定位更精准、病灶局部剂量更高、对周围脏器辐射损伤更小等优势,被越来越多地运用于胰腺癌的治疗中[8]。
目前SBRT治疗胰腺癌的报道大多针对局部晚期或晚期胰腺癌,对于SBRT治疗早期胰腺癌的效果及安全性的研究较少。许多前瞻性研究对手术联合或不联合化疗治疗早期胰腺癌的疗效进行了比较分析。单纯手术治疗患者中位总生存期为11~20.2个月,辅助治疗组中位生存期为12.5~29.8个月,新辅助治疗组为9.9~19.4个月。单纯手术患者的中位PFS为5~10.2个月,新辅助或辅助治疗组中位PFS为8.6~15.2个月[9-13]。术前新辅助质子放疗联合卡培他滨化疗的早期胰腺癌患者,术后中位生存期和PFS分别为17个月和10个月[14]。本研究结果显示,103例T1-2N0M0期SBRT治疗患者中位生存期和PFS分别为17.7个月和13.0个月,联合化疗组分别为22.4个月和15.9个月。将手术联合或不联合化疗与本研究结果进行比较,可以发现SBRT联合化疗治疗早期胰腺癌的疗效可能不劣于手术联合化疗的效果。因此对于无法接受手术或者拒绝手术治疗的患者,SBRT可以控制局部病灶,延缓疾病进展并改善生存质量,使患者获得生存受益。
本研究发现接受BED10≥60 Gy的患者明显具有更长的生存期和PFS,Krishnan等[15]也曾报道接受BED10>70 Gy的患者具有较优的生存期。本课题组之前在局部晚期且高龄的患者群体中未发现相似趋势[16],可能的原因是大部分局部晚期高龄患者的放疗的目的为姑息或高姑息性放疗,所以放疗剂量低于本研究中的剂量。因此,较高的放疗剂量可能是SBRT联合化疗的疗效不劣于手术联合化疗疗效的原因。
CA19-9是目前最多应用于胰腺癌诊断与治疗后随访的肿瘤标记物。先前研究结果发现术前CA19-9<37 U/ml患者的术后中位生存期(32~36个月)长于>37 U/ml的患者(12~15个月)[17]。同样有相似结果提示CA19-9<200 U/ml的胰腺癌患者接受术前新辅助治疗的效果更显著[10]。此外,有研究发现CA19-9水平还可以预测患者治疗后的复发情况,即辅助治疗后CA19-9仍升高的患者PFS明显短于辅助治疗后CA19-9水平正常者(10.4个月和29.6个月)[18]。本研究结果显示,SBRT治疗后CA19-9下降明显与较优的生存期和PFS相关,而治疗前CA19-9水平对预后无明显预测作用。因此,CA19-9变化水平对预测放疗患者的预后可能更具有临床意义。
CACI常用来预测患者术后死亡率,被广泛应用于肝癌、肺癌及胃肠道肿瘤等。Asano等[19]报道将CACI用于预测胰腺癌患者术后的预后情况,研究表明CACI<4分的患者生存期明显长于CACI≥4分的患者。SIRI与PNI也可能与胰腺癌患者的预后相关[3-5]。本研究结果表明,单因素生存分析均未发现上述差异,上述指标是否可以评估放疗患者的预后,还有待于进一步研究证实。
利益冲突所有作者声明不存在利益冲突
