台盼蓝、次甲基蓝及健那绿在猪精子活率测定中的比较研究
2019-03-24杨琼邓继辉王振华俞宁
杨琼,邓继辉,王振华,俞宁
(成都农业科技职业学院,四川 温江 611130)
根据某些活体染料能够区别细胞死活的特点,本试验利用台盼蓝、次甲基蓝、健那绿三种染液分别对猪精子进行染色,在不同的染色条件下统计数据,制表分析,筛选出合适的染料、合理的染色时间和染色浓度,从而使精子更容易观察到,测得的精子活率更为准确。
1 材料与方法
1.1 精液的采集和处理 本试验使用的猪精液来自崇州某猪场。借助光学显微镜将精液高倍稀释(采用BTS稀释液),在显微镜下用肉眼观测法估测,以清楚地观察到精子轮廓且精子间有一定的间距为宜[1]。将稀释后的猪精液放入17℃冰箱中保存,待用。
1.2 主要试剂 台盼蓝、次甲基蓝、健那绿购自上海士锋生物科技有限公司;PBS缓冲液(pH值7.4)、0.9%NaCl溶液、BTS 稀释液(pH 值 7.2)来自四川农业大学动物遗传与胚胎工程实验室。
1.3 主要仪器设备 恒温恒湿箱、恒温台、冰箱、超净工作台、实验室干燥箱、超声波清洗机、电子天平、计时器等,Zealway全自动高压灭菌锅、奥林巴斯CH-2正立显微镜等。
1.4 方法
1.4.1 实验准备工作 将载玻片、盖玻片在酸缸中浸泡至少1周,捞出后用清水冲洗掉酸液,反复几次。将玻片放入超声波清洗机中清洗20min(20℃),之后再用纯水漂洗,以不挂水珠为准,晾干。超净工作台经过紫外线照射至少15min,紫外线消毒后,将紫外线杀菌灯换成工作灯,打开风机。实验人员戴上干净的一次性聚乙烯手套和口罩,用酒精喷雾器喷洒手套外表面、移液枪枪头和枪头盒,消毒灭菌,用酒精棉球将台面擦拭干净,结束后再打开紫外灭菌灯,灭菌30min。
使用干净的牛皮纸将载玻片、盖玻片、枪头盒包好,用马克笔标记姓名、指导老师、实验室、日期等信息,将包好的物品放置在高压蒸汽灭菌锅中灭菌(30min,120℃)。灭菌完成后,待显示面板显示压力降到0Pa,显示温度<80℃,才能开盖,取出物品后关闭电源,在干燥箱中烘干,24h后取出、待用。
1.4.2 溶液配制
(1)台盼蓝染液的配制:用电子天平称取4g台盼蓝,加入PBS缓冲液至100 mL,溶解、过滤后,装入塑料试管中,用塑料杯封口膜密封,包裹锡箔纸,4℃保存。使用时用PBS液稀释成0.2%、0.3%、0.35%、0.4%、0.45%、0.5%的浓度梯度。
(2)次甲基蓝染液的配制:取次甲基蓝2.0g,加0.9%NaCl溶液100mL,溶解后过滤,配制成2%次甲基蓝染液。使用时用生理盐水稀释成0.2%、0.4%、0.6%、0.8%、1%、1.5%、2%的浓度梯度。
(3)健那绿染液的配制:将0.5g健那绿溶解于50mL生理盐水中,加温至30~40℃,使其充分溶解,经滤纸过滤后,装入塑料试管中,用塑料杯封口膜密封,包裹锡箔纸。按照此法将健那绿分别配成0.2%、0.4%、0.6%、0.8%、1%、1.2%的浓度梯度,再用生理盐水将1%的健那绿染液稀释为0.02%、0.04%、0.06%、0.08%、0.1%的浓度梯度。
(4)BTS稀释液的配制:依次称取葡萄糖3.700g、柠檬酸钠 0.300g、EDTA 0.125g、碳酸氢钠0.125g、KCl 0.075 g溶解到100 mL灭菌水中,然后用氢氧化钠调节pH值到7.2,使用时加青霉素125μL、链霉素 200μL。
1.4.3 染色方法
(1)台盼蓝抹片染色法:染液、显微镜玻片先在37℃恒温箱中预热[2]。将精液样品充分混匀,用移液枪(量程为 10~100 μL)吸取 5 μL 精液样品和5μL台盼蓝染液于微量离心管中,搅拌混匀,置于37℃恒温箱,待镜检。
镜检时摇匀待测液,取5μL滴于载玻片的右端,取另一张边缘光滑平直的载玻片呈35°角自待测液的左面向右接触,待测液即呈条状分布在两个载玻片接触边缘之间,将上面的载玻片贴着平置的载玻片表面,自右向左移动,带着待测液均匀地涂抹在载玻片上,切忌直接将待测液“推”过去,人为造成精子损伤[3]。置于400倍显微镜下观察,随机选取多个视野,对染色死亡细胞与非染色存活精子数量进行计数[4],保证所有视野中的精子总数≥200个,根据“精子活率=所有视野中存活精子数目/所有视野中总精子数目”公式计算精子的活率,重复数次,取平均值。
(2)台盼蓝滴压染色法:用移液枪取上述待测液3μL于载玻片上,然后盖上盖玻片(22 mm×22 mm),直接用400倍光学显微镜检验,统计染色精子数目和未染色精子数目,计算精子的活率,重复数次,取平均值[4]。
(3)次甲基蓝抹片染色法:用移液枪吸取5μL精液样品和5 μL次甲基蓝染液于微量离心管中,使用移液枪搅拌、混匀,然后吸取5μL于37℃载玻片上,待反应30~40s后,用另一洁净载玻片制作抹片(抹片方式同台盼蓝抹片染色法),然后镜检、计数,计算精子活率。
(4)次甲基蓝滴压染色法:将稀释后的猪精液混匀,取2μL中层精液与2μL次甲基蓝染液于37℃载玻片上,在载玻片上用移液枪充分搅拌均匀,盖上盖玻片,反应 30~40 s,然后镜检、计数,计算精子活率。
(5)健那绿染色方法:同次甲基蓝染色法。1.4.4 制作空白对照组 将未加染液的精液样品单独制片,置于血球计数板上,在恒温(37~38℃)载物台上观察,对不活动的精子进行计数,然后置于恒温干燥箱内(100℃ 2 min)处死所有精子,并计数[5]。精子活率=(所有视野中总精子数目-不活动精子数目)/所有视野中总精子数目。
1.5 统计分析 取稀释后的精液用不同浓度的台盼蓝(0.2%、0.3%、0.35%、0.4%、0.45%、0.5%)、次甲基蓝(0.2%、0.4%、0.6%、0.8%、1%、1.5%、2%)、健那绿(0.02%、0.04%、0.06%、0.08%、0.1%、0.2%、0.4%、0.6%、0.8%、1%、1.2%)于室温下染色,台盼蓝染液又分设 5、10、15、20 min 4个不同的染色时间。染色结束后镜检,计算各样本的精子活率。试验数据用“平均值±标准差”表示,用SPSS22.0软件进行数据分析,采用Duncan's单因素方差分析比较不同染液浓度及不同染色时间下的精子活率。
2 结果与分析
2.1 精子的染色特征 用台盼蓝染液对猪精液染色后,在显微镜下观察到活精子的细胞膜界限分明,呈无色透明状;死精子体积较大,着蓝色,细胞界限模糊难辨。经次甲基蓝染色后,可以观察到绝大部分精子被染上色,整个精子着蓝色,精子细胞膜界限分明,极少数精子透明不着色。经健那绿染色后,可以观察到绝大部分精子被染上蓝色,细胞界限分明,精子尾部中段略膨大,极少数精子不着色,无色透明。
2.2 不同染色条件下猪精子活率的比较
2.2.1 台盼蓝染色后精子活率的比较 采用Duncan's单因素方差分析,比较不同染液浓度及不同染色时间下的精子活率,结果如表1所示。
同一染色时间下,随着台盼蓝染液浓度的提高,精子头部着蓝色的精子数目逐渐增加,由此判断死精子数目不断增加,得出猪精子活率逐渐降低,且降低的幅度大(P<0.05),表明染液浓度对精子活率的影响较大,但染色15 min以内,0.35%、0.4%、0.45%浓度之间的差异不明显。在相同染色浓度下,作用时间越长,被染上色的精子数目越多,即死精子数目增多,精子活率下降。5~10 min内,精子活率下降幅度小(P>0.05),10 min之后,随着时间的延长,精子活率下降幅度增大(P<0.05),表明染色时间对精子活率的影响较大。将测得的精子活率与空白对照组进行对比,得出0.4%台盼蓝染色15 min与对照组差异不显著(P>0.05)。对照组的精子活率为77.87%±0.33%。2.2.2 健那绿、次甲基蓝染色后精子活率的比较 不同染色浓度下,次甲基蓝和健那绿染色后精子活率的测定结果如表2所示。
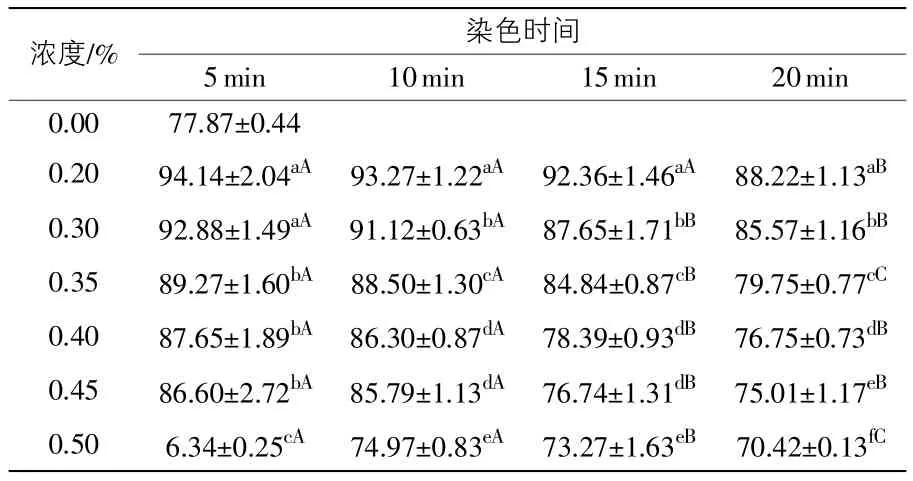
表1 不同浓度台盼蓝在不同染色时间下测得的精子活率
次甲基蓝染液和健那绿染液对精子的染色时间为30~40 s,光学显微镜下观察到视野中绝大多数精子被染上色,极少数精子无色透明、不着色,根据着色情况判断精子的死活,即染色30~40s精子全部死亡。与对照组相比,次甲基蓝、健那绿染色后的精子活率不超过4%。

表2 次甲基蓝、健那绿染色后精子活率的测定结果
3 讨论
精子质膜是精子最外层的细胞结构,膜的完整性是精子维持正常生理功能的基础和基本条件,因此精子膜的完整性常作为评价精子质量的最基本指标,而活体染色剂是目前判断精子质膜完整性最简便的方法之一,台盼蓝则是其中常用的精子活体染色剂之一[6]。
3.1 本次试验对不同染色条件下的精子活率进行了比较,发现染色时间越长、染液浓度越大,精子活率越低。台盼蓝染色时间从5min延长到10 min时,测得的精子活率差异不显著,表明染色时间在10min以内的染色效果差异不明显。染色时间越短,精子染色不充分,部分死精子没有染上色,导致测得的精子活率高于实际精子活率。不同染液浓度下,精子活率差异显著。染液浓度越高,染色越充分,染上色的死精子数目越多,测得的精子活率越低,但染液浓度过大对活精子也有损害,最终使测得的精子活率低于实际精子活率。
3.2 次甲基蓝染液常用于区分酵母细胞的死活,且区分酵母细胞死活的最适染色时间为8 min、最适染色浓度为2%。为了探究次甲基蓝是否可用于精子活率的测定,前期设置的时间梯度为3、5、8、12 min,浓度梯度为 1%、1.5%、2%、2.5%、3%。镜检观察到,绝大部分精子染上了蓝色,随着浓度的增加,染色背景越深,越不易区分染色与否,染上色的精子数目不随着时间的变化而变化。调整染色浓度为0.2%、0.4%、0.6%、0.8%、1%、1.5%、2%,采用立即染色的方式,即在 30~40 s范围内完成染色。结果显示:精子染色效果很明显,整个精子染上蓝色,细胞界限清晰,但是即使用低浓度的次甲基蓝染色,视野中的绝大部分精子也被染上了蓝色,根据染色情况,计算出的精子活率不超过4%,而空白对照组的精子活率为87.67%。所以,次甲基蓝不能用于猪精子活率的测定。
3.3 健那绿属于活体染色剂,专一性染色线粒体,线粒体中的细胞色素氧化酶使健那绿保持在氧化状态呈现蓝绿色,而线粒体周围细胞质中的染料被还原为无色,从而使线粒体显色[7]。为了探究健那绿是否可用于精子活率的测定,前期设置的时间梯度为5、10、15 min,浓度梯度为0.2%、0.4%、0.6%、0.8%、1%、1.2%。采用抹片法或者滴压法制片后,观察到视野中精子混为一体,无法辨别精子形态,健那绿染液吸附精子呈团状,背景杂乱不易观察,且浓度越大,絮状物越多。调整染色浓度为0.02%、0.04%、0.06%、0.08%、0.10%、0.20%、0.40%、0.60%、0.80%、1.00%、1.20%,于30~40s内完成染色。镜检比较各个浓度下的染色情况,发现当浓度大于0.08%时,染色效果差,精液和染液聚集,精子形态不易辨别;当染液浓度小于0.08%时,染色效果好,可以清晰地看到精子颈部、尾部中段膨大,精子染上蓝色,细胞界限清晰。随着浓度降低,精子染色越好,但计算得出的精子活率不超过4%,而空白对照组的精子活率为72.37%。所以,健那绿也不能用于猪精子活率的测定。
次甲基蓝和健那绿在即染方式下几乎对所有精子都染上色,且视野中没有活动的精子,分析原因可能是精子对次甲基蓝和健那绿的毒性很敏感,导致染色30~40s内精子全部死亡,所以通过这两种染料染色与否来判断精子死活并计算精子活率,是不可行的。
4 结论
本次试验得出:当台盼蓝的染色浓度为0.4%、作用时间为15 min时所测得的精子活率较为准确,次甲基蓝、健那绿不能用于猪精子活率的测定。
