沉默IFN-γR表达对大鼠BMMSCs免疫调节能力的影响*
2019-03-21兰绍阳谭梅傲陶双友蔡佳仲康锦花
兰绍阳,谭梅傲,陶双友,蔡佳仲,康锦花,陈 斌△
(广州中医药大学 1第一附属医院脾胃病科, 2第一临床医学院, 3脾胃研究所, 广东 广州 510405)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是存在于骨髓中的多潜能干细胞,能分化为软骨细胞和肝细胞等多种细胞。因为BMMSCs免疫原性弱,是异体干细胞移植治疗的理想细胞[1-3]。近几年研究发现BMMSCs具有免疫调节能力,能用于治疗免疫性肝损伤、移植物抗宿主病和风湿免疫疾病[4-5]。BMMSCs发挥免疫调节能力的机制尚不清楚,一些研究都提示,间充质干细胞发挥免疫调节能力需要受到干扰素γ (interferon-γ,IFN-γ)的激活[6-7],但是另一些研究则未能得出类似结论[8-9]。
RNA干扰(RNA interference,RNAi)是指利用与靶基因同源的双链RNA(double-strand RNA,dsRNA)对靶基因转录后的mRNA分解,从而抑制靶基因表达,该基因在mRNA水平失活而不是删除编码该基因的DNA。与传统的基因敲除方法相比,RNA干扰更容易在高等真核细胞中诱导实现,RNAi技术还可下调单个基因的表达,是研究基因生物学功能的有力工具[10]。短发夹RNA (short hairpin RNA,shRNA)是常用的诱导目的mRNA降解的RNA干扰工具。本实验利用pSicoR-Ef1a-mCh-Puro慢病毒介导shRNA沉默大鼠BMMSCs干扰素γ受体(interferon-γ receptor,IFN-γR)基因,进一步分析沉默间充质干细胞IFN-γR基因表达对其免疫调节能力的影响[11]。
材 料 和 方 法
1 动物及细胞
Wistar雄性大鼠,体重190~220 g,由广州中医药大学动物实验中心提供,许可证号为No.44005800005550;Tran5α感受态细胞购自Transgene;293T细胞株购自ATCC;pSicoR-Ef1a-mCh-Puro购自Invitrogen。
2 主要试剂
LB培养基(生工生物);T4磷酸化酶、T4连接酶、HpaI和XhoI(NEB);pLV-gene(表达红色荧光蛋白RFP)、pGag/Pol、pRev、pVSV-G、RPMI-1640培养基、0.25% Trypsin-EDTA(1×)、Lipofectamine 2000 transfection reagent、逆转录和实时定量PCR(real-time PCR)试剂盒(Invitrogen);Opti-MEM I(1×)和Reduced serum medium(Gibco);polybrene、植物血凝素(phytohaemagglutinin,PHA)、IFN-γ、MTT、白细胞介素10(interleukin-10, IL-10)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA试剂盒(Sigma)。
3 主要方法
3.1大鼠BMMSCs的分离、培养和鉴定 取Wistar大鼠1只,颈椎脱臼法处死,于75%乙醇中浸泡约10 min,无菌手术取出双侧股骨及胫骨。取5 mL注射器,在股骨及胫骨两端各打3个孔,注射器吸取5 mL培养基,插入股骨或胫骨干骺端,将细胞冲洗至培养皿中,反复多次,直至股骨及胫骨发白。以200目金属滤网过滤冲洗液,将过滤后细胞悬液收集至离心管中,800 r/min离心5 min,弃上清,加人适量DMEM培养基混匀,接种于2个25 cm2塑料培养瓶中,于37 ℃、5% CO2、饱和湿度孵育箱中培养48~72 h后更换培养基,约于10~12 d长满约70%~80%瓶底后可用0.125%Trypsin-EDTA消化,1∶2传代培养。
3.2目的干扰片断的选择 针对大鼠IFN-γR基因的核苷酸序列,利用Invitrogen公司shRNA在线设计工具http://rnaidesigner.invitrogen.com/rnaiexpress/设计合成1条shRNA单链寡核苷酸片段,两端含限制性内切酶位点HpaI和XhoI。
3.3shIFNγR-LV慢病毒载体的构建 按照试剂盒说明书构建能沉默IFN-γR基因的慢病毒shIFNγR-LV。简述如下:将pSicoR-Ef1a-mCh-Puro慢病毒载体以HpaI和XhoI双酶切后,在T4连接酶作用下,与双链DNA Oligo于4 ℃连接反应12 h,制备克隆连接液,转化Trans5α感受态细胞,选择阳性克隆进行基因鉴定。以Lipofectamine 2000介导进行慢病毒颗粒的包装。转染前24 h,用胰酶消化对数生长期的293T细胞,传代到10 cm细胞培养皿,37 ℃、5% CO2培养箱内培养24 h。待细胞密度达70%~80%时即可用于转染,转染前将细胞培养基更换为Reduced serum medium。向一个灭菌离心管中加入所制备的DNA 溶液(pLV-gene载体10 μg,pGag/Pol载体5 μg、pRev载体5 μg、pVSV-G载体5 μg),与相应体积的Opti-MEM 混合均匀,调整总体积为1.5 mL。取60 μL Lipofectamine 2000试剂在另一管中与1.5 mL Opti-MEM混合,在室温下温育5 min。把稀释后的DNA与稀释后的Lipofectamine 2000进行混合,轻轻地颠倒混匀,不要振荡。混合后,在室温下温育20 min。将DNA与Lipofectamine 2000混合液转移至293T细胞的培养液中,混匀,于37 ℃、5% CO2细胞培养箱中培养。培养6 h后吸去含有转染混和物的培养基,每瓶细胞中加入含10%胎牛血清的细胞培养基10 mL,于37 ℃、5% CO2培养箱内继续培养。培养48 h后收集细胞上清液,于4 ℃、4 000×g离心10 min,除去细胞碎片。以 0.45 μm滤器过滤上清液于50 mL离心管中。把病毒粗提液样品加入到过滤杯中,盖上盖子。将过滤杯插到滤过液收集管中,5 000×g离心15 min,至需要的病毒浓缩体积。离心结束后,过滤杯中的即为病毒浓缩液,-80 ℃保存。同样方法制备仅含RFP报告基因的阴性对照慢病毒SicoR-NC-LV。
3.4慢病毒滴度测定 稀释法测定病毒滴度。测定前一天,293T细胞铺96孔板,每孔加4×104个细胞,体积为100 μL。准备10个无菌的离心管。在每个管中加入90 μL无血清培养基。将病毒原液10 μL加入到第一个管中,记为1E+1;混匀后,取10 μL加入到第二个管中,记为1E+0。以此类推,继续相同的操作直到最后一管。选取所需的细胞孔,吸去90 μL培养基丢弃。加入90 μL稀释好的病毒溶液。放入培养箱培养。24 h后加入完全培养基100 μL。4 d后拍照观察荧光表达情况。
3.5慢病毒感染大鼠BMMSCs 感染前,37 ℃水浴融化病毒,用培养基适当稀释。加入polybrene,摇匀。常规方法检测感染复数值(multiply of infection, MOI)。BMMSC-shIFNγR组取shIFNγR-LV按照最适MOI值感染大鼠BMMSCs(BMMSC-NC组添加病毒SicoR-NC-LV作为对照),置于37 ℃、5% CO2培养箱内孵育72 h,荧光显微镜下拍照观察,RFP阳性率>95%。
3.6慢病毒感染大鼠BMMSCs后IFN-γR mRNA的real-time PCR检测 分别以shIFNγR-LV和对照病毒SicoR-NC-LV感染BMMSCs,72 h后收集细胞,按照试剂盒提取RNA以及逆转录,按照试剂盒说明书行real-time PCR,扩增实验条件:热变性95 ℃ 120 s;95 ℃ 15 s,60 ℃ 30 s,共40循环。2-ΔΔCt计算基因相对表达倍数。
3.7BMMSCs和脾淋巴细胞的混合培养 实验分组:对照(control)组(淋巴细胞+PHA);BMMSC-NC组(IFN-γ+BMMSCs+SicoR-NC-LV+淋巴细胞+PHA);BMMSC-shIFNγR组(IFN-γ+BMMSCs+shIFNγR-LV+淋巴细胞+PHA),每组设3个复孔,实验重复5次。常规方法制备大鼠脾淋巴细胞悬液,调整细胞浓度至1×109/L备用。以含IFN-γ(5×105U/L)的培养基处理BMMSCs(添加shIFNγR-LV或SicoR-NC-LV)5 d后,将BMMSCs消化、洗涤并计数,调整细胞浓度为2×107L,接种于96 孔板,每孔100 μL。72 h待其贴壁后,以每孔5 μL的丝裂霉素(浓度为1 g/L)处理,37 ℃,30 min。吸去丝裂霉素并清洗干净,在相应组加入备用的淋巴细胞悬液90 μL及PHA(浓度为0.1 g/L)10 μL以刺激淋巴细胞增殖。37 ℃、饱和湿度、5% CO2的孵箱中培养。
3.8标本的收集和检测 (1)脾淋巴细胞活力的检测:各组BMMSCs和脾淋巴细胞混合培养72 h后加入MTT(5 g/L),每孔20 μL。37 ℃,继续孵育4 h,500 r/min离心10 min,弃去孔内培养液。每孔加入150 μL二甲基亚砜(DMSO),振荡10 min,酶标仪490 nm处读取吸光度(A)值。(2)培养上清细胞因子的检测:各组BMMSCs和脾淋巴细胞的混合培养72 h后,收集上层培养基,4 ℃、1 000×g条件下离心10 min,取上清,分装后标记,立即冻存于-80 ℃冰箱。采用ELISA法,按照试剂盒说明书操作,分别检测各组上清液中IL-10及TNF-α的水平。于酶标仪450 nm处读A值,根据标准曲线计算各因子浓度。
4 统计学处理
应用SPSS 17.0软件分析结果。结果用均数±标准差(mean±SD)表示。做方差齐性检验。两组比较采用t检验;多组间两两比较采用方差分析,使用Bonferroni校正的t检验行均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1 shIFNγR-LV慢病毒载体的构建
运用Invitrogen提供的RNA干扰设计工具,并结合RNA干扰设计的原则,寻找合适的靶序列。将编码siRNA的DNA片段设计成发夹结构。发夹结构的两端含限制性内切酶位点HpaI和XhoI。按照试剂盒说明书构建包含有沉默IFN-γR基因的慢病毒载体shIFNγR-LV。shIFNγR序列为 5’-GTTAACAACTGCCTGCGCCAACAAATGTTCTTTCAAGAGAA-GAACATTTGTTGGCGCAGGCTTTTTTCCTCGAG-3’。
2 shIFNγR-LV慢病毒滴度测定
荧光显微镜下见不同程度的红色荧光,证实已有病毒转染入细胞。荧光细胞数随稀释倍数的增加而减少,观察每孔阳性细胞数,利用公式计算病毒滴度(TU/mL)=阳性细胞数/病毒原液量,所得shIFNγR-LV滴度为2×108TU/mL,可满足实验要求,见图1。
3 慢病毒稳定转染大鼠BMMSCs
按照说明书,将shIFNγR-LV以及对照病毒SicoR-NC-LV转染BMMSCs。在荧光显微镜下观察,293T细胞都能够表达RFP,显示较强的红色荧光信号。RFP阳性率>95%,见图2。
4 shIFNγR-LV下调BMMSCs的IFN-γR mRNA表达
将shIFNγR-LV和SicoR-NC-LV分别转染大鼠BMMSCs,real-time PCR检测BMMSC-NC组和BMMSC-shIFNγR组IFN-γR mRNA表达水平,结果显示BMMSC-NC组IFN-γR的mRNA表达水平明显高于BMMSC-shIFNγR组(P<0.05),见图3。
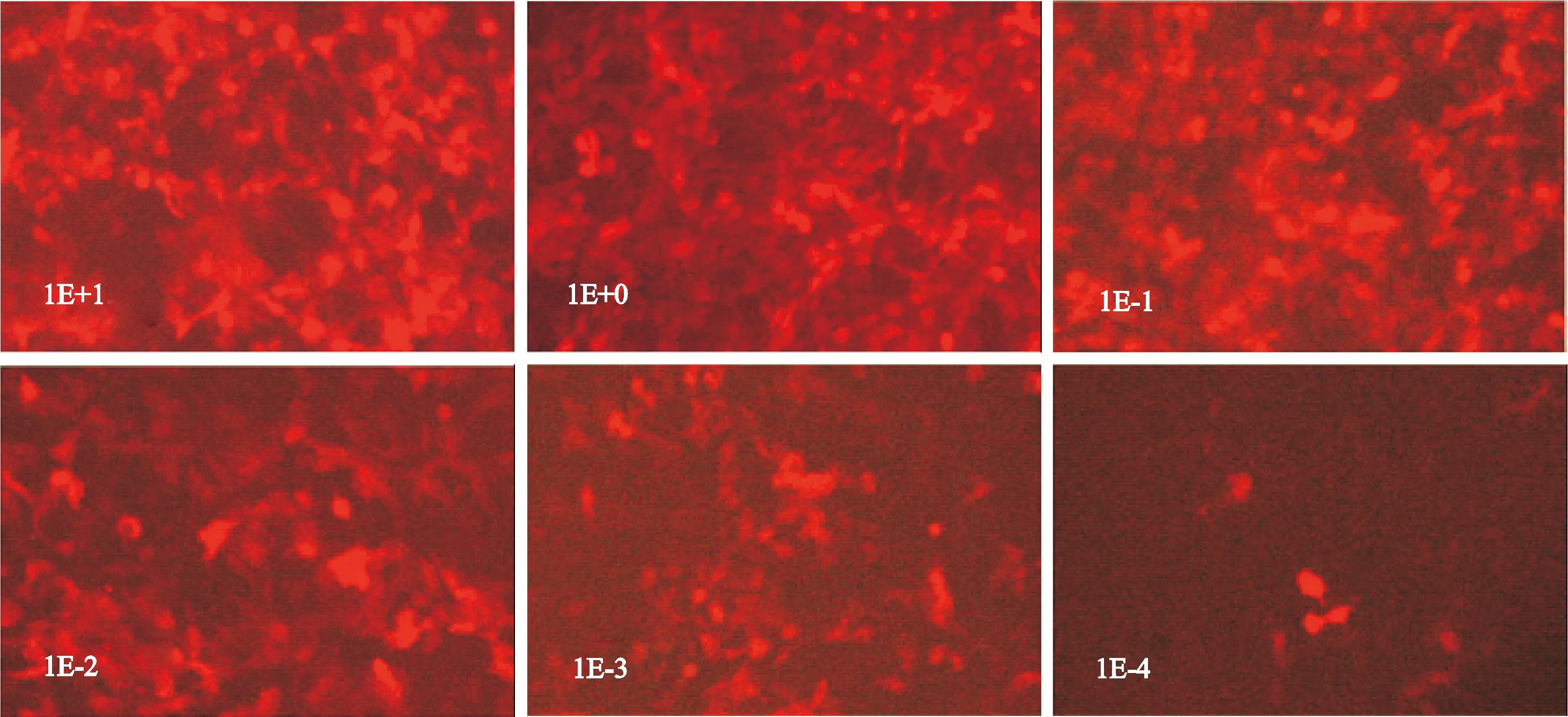
Figure 1.Detection of shIFNγR-LV concentration with dilution method (4 d after transfection;n=5; ×200).
图1稀释法测定shIFNγR-LV滴度
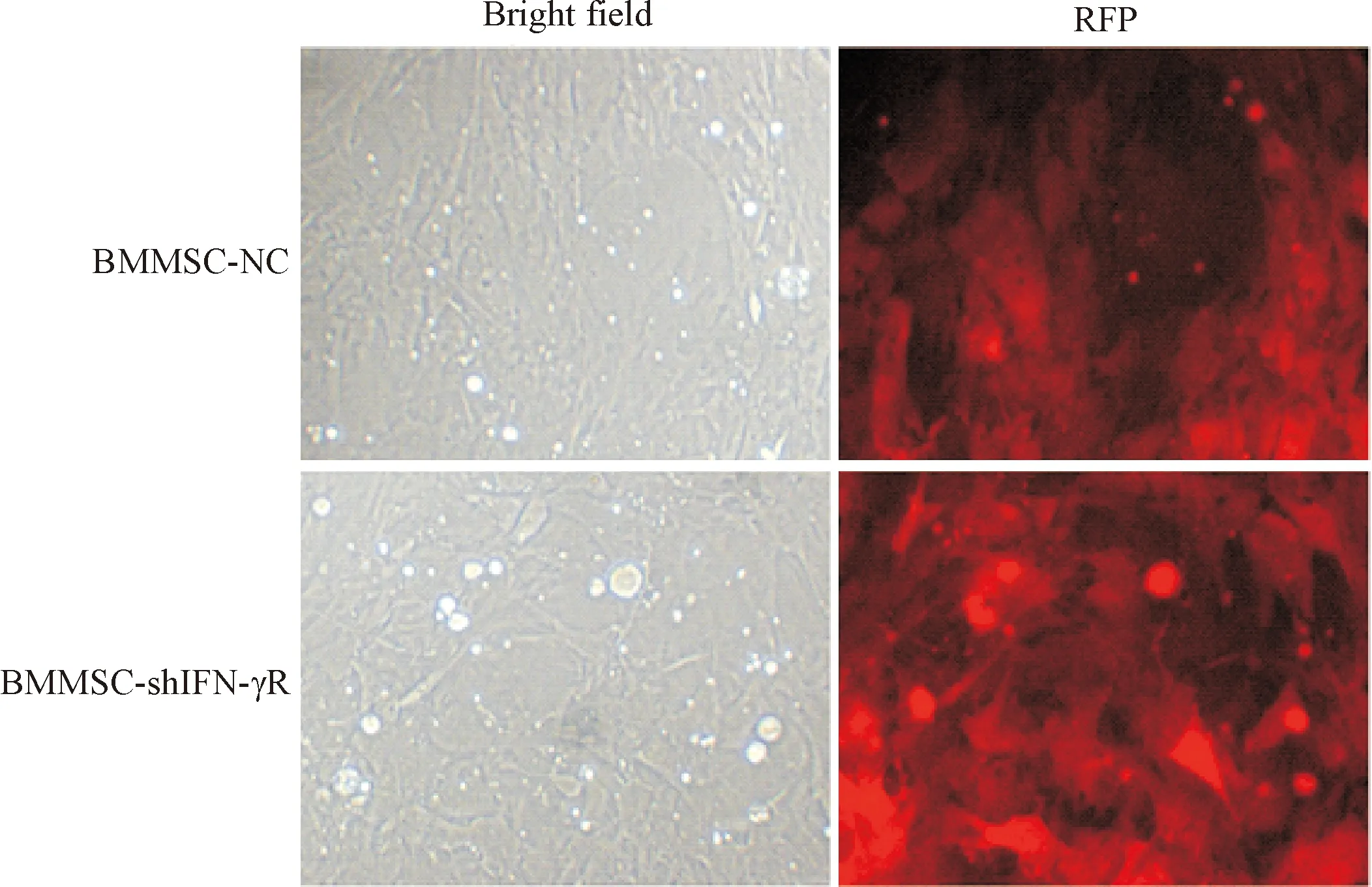
Figure 2.Fluorescence detection of BMMSCs transfected with shIFNγR-LV or SicoR-NC-LV (72 h after transfection;n=5; ×200). BMMSCs in BMMSC-shIFNγR group were transfected with shIFNγR-LV, and BMMSCs in BMMSC-NC group were transfected with SicoR-NC-LV.
图2BMMSCs转染shIFNγR-LV或SicoR-NC-LV后荧光检测
5 混合淋巴细胞反应
对照组、BMMSC-NC组和BMMSC-shIFNγR组大鼠BMMSCs与大鼠脾淋巴细胞混合共孵育72 h,MTT法检测结果显示,BMMSC-NC组、BMMSC-shIFNγR组和对照组的A值分别为0.656±0.008、0.753±0.013和0.801±0.787。BMMSC-NC组的A值明显低于对照组(P<0.05),显示了BMMSCs能抑制淋巴细胞的活力;BMMSC-NC组A值低于BMMSC-shIFNγR组(P<0.05),提示转染shIFNγR-LV后,BMMSCs细胞表面缺乏IFN-γ受体,抑制了IFN-γ信号通路,也抑制了BMMSCs的免疫调节能力,见图4。
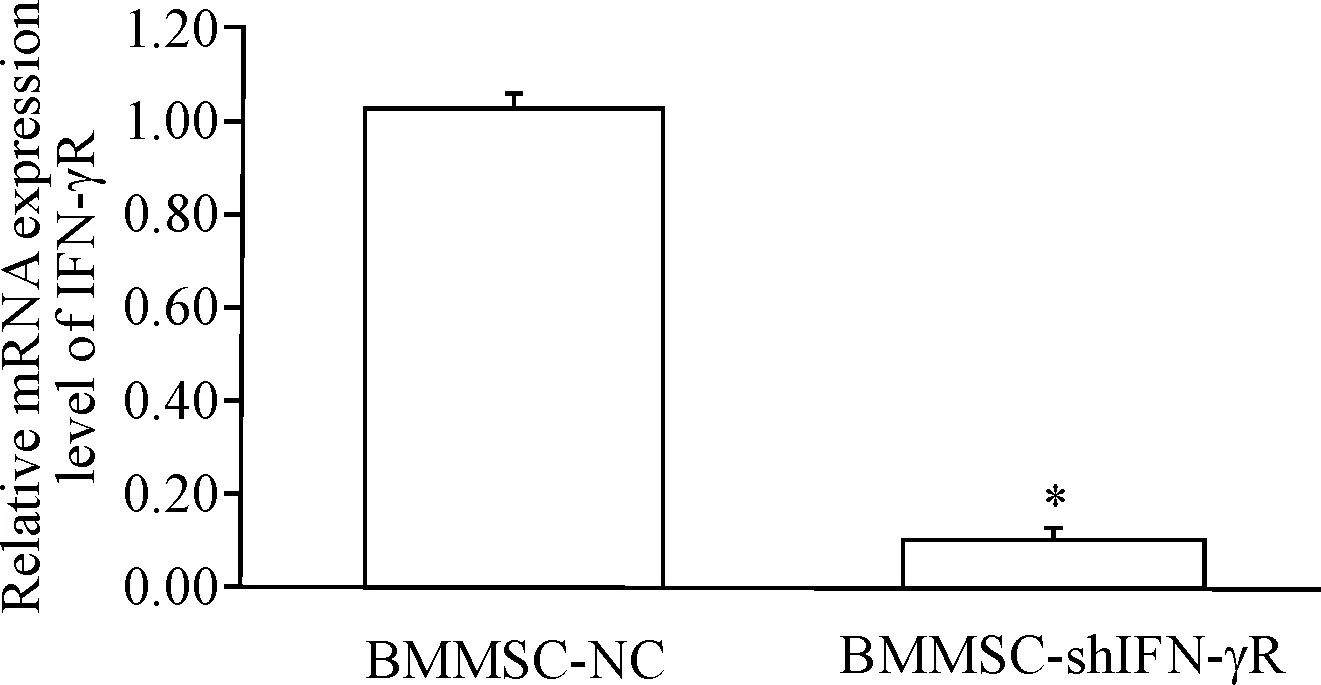
Figure 3.IFN-γR mRNA relative expression. Mean±SD.n=5.*P<0.05 BMMSC-NC group.
图3IFN-γRmRNA相对表达分析
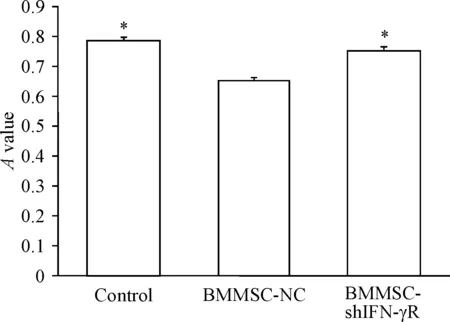
Figure 4.The results of MTT assay for measuring mixed lymphocyte reaction. Mean±SD.n=5.*P<0.05vsBMMSC-NC group.
图4混合淋巴细胞反应的MTT分析
6 混合淋巴细胞反应系统TNF-α和IL-10浓度的分析
混合淋巴细胞反应体系共孵育3 d 后,以ELISA法检测培养上清液中TNF-α和IL-10浓度。与对照组相比,BMMSC-NC组上清液中TNF-α浓度更低而IL-10 浓度更高(P<0.05),显示BMMSCs能抑制TNF-α的分泌,促进IL-10分泌,减轻炎症反应,体现了BMMSCs的免疫调节能力;和BMMSC-NC组相比,BMMSC-shIFNγR组上清液中TNF-α浓度更高,而IL-10浓度更低(P<0.05),提示抑制BMMSCs的IFNγ信号通路会部分消除BMMSCs的免疫调节能力,见图5。
讨 论
间充质干细胞因为低免疫原性和多向分化能力,在异体干细胞移植治疗上有广泛应用前景。随着间充质干细胞在移植物抗宿主病和免疫系统疾病中的应用,间充质干细胞的免疫调节能力日益受到重视。目前认为,在间充质干细胞移植治疗肝衰竭和移植物抗宿主病等疾病时,是免疫调节能力,而不是多向分化能力起主要作用。虽然间充质干细胞的免疫调节能力得到广泛的认可,但是具体发生机制尚不明确。虽然很多研究都提示IFN-γ信号通路在其中扮演重要角色,但是都缺乏充分依据[12]。本研究利用RNA干扰技术,构建一个能沉默间充质干细胞IFN-γ受体基因的慢病毒载体,通过沉默间充质干细胞IFN-γ受体基因,抑制IFN-γ信号通路的激活,最终观察不同IFN-γ信号通路激活状态对间充质干细胞免疫调节能力的影响。
针对IFN-γ受体的基因编码序列,本实验构建了shIFNγR-LV慢病毒干扰载体,能稳定转染到大鼠骨髓间充质干细胞,并能有效下调骨髓间充质干细胞IFN-γ受体基因的表达水平,从而抑制间充质干细胞IFN-γ信号通路活性,为研究IFN-γ信号通路在间充质干细胞免疫调节能力发生机制中的作用提供重要研究工具。
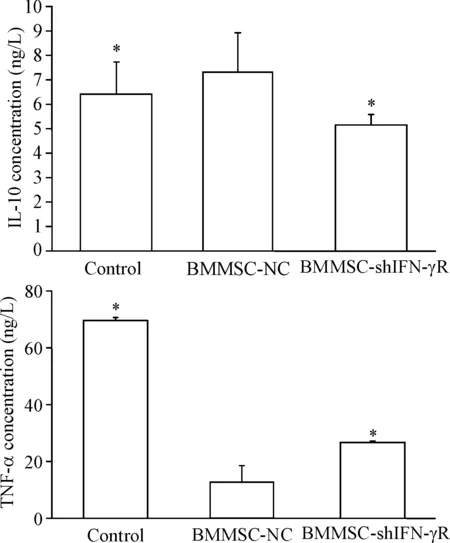
Figure 5.Concentrations of IL-10 and TNF-α in supernatants of mixed lymphocyte reaction system. Mean±SD.n=5.*P<0.05vsBMMSC-NC group.
图5混合淋巴细胞反应体系上清液IL-10和TNF-α浓度
为了研究间充质干细胞的免疫调节能力,本研究进行了混合淋巴细胞培养实验。大鼠骨髓间充质干细胞发挥免疫调节能力,有效抑制脾淋巴细胞的活力,这和多数研究报道一致[13]。沉默大鼠骨髓间充质干细胞IFN-γR基因后,对脾淋巴细胞的增殖反应抑制作用明显减弱,显示免疫调节能力的大幅下调,直接证实了IFN-γ信号通路对间充质干细胞发挥免疫调节能力起到重要作用。进一步对淋巴细胞混合培养体系炎症因子的分析表明,间充质干细胞的免疫调节能力与TNF-α浓度降低以及IL-10的浓度升高有关,体现了抑制免疫炎症反应的作用[14]。而以RNA干扰技术抑制间充质干细胞IFN-γ信号通路后,间充质干细胞降低TNF-α浓度、提高IL-10浓度的能力下降,直接表现为免疫调节能力的下调。
本研究中,无论是对脾淋巴细胞增殖的抑制还是对炎症因子的影响,沉默间充质干细胞IFN-γR基因并不能完全阻断间充质干细胞的免疫调节作用。原因是多方面的:一方面所构建的shIFNγR-LV慢病毒干扰载体并不能完全沉默间充质干细胞IFN-γR基因,导致IFN-γ信号通路的激活不能完全被抑制;另一方面,除了IFN-γ信号通路,间充质干细胞可能也存在其它替代通路来激活其免疫调节能力,虽然这些替代通路所激活的免疫调节能力弱于IFN-γ信号通路的激活作用。
本研究通过利用RNA干扰技术,成功沉默间充质干细胞IFN-γR基因。抑制IFN-γ信号通路可以下调间充质干细胞的免疫调节能力,进一步揭示的IFN-γ信号通路在间充质干细胞免疫调节机制中重要作用,但是其中的具体机制尚需要进一步研究。
