IRAK-1表达水平与COPD大鼠PASMCs分泌PDGF-AB和IL-6的相关性研究*
2019-03-21王鹏雁王昌明郑增光
王鹏雁, 王昌明,郑增光
(1浙江医院重症医学科, 浙江 杭州 310013; 2桂林医学院附属医院呼吸科, 广西 桂林 541001; 3浙江省肿瘤医院病理科, 浙江 杭州 310022)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是常见的慢性疾病,其主要病理特征为炎症反应和血管重塑。作为肺血管重塑的主要效应细胞,肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)在炎症和创伤等刺激下具有合成和分泌功能[1-2]。Toll 样受体(Toll-like receptors, TLRs)可特异性识别多种病原成份,启动固有免疫反应,并进一步诱导适应性免疫应答。有研究显示[3],在哮喘的气道重塑中TLR4信号通道可以调控支气管平滑肌细胞合成并分泌炎症因子;本课题组前期体外实验研究表明[4],TLR4表达水平与COPD大鼠PASMCs合成和分泌功能有关,但其机制仍不清楚。白细胞介素1受体相关激酶(interleukin-1 receptor-associated kinase, IRAK)家族是TLR与白细胞介素1受体信号通路中重要分子,参与细胞内信号网络控制和炎症反应。故本课题通过利用IRAK抑制剂为工具药,探讨其对LPS(lipopolysaccharide,LPS)诱导的COPD大鼠PASMCs分泌功能的影响。
材 料 和 方 法
1 实验动物
健康SPF级Wistar大鼠36只,体重(200±20)g,周龄8~10周,来自桂林医学院实验中心,许可证号为SCXK(桂)2013-0001。
2 主要试剂和仪器
脂多糖购自Sigma;红色果树香烟(贵阳卷烟厂出品,烟气烟碱量1.2 mg;焦油量15 mg);澳洲进口胎牛血清和DMEM/F12培养基(Gibco);抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA、IRAK-1和p-IRAK-1兔单克隆抗体 (Abcam);抗β-actin鼠单克隆抗体(中国中杉金桥公司);总蛋白提取试剂盒和BCA蛋白定量试剂盒(碧云天生物科技有限公司);大鼠血小板源性生长因子AB(platelet-derived growth factor-AB,PDGF-AB)和白细胞介素6(interleukin-6,IL-6) ELISA试剂盒(武汉伊莱瑞特生物公司)。自制烟熏有机玻璃舱(规格91 cm×42 cm×62 cm);细胞培养箱 (Memmer INC108);倒置相差显微镜和荧光倒置显微镜(Olympus);全自动酶标仪和蛋白电泳及转膜仪(Bio-Rad)。
3 实验方法
3.1COPD大鼠动物模型的构建 在实验中心取健康SPF 级 Wistar大鼠36只,雌雄各半,适应环境(温度一般维持22 ℃~25 ℃,湿度保持60%左右,正常饮水、进食)1周后,随机分为空白对照(control)组和COPD模型(COPD)组,各18只;COPD模型组大鼠于实验第1和14天经气道内注入LPS(浓度为1 mg/L)每次200 μg,予自制有机玻璃舱内烟熏2 h/d,上、下午各1次,每次约8~10支烟,共 8周。空白对照组于实验第1和14天经气道注入等量生理盐水,不做其它干预,与COPD模型组大鼠同等条件(温度、湿度、避光强度)饲养8周。
3.2HE染色观察肺组织病理形态学改变 8周后,各组随机取3只大鼠,予10%水合氯醛(30~40 mL/kg)从腹腔注射麻醉大鼠,取出肺组织,予4%多聚甲醛溶液将其固定24 h后,进行脱水、石蜡包埋、切片、脱蜡,HE染色,显微镜下观察各组肺组织病理学改变及测定肺动脉管壁厚度占外径的百分比(WT%)和管壁面积占血管总面积的百分比(WA%)。
3.3PASMCs的分离、培养 及鉴定 将COPD模型组大鼠腹腔注射10%水合氯醛(30~40 mL/kg)麻醉,放入75%乙醇浸泡5 min,开胸取出心肺组织,分离肺动脉3 级以下分支,放入含PBS溶液的培养皿中用镊子分离出中膜平滑肌层。将中膜组织剪成2 mm×2 mm×2 mm小块,加入I型胶原酶(浓度为0.2%)37 ℃水浴消化15~20 min,吸出消化酶,加入DMEM高糖培养液(含25%胎牛血清),置5%CO2、37 ℃培养箱中培养,10 d左右细胞贴壁生长达培养瓶的90%以上时进行消化传代,采用显微镜进行形态学观察及α-SMA免疫荧光染色进行鉴定。
3.4Western blot检测各组PASMCs中IRAK-1蛋白的表达水平 将对照(control)组、LPS组(终浓度为1 mg/L)、IRAK-1/4抑制剂(终浓度为10 μmol/L)组和LPS+IRAK-1/4抑制剂组(以10 μmol/L IRAK1/4抑制剂预处理30 min后加入LPS,终浓度为1 mg/L)PASMCs均培养48 h后裂解细胞,提取总蛋白,检测浓度后计算上样量,在聚丙烯酰胺凝胶泳道中加入3 μL Marker及20 μL的样品组(每孔所含蛋白量统一)进行分离(浓缩胶时电压为80 V,60 min, 在分离胶时为 120 V,30 min),湿式转膜(不同分子量则不同的转膜时间),取出PVDF 膜,加封闭液摇床温育2 h,加入抗IRAK-1和p-IRAK-1兔单克隆抗体 (稀释浓度分别为1∶500和1∶1 000)及抗β-actin鼠单克隆抗体(稀释浓度1∶1 000),4 ℃摇床过夜,次日弃 I 抗,予TBST洗3次,每次10 min,加 II 抗温育1 h(II抗稀释浓度为1∶5 000), 弃 II 抗,予TBST洗3次;每次10 min,加入发光液(A∶B=1∶1),采用ECL超敏发光仪采集图像,Sensi Ansys 凝胶图像分析软件分析条带灰度值。实验重复3次。
3.5ELISA方法检测各组PASMCs培养上清中PDGF-AB和IL-6的含量 将对照组、LPS组、IRAK-1/4抑制剂组和LPS+IRAK-1/4抑制剂组PASMCs均培养48 h后收集上清液,根据PDGF-AB和IL-6 ELISA反应试剂盒严格操作,在酶标仪上设定波长为450 nm时,测各孔的吸光度(A)值,以所测标准品的A值为横坐标,标准品的浓度值为纵坐标,根据相关软件绘制标准曲线,代入样品A值即计算出浓度。
4 统计学分析
用SPSS 18.0软件进行统计分析。计量资料数据用均数±标准差(mean±SD)表示。两个样本组间差异采用t检验,多个样本均数间比较使用单因素方差分析,两两比较方差齐用SNK法,方差不齐时用Games-Howell法;相关性分析采用Pearson correlation检验。以P<0.05为差异有统计学意义。
结 果
1 肺组织病理形态学改变的观察
空白对照组无炎症细胞浸润,肺泡结构完整。COPD模型组大量炎症细胞浸润,肺泡壁断裂、肺大泡形成,肺动脉平滑肌层增厚,见图1。图像分析结果表明,COPD模型组肺动脉出现明显重构,其WT%和WA%均高于空白对照组(P<0.01),见表1。

Figure 1.Lung tissue HE staining in rats (×100).
图1大鼠肺组织HE染色
表1大鼠远端肺动脉HE染色测定WT%和WA%
Table 1.Determination of WT% and WA% by HE staining of distal pulmonary artery in rats (Mean±SD.n=3)

GroupWT%WA%Control 0.284±0.0190.436±0.041COPD0.441±0.094∗∗0.711±0.096∗∗
**P<0.01vscontrol group.
2 COPD大鼠PASMCs光镜观察及α-SMA蛋白的表达
PASMCs呈梭形、聚团生长,当层数增多,重叠堆积成“峰-谷”状,见图2A。α-SMA免疫荧光染色,荧光显微镜下可见细胞质α-SMA蛋白染成红色,胞质中有向细胞两极呈放射状分布的条丝状物,与细胞长轴平行,形态清晰,故认定该细胞为PASMCs,见图2B。
3 Western blot检测各组PASMCs中IRAK-1蛋白的表达水平
与对照组相比,LPS组IRAK-1磷酸化蛋白表达水平升高,IRAK-1非磷酸化蛋白表达下降(P<0.05);与LPS组相比,LPS+IRAK-1/4抑制剂组IRAK-1磷酸化蛋白表达明显降低,IRAK-1非磷酸化蛋白表达升高(P<0.05),见图3。
4 ELISA方法检测各组PASMCs分泌PDGF-AB和IL-6的含量
与对照组相比,LPS组的PDGF-AB和IL-6含量升高(P<0.05);予10 μmol/L IRAK1/4 抑制剂预处理 30 min后,再给予相同浓度LPS刺激,较单纯LPS组,其PDGF-AB和IL-6含量显著下降(P<0.05),见表2。
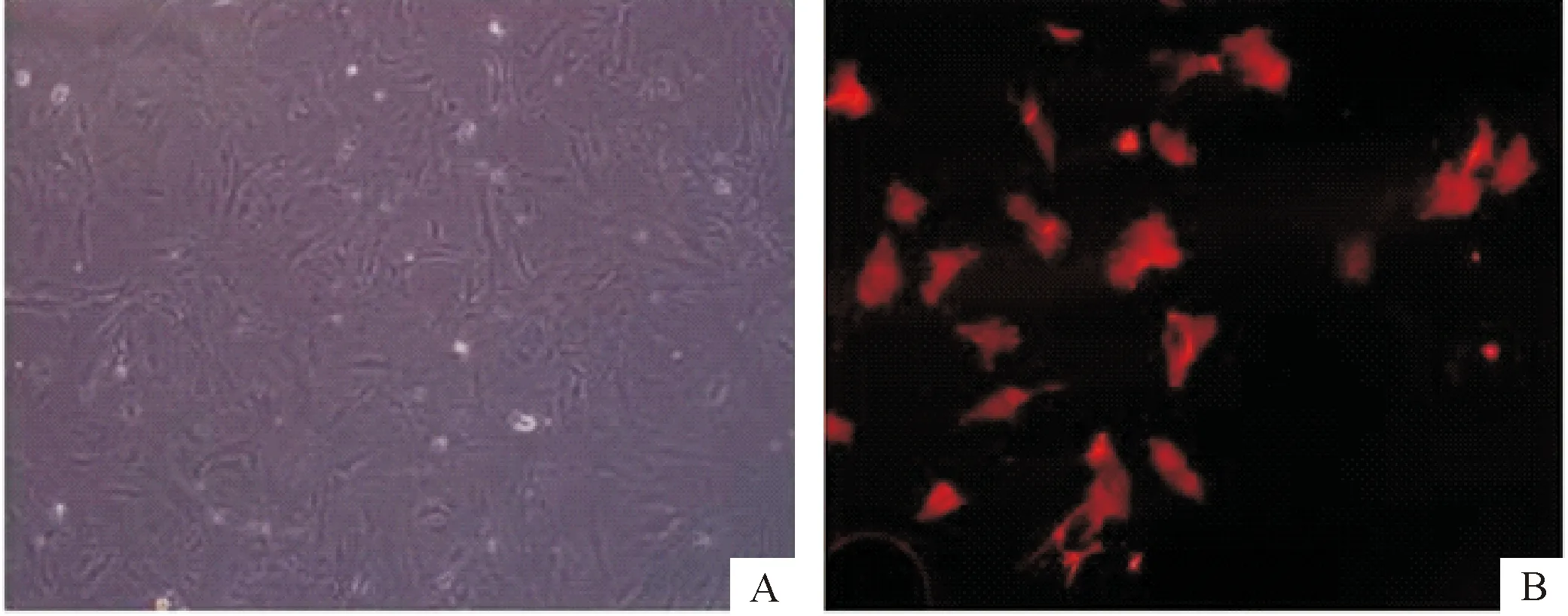
Figure 2.Light microscopicobservation of PASMCs (A) and immunofluorescence staining of α-smooth muscle actin in the PASMCs (B).
图2PASMCs光镜观察及肌动蛋白细胞免疫荧光染色

Figure 3.The effect of IRAK-1/4 inhibitor on IRAK-1 protein expression in PASMCs of COPD rats. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsLPS group.
图3IRAK-1/4抑制剂对COPD大鼠PASMCs上IRAK-1蛋白表达的影响
表2予IRAK1/4抑制剂处理后COPD大鼠PASMCs分泌因子水平的变化
Table 2.The levels of PDGF-AB and IL-6 in culture supernatants of the PASMCs from COPD rats after IRAK-1/4 inhibitor treatment (ng/L. Mean±SD.n=3)

GroupPDGF-ABIL-6Control55.38±5.8791.66±6.78LPS82.39±1.35∗489.57±17.52∗∗IRAK-1/4 inhibitor50.29±0.77##73.90±3.60##LPS+IRAK-1/4 inhibitor62.42±1.97#81.24±0.65##
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsLPS group.
5 IRAK-1磷酸化蛋白表达水平与COPD大鼠PASMCs分泌PDGF-AB和IL-6浓度的相关性分析
COPD大鼠PASMCs IRAK-1磷酸化表达水平与细胞上清液中PDGF-AB和IL-6的浓度呈正相关性(相关系数r分别为0.875和0.949,P<0.05)。
讨 论
COPD是一种慢性疾病,严重影响患者的生存率和死亡率,成为一个重大的公共卫生问题。研究发现早期无缺氧的COPD肺组织已有明显的血管炎症改变及结构重建,且肺动脉高压与COPD预后密切相关[5]。PASMCs不仅仅是肺血管重塑的主要效应细胞,而且扮演着免疫细胞的作用,合成分泌炎症介质促进血管炎症的发展[1-2],因此PASMCs在肺血管重塑中起着重要的作用,但潜在机制尚不完全清楚。本课题前期研究发现LPS诱导下COPD大鼠PASMCs合成分泌功能与TLR4表达存在时间及剂量-效应关系,且呈正相关[4]。但IRAK是否参与调控COPD大鼠PASMCs分泌PDGF-AB和IL-6尚不清楚。
IRAK是细胞内激酶,有多个区域蛋白,包括N末端死亡域和C末端中央激酶域[6]。哺乳动物中发现IRAKs家族4个成员是IRAK-1、IRAK-2、IRAK-4和IRAK-M。IRAK-M的表达仅限于巨噬细胞和单核细胞,而IRAK-1、IRAK-2和IRAK-4则被广泛地表达[7]。IRAK家族可激活多条信号通路,主要包括NF-κB、MAPKs和IFN调节因子在内的信号通路。近来研究发现予IRAK抑制剂处理后,大鼠颈总动脉损伤模型组的TLR4蛋白表达水平和IRAK、IκB磷酸化蛋白表达水平明显降低,且部分炎症因子如IL-β和TNFα的表达水平也显著降低,进而减少大鼠血管平滑肌细胞的增殖及新生内膜的形成[8]。同样,在Toll样受体激活的反应中,IRAK1基因敲除小鼠细胞因子的产量较对照组明显减少[9];IRAK4基因敲除小鼠对TLR激活甚至没有反应[10],以上说明IRAK-1和IRAK-4是Toll样受体与IL-1受体信号传导通路的重要因子,其磷酸化激活在全身炎症反应中扮演着重要角色。
PDGF主要由单核/巨噬细胞合成,研究发现[11]PDGF可促进肌纤维母细胞产生胶原纤维,上调组织金属蛋白酶抑制剂抑制胶原酶的作用,以减少细胞外基质的降解,说明PDGF与血管重塑密切相关。IL-6是一种细胞因子,主要由纤维母细胞、上皮细胞、T淋巴细胞等多种细胞产生,可通过多条信号通路,参与免疫细胞增殖分化、促进血管生成[12]。以上研究表明PDGF和IL-6可促进炎症反应的发展及血管重塑。
本实验通过构建COPD大鼠模型,分离培养原代PASMCs,利用IRAK1/4抑制剂为工具药,采用Western blot检测IRAK1的蛋白水平,ELISA检测炎症因子浓度,以探讨IRAK-1表达水平与COPD大鼠PASMCs分泌PDGF-AB和IL-6的相关性。结果发现与对照组相比,LPS刺激COPD大鼠PASMCs 后,PASMCs中IRAK-1磷酸化蛋白水平及PDGF-AB和IL-6的表达明显升高;予IRAK1/4抑制剂干扰后,PASMCs中IRAK-1磷酸化蛋白表达及PDGF-AB和IL-6的表达显著降低;同时,Pearson相关性分析发现PASMCs IRAK-1磷酸化水平与细胞上清液中PDGF-AB和IL-6的浓度呈正相关性,说明细胞在静息状态下,PASMCs中IRAK-1很少磷酸化,予LPS刺激后,PASMCs中IRAK-1磷酸化蛋白表达明显升高,从而促进PASMCs分泌炎症介质细胞因子,加重COPD病情进展,阻断IRAK1/4可抑制PASMCs分泌炎症介质细胞因子,减少炎症反应的发生。
综上所述, 我们发现IRAK-1参与LPS诱导下COPD大鼠PASMCs分泌PDGF-AB和IL-6,进而加重炎症反应及肺血管重塑。故后续工作拟行体内实验,以IRAK-1/4为干预靶点,探讨防治COPD肺血管重塑的有效措施。
