Nav1.8在足底切口痛模型大鼠背根神经节中表达的研究
2019-03-21孙娇丽李宁波张咸伟
刘 怡 孙娇丽 李宁波 张咸伟
(华中科技大学同济医学院附属同济医院麻醉科,武汉430030)
术后疼痛是最常见的一种急性疼痛。近年来,尽管临床镇痛技术不断改善,仍然有39%~50%的手术病人经历中、重度术后疼痛[1]。术后疼痛发生率高、控制不佳,严重影响了病人的恢复及生活质量,因此术后疼痛的防治仍然是临床实践中迫切需要解决的关键问题。目前认为术后疼痛机制中痛觉过敏是重要环节,敏化机制复杂,且敏化过程尚未明晰。
电压门控钠通道Nav1.8是河豚毒素不敏感(tetrodotoxin-resistant, TTX-R)钠通道,主要在背根神经节(dorsal root ganglion, DRG)小直径C纤维神经元细胞上表达[2]。在疼痛信号的产生和传导过程中,DRG是机体疼痛电信号向脊髓及以上中枢传递的纽带,Nav1.8产生慢失活TTX-R钠电流,是其所在细胞动作电位去极化期钠电流的主要通道。研究发现在SNL、SNI、CCI及骨癌痛模型等多种疼痛模型中大鼠DRG神经元中Nav1.8通道表达上调,TTX-R钠电流明显增加[3~7],应用高选择性Nav1.8阻滞剂可依赖性阻滞SNL、SNI、CCI引起的机械性痛觉过敏[7],且选择性敲除Nav1.8基因的大鼠会表现出对机械性刺激的痛觉缺失[5]。因此,我们推测Nav1.8或与术后痛觉敏化过程有关。
本实验拟检测足底切口痛模型大鼠术后2 h、1 d、2 d、3 d、5 d的行为学变化及L4-L6节段DRG内Nav1.8 mRNA和Nav1.8蛋白的动态表达情况,来探究Nav1.8表达在切口痛诱发的痛觉敏化过程中的作用,为急性术后疼痛的防治提供理论依据。
方 法
1.实验动物及分组
成年雄性SD大鼠36只,体重200~250 g,由华中科技大学同济医学院附属同济医院实验动物中心提供,饲养环境:12小时昼夜周期,室温20~25℃,湿度60%~70%,分笼饲养,通风良好,避免强光及噪声,自由进食和饮水,实验前静养 1周,使其习惯该环境,避免环境对痛阈值测量的影响。随机编号分组为空白对照组 (oh组,n= 6) 和足底切口痛组(n= 30),其中足底切口痛组包括2 h组(n= 6,足底切口痛模型手术后2 h处死)、1 d组(n= 6,术后第1天处死)、2 d组(n= 6,术后第2 d处死)、3 d组(n= 6,术后第3天处死)和5 d组(n= 6,术后第5 d处死)。分别接受疼痛行为学测量,并且在每个相应时间点,从空白对照组和模型手术后组取大鼠左侧L4-L6DRG进行PCR检测(n= 3)和Western Blotting检测(n= 3)。
2.足底切口痛模型的建立
根据Brennan 研究组方法[8]建立足底切口痛模型。大鼠用4%异氟烷诱导麻醉,之后改为2.5%的异氟烷维持麻醉。碘伏消毒大鼠左后足皮肤后,从距离足跟 0.5 cm 处向足趾方向做一长约 1 cm 的切口,分离暴露足底肌肉并纵行切开,保持肌肉完整性。压迫止血,用3-0线缝合皮肤 2 针,术后伤口处涂抹青霉素粉,整个手术过程约为 5 min。空白对照组不作处理。
3.疼痛行为学测量
(1)机械性缩爪阈值(Mechanical withdrawal threshold, MWT)
将大鼠置于底部为网格状的塑料测痛笼中,适应环境30 min。依照Vivancos方法[9],利用电子von Frey纤维丝(UGO BASILE Cat.38450)进行机械性疼痛敏感性测试。将纤维丝尖端垂直施加压力,作用于大鼠左足底中部,当后足迅速撤回时,压力被自动记录。重复测试,直至三次测量值相近(10 g以内),测试间隔时间为10 min,三次测量的平均值即为机械性缩爪阈值。
(2)热刺激缩足反射潜伏期(Thermal withdrawal latency, TWL)
将大鼠置于热痛测试设备中,适应环境30 min。根据Hargreaves等人的方法[10]进行热痛觉敏化测试。热痛刺激仪(UGO BASILE S.R.L 37370)的辐射热源透过热板集中照射左后足掌心处,大鼠出现缩足反应(抬起或舔后爪)时自动切断并记录从照射开始到缩足反应的时间,重复测量三次,每次间隔5 min,三次重复测量的平均值为热刺激缩足反射潜伏期。为避免组织损伤,热痛刺激仪自动切断时间为20 s。
4.实时荧光定量(quantitative real-time PCR, q-PCR)检测Nav1.8mRNA在大鼠DRG中的表达
大鼠于术后2 h、1 d、2 d、3 d、5 d测痛后,深麻醉下分离左侧L4-L6DRG组织,以Trizol法提取DRG总RNA,测定各组RNA样本的浓度和纯度,OD260/OD280比值在1.8-2.0之间满足实验要求。取2 μg 总RNA逆转录成cDNA,在实时荧光定量PCR仪(ABI7900 / illumina eco,7900 Viia7)行PCR。以GAPDH为内参,样本包含3个复孔,以2-△△Ct分析Nav1.8 mRNA的表达水平。扩增条件如下:50℃ 2 min,95℃10 min;95℃ 30 s,60℃30 s,共40个循环。引物序列如下:Nav1.8(正向):5’-CGACGATGGTGAATAACAAG-3’,(反向):5’-GAAAACGACGAAGTACAGGT-3’;GAPDH(正向):5’- ACAGCAACAGGGTGGTGGAC -3’,(反向):5’- TTTGAGGGTGCAGCGAACTT -3’。
5.蛋白质印迹(Western Blot)检测Nav1.8 蛋白在大鼠DRG中的表达水平
大鼠于术后2 h、1 d、2 d、3 d、5 d测痛后,深麻醉下分离左侧L4-L6DRG组织,向DRG组织中加入RIPA裂解缓冲液(碧云天P0013B),冰浴研磨器充分研磨裂解,提取DRG中总蛋白,使用碧云天试剂盒(P0010)检测样品蛋白浓度,蛋白变性后保存至-20℃备用。取40 μg蛋白样品于SDSPAGE凝胶系统上样电泳,半干转法将目的蛋白转移至PVDF膜上,加入5%脱脂奶粉/TBST 20 ml,室温摇床封闭2 h。加入兔Anti-Nav1.8一抗(1:200,Alomone ASC-016)、兔多抗GADPH(1:1 000,杭州贤至生物有限公司AB-P-R 001),4℃孵育过夜。第2 d加入HRP标记羊抗兔二抗(1:50 000,武汉博士德生物工程有限公司BA1054), 37℃摇床孵育2 h。加入TBST缓冲液充分洗涤PVDF膜,于暗室内膜上滴加ECL工作液(Thermo,NCI5079)反应数分钟待荧光带明显后,X光胶片压片,依次放入显影液显影、定影液定影,冲洗、晾干、扫描胶片,用BandScan分析胶片灰度值。
6.统计学方法
研究结果采用均数±标准差(±SD)表示,实验数据图形用GraphPad Prism 7.0软件进行绘制,采用SPSS 23.0软件进行统计学分析,q-PCR、Western blotting数据组间差异采用单因素方差分析(One-way ANOVA),组间疼痛行为学比较采用双因素方差分析(Two-way ANOVA)进行比较。P< 0.05为差异有统计学意义。
结 果
1.足底切口痛模型手术后,大鼠疼痛行为学改变
大鼠足底切口痛模型建立成功,与空白对照组比较,足底切口痛组大鼠术后2 h至术后第5 d MWT明显下降(P< 0.05),且于术后2 h MWT降到最低(见图1A)。足底切口痛模型大鼠术后TWT下降,与空白对照组比较,术后2 h降至最低,差异有统计学意义(P< 0.05),从术后第1 d至术后第5 d开始出现恢复,尽管大鼠疼痛阈值仍然低于对照组,但是没有显示出统计学差异(P> 0.05,见图1B)。
2.足底切口痛模型手术后,大鼠DRG内Nav1.8表达的动态变化
在术前(0 h)及足底切口疼痛模型手术术后2 h、1 d、2 d、3 d及5 d疼痛行为学检测后取大鼠L4-L6DRG组织进行q-PCR和Western blotting检测大鼠DRG内Nav1.8动态变化。结果显示,与空白对照组相比,足底切口痛模型大鼠Nav1.8 mRNA及Nav1.8蛋白在术后2 h表达水平最高(P<0.05),随后Nav1.8表达逐渐恢复,虽表达量仍高于空白组,但差异没有统计学意义(P> 0.05,见图2)。
讨 论
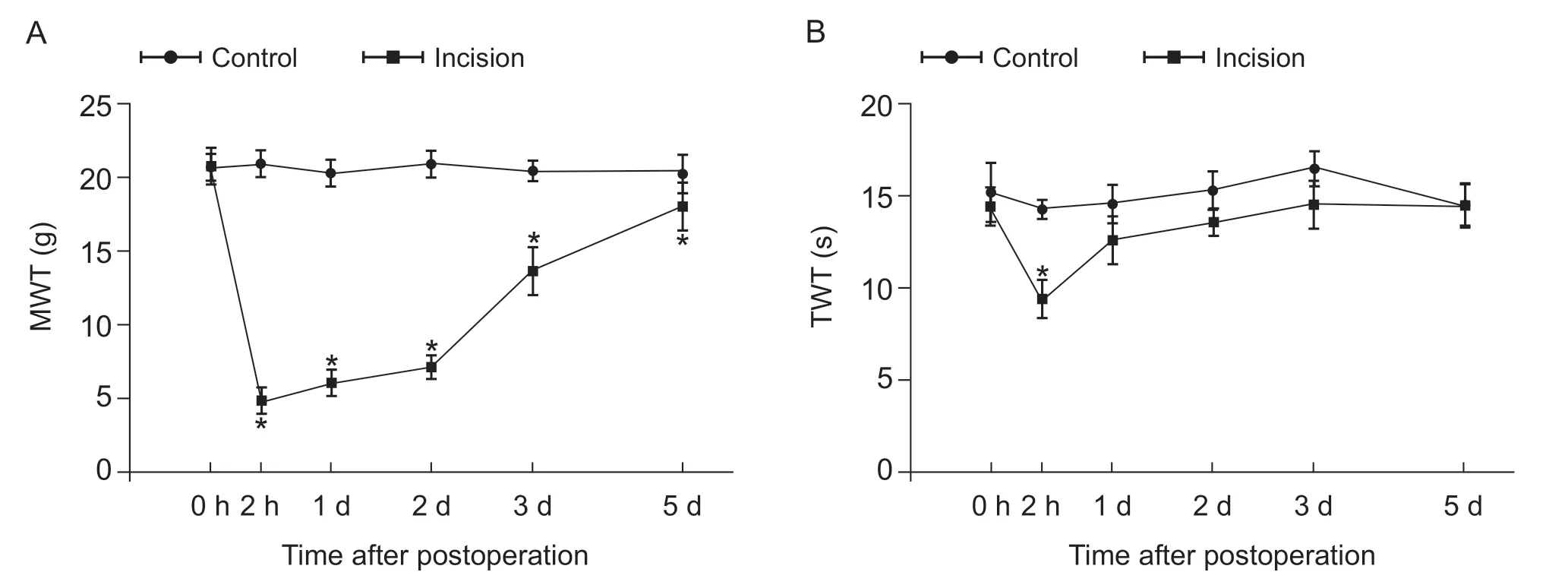
图1 足底切口痛大鼠模型术后疼痛行为学变化 (±SD)(A)机械性缩爪阈值;(B)热刺激缩足反射潜伏期*P < 0.05,与对照组相比Fig.1 Pain-related behavior in rats following plantar incision (±SD)(A) Mechanical latency withrawal threshold; (B)Thermal withdrawal latency*P < 0.05, compared to the control group.
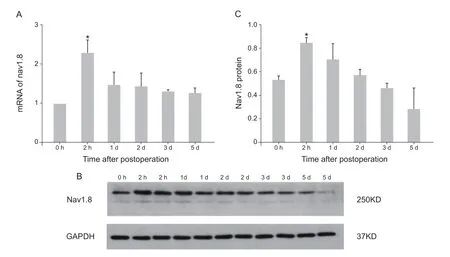
图2 足底切口痛大鼠模型术后DRG内Nav1.8动态表达(±SD)(A) q-PCR检测大鼠DRG内Nav1.8mRNA表达变化;(B) Western blotting检测足底切口痛大鼠模型术后大鼠DRG内Nav1.8蛋白表达变化;(C)足底切口痛大鼠模型术后大鼠DRG内Nav1.8蛋白定量分析 *P < 0.05,与对照组相比Fig.2 Dynamic expression of Nav1.8 in DRG of rats after plantar incision (±SD)(A) Quantitative analysis of Nav1.8 mRNA expression in the DRG after plantar incision; (B) The expression of Nav1.8 in the DRG was analyzed by western blotting; (C) Quantitative analysis of Nav1.8 protein expression in the DRG after plantar incision.*P < 0.05, compared with control.
大鼠足底切口痛模型是模拟人类术后疼痛的可靠动物模型,有助于了解术后疼痛的发生机制,探索术后疼痛防治新方法。术后疼痛是临床最常见的急性疼痛,在临床实践中,术后疼痛包括静息痛和运动痛。本实验采用电子von Frey纤维丝定量机械性疼痛阈值,用热刺激缩足反射潜伏期定量热疼痛阈值,这两种疼痛感觉均类似于临床人类咳嗽诱发的运动痛。本研究的疼痛行为学测量结果显示切口痛模型组大鼠于术后出现痛觉过敏,于术后2 h MWT和TWL降至最低,术后第1 d至5 d痛觉敏化逐渐恢复;PCR和WB结果显示切口痛模型组Nav1.8 mRNA及Nav1.8蛋白在术后2 h表达水平升高,这与何小妹等人发现切口痛模型术后2小时Nav1.8表达上调结果一致[11]。术后第1 d至第5 d Nav1.8表达开始逐渐恢复。Nav1.8 mRNA及蛋白表达于术后2 h同时升至最高,这提示强烈的足底切口疼痛刺激信号传入引起的Nav1.8表达量的变化可能出现在更早时候。细胞膜上Nav1.8的表达是由内质网分泌控制的,受多种炎性或致炎因子的调节,如组胺可以通过 H2受体通路上调初级传入神经元中Nav1.8 的表达从而导致神经病理性痛等,肿瘤坏死因子α能上调 Nav1.8 的表达[6]。最新研究表明足底切口痛模型大鼠DRG内肿瘤坏死因子α表达上调[12],这可能是引起Nav1.8表达上调的机制之一。
电压门控钠通道Nav1.8 主要表达于 89% C、93% Aδ、 60% Aα/β 传入神经元和 88%C 无反应神经元[13],其编码基因为SCN10A。本课题组此前的电生理学研究发现 SCN10A常见突变 rs6795970 参与了非病理情况下 DRG 神经元兴奋性的调节[14]。Nav1.8是产生细胞动作电位去极化期钠电流的最重要通道,参与组织或神经损伤后DRG神经元自发动作电位和异常高频放电等异常电活动,在外周神经的敏化过程中具有重要意义[15]。DRG内Nav1.8的持续上调可引起DRG神经元兴奋性增强,在疼痛信号的产生及传导过程中以及外周疼痛信号向脊髓的传递发挥重要作用。切口痛模型手术后,DRG内Nav1.8表达增加意味着DRG神经元兴奋性增加,DRG向脊髓背角释放递质增加,进一步向中枢传递的疼痛信号增加,最终导致痛觉敏化。本研究中术后2 h痛觉敏化最明显时,Nav1.8表达水平最高;术后第1 d至术后第5 d痛觉敏化逐渐恢复时,Nav1.8表达水平也逐渐下降,足底切口痛模型大鼠术后5 d内的痛觉过敏过程与DRG内Nav1.8表达的动态变化趋势基本一致。这表明Nav1.8参与急性术后疼痛的痛觉敏化过程,可能在急性术后疼痛的发生发展中发挥重要作用。
本研究中足底切口痛大鼠热痛阈值的变化与Nav1.8表达变化一致,术后2 h热痛阈值降至最低时,Nav1.8 mRNA及Nav1.8蛋白表达量最高;术后1 d至术后5 d热痛阈值出现恢复,与空白组比较差异无统计学意义时,Nav1.8 mRNA及Nav1.8蛋白表达量与空白组比较差异也不明显,而此时间段内大鼠机械痛阈值与空白组比较仍具有差异,有研究发现应用Nav 1.8阻滞剂可部分减轻切口痛组大鼠热痛觉过敏[10],这提示足底切口痛模型的热痛觉敏感性与Nav1.8更相关,而机械性痛觉敏感性的变化除受Nav1.8表达的影响,可能还受其他因素的影响。
本实验充分观察了术后2 h后至术后5 d内的痛觉敏化过程与DRG内Nav1.8的表达情况,证实Nav1.8参与切口痛模型大鼠术后痛觉敏化的整个过程。但本实验存在一定局限性,并未明确使用Nav1.8抑制剂是否能减轻切口痛模型大鼠的痛觉敏化。后续实验将进一步验证Nav1.8抑制剂在此模型中的作用,研究Nav1.8在急性术后疼痛痛觉敏化中的作用。
综上所述,足底切口痛模型大鼠术后2 h后至术后5 d内的痛觉敏化过程与DRG内Nav1.8的动态变化趋势基本一致,提示Nav1.8参与急性术后痛觉敏化的形成与维持过程,可能在急性术后疼痛的发生发展中发挥重要作用;大鼠热痛阈值的变化与Nav1.8表达变化一致,切口痛模型的热痛觉敏感性与Nav1.8更相关。本研究为术后痛觉敏化的机制提供新的补充,为完善术后痛觉敏化的机制提供理论基础。
