术后放疗联合替莫唑胺化疗对高级别脑胶质瘤临床疗效及酪氨酸激酶2和血管内皮细胞生长因子表达的影响
2019-03-20刘沛涛
刘沛涛
漯河市第二人民医院神经外科,河南 漯河 462000
脑胶质瘤(brain glioma)为中枢神经系统常见原发性颅内肿瘤,其发病率约占颅内肿瘤总发病率的40%~50%,且为恶性[1]。该病病理类型较多,患者多伴有癫痫、头痛、恶心、呕吐等临床症状。目前,外科手术仍为脑胶质瘤主要治疗措施,但多项研究均表明,高级别脑胶质瘤病灶主要呈浸润性生长,且发生于重要结构,同时,正常脑组织与肿瘤组织间无清晰界限,导致单纯实施手术难以完全切除病灶,术后复发风险较高[2,3]。因此,高级别脑胶质瘤临床治疗方式转向综合治疗,其中放疗及化疗均为脑胶质瘤术后辅助治疗的重要措施[4,5]。但赵东利等学者[6]研究显示,单纯采用放疗的恶性脑胶质瘤患者1、3、5年生存率仅为60.5%、25.5%、14.0%。近些年,替莫唑胺以安全性高、与其他药物无叠加毒性、抗肿瘤谱广等优点在高级别脑胶质瘤化疗治疗中得以推广应用,取得了良好效果[7,8]。本研究选取我院64例高级别脑胶质瘤患者,分组探讨术后放疗联合替莫唑胺化疗对高级别脑胶质瘤临床疗效及酪氨酸激酶2和血管内皮细胞生长因子表达的影响。报告如下。
1 资料与方法
1.1 一般资料 抽取2012年10月至2014年4月我院收治的64例高级别脑胶质瘤患者,通过随机数表法分组,各32例。研究组女15例,男17例;年龄23~65岁,平均(44.63±9.63)岁;肿瘤部位:枕叶8例,顶叶11例,颞叶6例,额叶7例;病理分级:Ⅲ级19例,Ⅳ级13例。对照组女14例,男18例;年龄25~67岁,平均(45.02±10.01)岁;肿瘤部位:枕叶7例,顶叶12例,颞叶4例,额叶9例;病理分级:Ⅲ级20例,Ⅳ级12例。对比两组性别、肿瘤部位、年龄等基线资料无明显差异(P>0.05),可进行对比研究,且本研究经我院伦理委员会审批通过。
1.2 纳入标准 ①符合人民卫生出版社第8版《外科学》中高级别脑胶质瘤临床诊断标准[9];②预计生存期>3个月;③Karnofsky氏(KPS)评分>60分;④血小板>100×109/L,血红蛋白>90g/L,血白细胞>4×109/L;⑤知情同意。
1.3 排除标准 ①既往有化疗及放疗治疗史者;②哺乳期或妊娠期女性;③纳入研究前3个月内采用免疫治疗者;④并发严重内科基础疾病及感染性疾病者。
1.4 方法
1.4.1 对照组 采用放疗联合静脉注射尼莫司汀化疗治疗:设备选用Precise直线加速器,指导患者取平卧位,以热塑面罩将其头部固定,实施CT断层扫描(层厚为5mm),采集解剖图像及数据,并输送至Plato治疗计划系统实施MRI及CT图像融合;勾画靶区与危险器官(OAR),肿瘤靶体积(GTV):术后MRI显示残留病灶与术后残腔,临床靶体积(CTV):GTV外放约2~3cm与周围水肿区域,计划靶体积(PTV):CTV及GTV均外放约0.3cm;分割剂量为GTV-P:2.0~2.2Gy/次,5次/周,DT 60~66Gy/30f,CTV-P:1.8Gy/次,5次/周,DT 56Gy/30f。静脉注射尼莫司汀化疗方案:注尼莫司汀2.5mg/kg,1次/月,共化疗3次。
1.4.2 研究组 采用放疗联合替莫唑胺(江苏天士力帝益药业有限公司,国药准字H20060880),放疗措施及照射剂量同对照组;放疗过程中同步服用替莫唑胺,75mg/(m2·d),放疗结束28d后服用替莫唑胺进行辅助化疗,150mg/(m2·d),连续服用5d,28d为1个周期,连续服用4~6个周期。1、2年后进行随访。
1.5 观察指标 ①疗程结束时统计两组临床疗效,肿瘤完全消失,且1个月内无新病灶出现为完全缓解;肿瘤最大垂直径与最大直径乘积减小≥50%,且1个月内无新病灶出现为部分缓解;肿瘤最大垂直径与最大直径乘积减小或增大≤25%为稳定;肿瘤体积增大>25%或有新病灶出现为进展;有效率=(完全缓解+部分缓解)/总例数×100%,疾病控制率=(完全缓解+部分缓解+稳定)/总例数×100%[10]。②分别于入院时及疗程结束时通过简易智力状态检查量表(MMSE)、日常生活能力量表(ADL)对两组认知功能及日常生活能力进行评估,其中MMSE分值范围为0~30分,分值越高表明认知功能越良好;ADL分值范围为0~56分,分值越高日常生活能力越强[11]。③选用美国BIO-TEK公司生产的ELX800酶标仪,试剂盒由北京欧蒙生物技术有限公司提供,通过双抗体夹心法测定酪氨酸激酶2(DDR2)和血管内皮细胞生长因子(VEGF)水平。④统计对比两组不良反应发生率,根据NCI毒性分级标准将不良反应分为Ⅰ~Ⅳ度。⑤统计对比两组1、2年生存率。
1.6 统计学分析 通过SPSS20.0进行数据分析,以表示计量资料,配对t检验;以[例(%)]表示计数资料,配对χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较 研究组治疗有效率(65.63%)、疾病控制率(87.50%)高于对照组(40.63%、65.63%),差异有统计学意义(P<0.05)。详见表1。
2.2 两组治疗前后 MMSE及ADL评分变化比较 治疗前两组MMSE及ADL评分比较,差异无统计学意义(P>0.05),治疗后两组各指标评分均较治疗前增高,且研究组MMSE及ADL评分高于对照组,差异有统计学意义(P<0.05)。详见表2。
2.3 两组治疗前后 DDR2及VEGF OD值变化比较 治疗前两组DDR2及VEGFOD值比较,差异无统计学意义(P>0.05),治疗后两组各指标OD值均较治疗前降低,且研究组DDR2及VEGF OD值低于对照组,差异有统计学意义(P<0.05)。详见表3。
2.4 两组不良反应发生率比较 两组均无患者出现Ⅲ及Ⅳ度不良反应,研究组呕吐、恶心、脱发、骨髓抑制发生率(40.63%、50.00%、34.37%、31.25%)与对照组(37.50%、43.75%、34.37%、25.00%)比较,差异均无统计学意义(P>0.05)。详见表4。
2.5 两组1、2年生存率比较 研究组随访1年生存率(81.25%)与对照组(78.13%)比较,差异无统计学意义(P>0.05),研究组随访2年生存率(65.63%)高于对照组(40.63%),差异有统计学意义(P<0.05)。详见表5。
表 2 两组治疗前后MMSE及ADL评分变化比较分)Tab 2 Comparison of MMSE and ADL scores before and after treatment in two groups points)
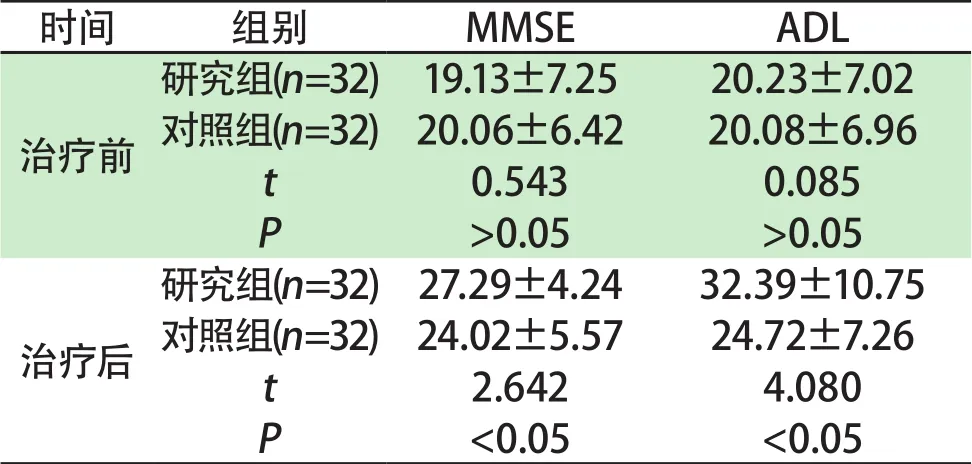
表 2 两组治疗前后MMSE及ADL评分变化比较分)Tab 2 Comparison of MMSE and ADL scores before and after treatment in two groups points)
时间 组别 MMSE ADL治疗前研究组(n=32) 19.13±7.25 20.23±7.02对照组(n=32)20.06±6.42 20.08±6.96 t 0.543 0.085 P>0.05 >0.05治疗后研究组(n=32)27.29±4.24 32.39±10.75对照组(n=32)24.02±5.57 24.72±7.26 t 2.642 4.080 P<0.05 <0.05
表 3 两组治疗前后DDR2及VEGF OD值变化比较Tab 3 Comparison of DDR2 and VEGF before and after treatment in two groups

表 3 两组治疗前后DDR2及VEGF OD值变化比较Tab 3 Comparison of DDR2 and VEGF before and after treatment in two groups
时间 组别 DDR2 VEGF治疗前研究组(n=32)31.471±6.783 0.847±0.204对照组(n=32)30.872±6.414 0.851±0.197 t 0.363 0.080 P>0.05 >0.05治疗后研究组(n=32)21.365±5.416 0.147±0.133对照组(n=32)25.477±6.024 0.304±0.158 t 2.872 4.300 P<0.05 <0.05

表 4 两组不良反应发生率比较[例(%)]Tab 4 Comparison of the incidence of adverse reactions in the two groups[cases(%)]
3 讨论
脑胶质瘤主要发病于神经外胚层,属神经上皮肿瘤,是人类中枢神经系统多发恶性肿瘤疾病。Macdonald Glenn等[12]研究指出,高级别脑胶质瘤好发于30~40岁,由于肿瘤生长过度侵占正常脑组织空间而发生占位效应,导致患者颅内压增高。此外,高级别脑胶质瘤周边组织浸润较广泛,且肿瘤无边界,进展较快,因此,临床疗效及预后较差,其有效治疗仍是当前研究难点[13,14]。
目前,外科手术仍为脑胶质瘤主要治疗方式,毛德强等学者[15]认为,通过外科手术治疗脑胶质瘤,不仅能进行明确诊断,且能切除肿瘤,降低颅内压,减小肿瘤、缓解临床症状,但受脑胶质瘤生物学特点(浸润广泛、肿瘤无边界等)影响,仅实施手术难以彻底切除病灶,且即使于显微镜下完全将肿瘤切除,并将切除边缘向外扩至2cm范围组织,仍可有2%肿瘤细胞发生残留。Christina 等[16]表明,高级别脑胶质瘤具有原位复发特性,且多发生于距原发病灶2cm左右范围中,而通过放疗可有效杀除残余肿瘤细胞,降低疾病复发风险,提高生存率。本研究结果显示,治疗后两组DDR2及VEGF OD值均较治疗前改善,进一步佐证术后放疗对改善高级别脑胶质瘤患者临床疗效意义重大,其主要原因在于本研究根据高级别脑胶质瘤患者肿瘤部位及形态对靶区照射剂量予以调整,并集中照射肿瘤部位,可显著改善治疗效果。

表 1 两组临床疗效比较[例(%)]Tab 1 Comparison of clinical efficacy between the two groups[cases(%)]
另从本研究可知,研究组临床疗效、DDR2及VEGFOD值优于对照组(P<0.05),表明术后放疗联合替莫唑胺化疗治疗高级别脑胶质瘤效果更佳。高级别脑胶质瘤发病、进展及转归与肿瘤血管生成关系密切,通过抑制肿瘤血管生成,可减少肿瘤营养成分摄取量,以此减慢或抑制肿瘤生长,致使肿瘤处于休眠状态。孙文博学者[17]表明,新毛细血管生成需不同连续步骤、介导及抑制多种血管生成因子(生长因子、趋化因子等)。新血管生成为评估高级别脑胶质瘤恶性程度及预后的重要指标,VEGF在内皮细胞移行与增殖过程中具有重要参与,高级别脑胶质瘤内肿瘤分泌VEGF明显高于正常脑组织与其他正常器官。若VEGF表达水平增高,则会促进脑胶质瘤血管增长,进而为脑胶质瘤细胞生长提供充足营养成分,加剧病情。而DDR2为分布较广泛的高度保守受体型酪氨酸激酶,其能促使细胞内基质金属蛋白酶合成及分泌。国外大量研究证实,高级别脑胶质瘤发病及进展过程中伴有低氧、炎症等微环境异常变化,此类因素可上调脑胶质瘤细胞内DDR2表达水平,并使其分泌大量基质金属蛋白酶,推动肿瘤进展[18,19]。同时,DDR2含量越高,高级别脑胶质瘤细胞转移能力更强,其恶性程度及侵袭性越高。
李子煌[20]及Grossman Harry[21]等指出,替莫唑胺分子量较小,可于正常生理PH值条件下直接转化为具有生理活性的物质,且无需其他介质帮助,并发挥较高细胞毒作用。同时,替莫唑胺进入人体后于1~2h内血药浓度即可上升至峰值,发挥药效,并能轻易透过血脑屏障直接作用于靶细胞,且其和蛋白结合率仅为15%左右,能有效避免和其他药物产生相互作用。同时,研究组MMSE及ADL评分、2年生存率优于对照组(P<0.05),表明该联合干预方案在改善高级别脑胶质瘤患者认知功能及日常生活活动能力、提高生存率方面具有积极意义。主要是因放疗在对肿瘤病变实施局部治疗同时,可损坏血脑屏障,利于替莫唑胺作用于全身组织,消除潜在病灶,控制肿瘤细胞转移。此外,Jeyapalan Jerrold等[22]表明,肿瘤细胞所处周期与其对放射线敏感性关系密切,而替莫唑胺为新型烷化剂,可对G1期肿瘤细胞形成周期特异性而发挥细胞毒作用,与放疗联合治疗可显著提升肿瘤细胞杀除效果。同时,替莫唑胺可改善肿瘤细胞缺氧情况及局部血液循环,增强肿瘤细胞对放射线敏感性,进而提高放疗效果。本研究中,两组均未出现Ⅲ及Ⅳ度不良反应,且两组各不良反应发生率间无明显差异(P>0.05),表明放化疗联合治疗高级别脑胶质瘤不仅效果显著,且安全性较为可靠。
综上所述,术后放疗联合替莫唑胺化疗治疗高级别脑胶质瘤效果显著,可有效降低酪氨酸激酶2和血管内皮细胞生长因子表达水平,改善患者认知功能及日常生活能力,提高治疗效果及生存率,且安全性较高。
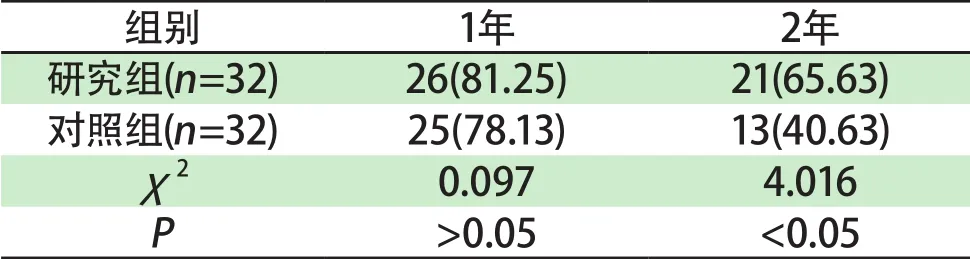
表 5 两组1、2年生存率比较[例(%)]Tab 5 Comparison of 1 and 2 year survival rates in two groups[cases(%)]
