脊柱结核并发骨质疏松症患者应用抗骨质疏松药物的疗效分析
2019-03-19李柯马远征李大伟胡明王亮
李柯 马远征 李大伟 胡明 王亮
1.山西医科大学,山西 太原 0300012.解放军第三○九医院骨科中心,北京 100091
脊柱结核是最常见的肺外结核,约占骨关节结核的50%[1],近年来随着卡介苗的预防接种、抗结核药物的广泛应用及人民身体素质的提高,老年性脊柱结核发病比例明显升高, 并且常伴发骨质疏松。结核分枝杆菌感染影响骨代谢过程,可能是骨密度下降的独立危险因素[2]。而脊柱结核并发骨质疏松症患者手术治疗需考虑手术内植物失效的安全性问题,目前临床上多不重视骨质疏松的治疗。为探寻骨质疏松因素对于脊柱结核手术治疗的影响,本研究对脊柱结核并发骨质疏松症患者进行抗骨质疏松干预,评价抗骨质疏松治疗对脊柱结核并发骨质疏松症患者的临床疗效。
1 材料和方法
1.1 研究对象
选取2012年1月至2015年2月解放军309医院骨科中心收治的脊柱结核并发骨质疏松症患者,共102例,其中男56例,女46例;年龄41~75岁,平均(57.2±13.1)岁。所有受试者均签署知情同意书,本研究方案获得解放军309医院医学伦理委员会批准。
将102例脊柱结核并发骨质疏松征患者运用分层随机分组法分为两组:观察组51例;对照组51例,使各组性别构成相同,年龄构成相仿,减少因性别及年龄差异导致骨质疏松程度差异造成实验结果的偏倚,观察组接受钙剂、维生素D、双膦酸盐药物抗骨质疏松治疗,对照组未使用抗骨质疏松药物治疗,两组均根据用药史、区域药物使用经验,药敏试验结果制定抗结核药物治疗方案,术前抗结核2~4周,平均3周,监测肝肾功能、动态血红细胞沉降率(ESR)、C-反应蛋白。加强营养支持治疗,贫血或低蛋白血症者通过输血、白蛋白及血浆等予以矫正。A组平均年龄(55.9±12.5)岁,B组平均年龄(58.5±13.9)岁。A组发病时间2~12个月,平均(6.1±4.9)月,B组发病时间2~11个月,平均(5.9±5.0)月。两组患者年龄、性别及术前骨密度、Cobb角、疼痛视觉评分(VAS)、血清碱性磷酸酶(ALP)、I型胶原交联C-末端肽(CTX)、骨钙素(OC)等差异均无统计学意义(见表1)。
纳入标准:①经快速结核分枝杆菌培养、菌种鉴定、病理检查证实为结核分枝杆菌感染;②应用双能X 线骨密度仪行髋部检查, 骨密度少于或等于标准骨密度(BMD)2.5 个标准差;③血钙、磷、ALP正常;④X线片、CT及MRI检查符合脊柱结核并发骨骨质疏松表现。⑤具有手术指征[3]者。
排除标准:①甲旁亢、多发性骨髓瘤、长期应用糖皮质激素等所致继发性骨质疏松症;②依从性差,不规律服用药物的患者;③拒绝参加本研究者。
所有患者均有不同程度的疼痛症状,部分有盗汗、午后低热等结核中毒症状。病灶情况:A组颈椎6例,胸椎15例,胸腰段8例,腰椎15例,腰骶段7例。B组颈椎5例,胸椎15例,胸腰段7例,腰椎18例,腰骶段6例。局部后凸畸形采用测量Cobb角方法。
1.2 骨密度测量
所有研究对象采用双能X线骨密度测量仪(DXA,美国Norland公司,XR-46型)测定髋部(包括股骨颈、股骨大转子、Ward三角区)的骨密度(BMD,g/cm2)。该方法测定人体骨密度的精密度变异系数为1%。由于大部分入组病例病灶位于腰椎,并伴有骨质破坏,腰椎(L2-L4)骨密度值易受到病灶影响,故腰椎(L2-L4)骨密度不纳入本研究。本研究所有患者符合骨质疏松诊断标准[4]。
1.3 药物治疗及围手术期准备
所有患者入院后均严格卧床。治疗前,所有入组患者检测骨密度、血生化以及骨标志物检测。A组抗骨质疏松药物治疗方案为:唑来膦酸,5 mg药物溶于100 mL水溶液以输液管恒定速度滴注,滴注时间不得少于15 min。同时服用维生素D3(上海罗氏,每粒0.25 μg),每次1粒,每日1次;钙尔奇D片(惠氏制药,600 mg/片),每次1片,每日1次。抗结核药物治疗方案,根据用药史、区域药物使用经验,药敏试验结果制定抗结核药物治疗方案,术前抗结核2~4周,平均3周,监测肝肾功、动态红细胞沉降率(ESR)、C-反应蛋白。加强营养支持治疗,贫血或低蛋白血症者通过输血、白蛋白及血浆等予以矫正。待结核中毒症状减轻、ESR动态下降,行手术治疗。基于病灶特点对两组患者采用个体化手术方案[5],两组植骨材料选用自体骨块、钛笼自体骨粒或同种异体骨块,内固定为前路钉板和后路椎弓根钉棒。
1.4 术后处理
术后抗生素预防感染,卧床1周,1周后支具保护下离床活动,有截瘫症状者视肌力恢复情况康复功能锻炼,佩戴支具3个月。根据药敏试验、耐药基因结果及症状缓解情况调整抗结核用药,督导下抗结核治疗12~18个月。继续服用钙剂、维生素D、唑来膦酸药物治疗3年。
1.5 随访及观察指标
术后1、3、6、9、12个月分别进行随访,以后每隔6个月随访1次,随访3年。观察骨密度、血生化以及骨标志物、疼痛症状、内固定、植骨融合、后凸角度(Cobb角)等。
1.6 统计学处理

2 结果
2.1 两组患者术前的一般情况
两组患者术前的一般情况见表1。

表1 两组患者术前的一般情况对比Table 1 Comparison of preoperative general conditions between the two groups
2.2 临床疗效
所有患者均随访3年,资料完整。观察组术后疼痛视觉评分(VAS)为(2.32±0.61)分,末次随访VAS为(1.13±0.43)分。观察组1例窦道形成,经换药、调整化疗方案后2月内愈合。钛网未发生倾倒,前路钢板螺钉未发生断裂、松动、脱出。后路椎弓根螺钉系统位置良好,无松动或拔出。对照组术后VAS为(2.47±0.54)分,末次随访VAS为(1.24±0.62)分,1例腰椎术后椎弓根螺钉断裂,2例腰椎、1例胸椎随访中发现有螺钉松动情况,1例胸腰段后路头端螺钉术后拔出,1例尾端螺钉术后拔出,均再次手术延长固定节段。两组患者末次随访Cobb角方面差异有统计学意义(t=-3.13,P<0.01),见表2。术后6~24个月,102例X线片或CT显示植骨融合或钛网植骨与椎体融合。



组别术后Cobb角(°)末次随访Cobb角(°)术后VAS(分)末次随访VAS(分)观察组10.93±6.3811.05±6.172.32±0.611.13±0.43对照组10.77±7.1214.08±8.242.47±0.541.24±0.62t值0.37-3.13-1.02-1.18P值0.71<0.010.310.24
2.3 末次随访骨标志物变化比较
末次随访,观察组血清碱性磷酸酶(ALP)、I型胶原交联C-末端肽(CTX)、骨钙素(OC)较对照组低,差异均有统计学意义(P<0.05)。见表3。
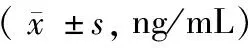


组别CTXALPOC观察组0.22±0.0816.06±8.056.42±1.03对照组0.52±0.1318.10±8.557.43±1.52t值-6.54-5.47-3.47P值<0.01<0.01<0.01
2.4 末次随访骨密度比较
末次随访,观察组股骨颈、Ward三角区及股骨大转子骨密度均较对照组骨密度高,差异有统计学意义(P<0.05),见表4。


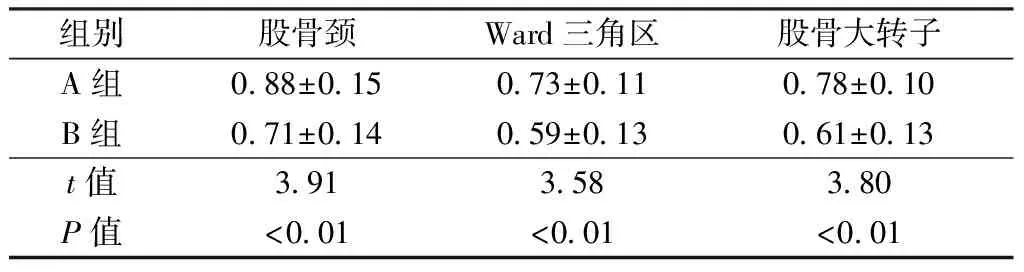
组别股骨颈Ward三角区股骨大转子A组0.88±0.150.73±0.110.78±0.10B组0.71±0.140.59±0.130.61±0.13t值3.913.583.80P值<0.01<0.01<0.01
3 讨论
当前,我国老龄人口逐年增多,骨质疏松伴脊柱结核的发病比例明显上升[2]。内固定的使用使得脊柱结核的手术治疗疗效明显提高。但骨质疏松以低骨量和骨组织微结构破坏为特征[3], 骨组织中的钙含量丢失、骨空隙增加、机械性能下降、骨脆性增加,使得内固定断裂、拔出、松动失效等风险提高。改善骨质疏松患者骨密度,可使椎弓根螺钉的稳定性增加[6]。骨质疏松的治疗主要包括骨健康基本补充剂及抗骨质疏松药物的治疗;骨健康基本补充剂即钙剂及维生素D,抗骨质疏松药物目前主要包括:钙剂、维生素D、骨吸收抑制剂(双膦酸盐、雌激素或降钙素等)和促进骨形成药物(特立帕肽)。双膦酸盐类药物能抑制破骨细胞活性,降低骨转换率、减少骨量丢失,提高骨密度,但可能会导致非典型骨折,因此需要考虑其合理用药问题。特立帕肽属于促骨形成药物,可明显降低骨折风险[7]。骨质疏松的治疗宜联合用药,联合应用药物起协同或加强作用,能够降低甚至逆转骨量丢失,增加骨密度[8-9]。
3.1 脊柱结核并发骨质疏松应用抗骨质疏松药物可提高骨密度、降低骨转换率
本研究采用唑来膦酸、钙剂、维生素D治疗骨质疏松,唑来膦酸1年滴注一次即可,可降低患者服药依从性问题。观察组及对照组治疗前骨密度的差异无统计学意义,治疗后观察组骨密度较对照组上升,且破骨标志物胶原降解产物CTX,成骨标志物骨碱性磷酸酶(ALP)及骨钙素(OC)均较对照组下降。表明唑来膦酸对成骨及破骨指标均有抑制作用,这与国外研究结果相符[10-12]。抗骨质疏松药物治疗疗程在目前是比较有争议的,其一,现有的国内外长期抗骨质疏松药物治疗临床数据有限,其二,抗骨质疏松药物长期用药存在“药物假期”可能,结合双膦酸盐药物治疗特点和临床事件经验,本研究采用的药物治疗疗程为3年。脊柱结核患者因结核分枝杆菌感染可导致骨量急剧下降,破骨细胞活性增强[2],这与Chen等[13]的研究结果相似,其通过多变量分析发现结核是骨质疏松症的独立危险因素。王立民等[14]研究表明脊柱结核患者不仅破骨细胞活性增强,并且因户外活动减少缺乏维生素D,因此建议补充维生素D及应用抑制破骨细胞活性的抗骨质疏松药物,减少骨量丢失。脊柱结核患者易并发骨质疏松症,应用抗骨质疏松药物能有效提高患者骨密度,降低骨转换率,为术后椎弓根螺钉的稳定性提供保障。
3.2 脊柱结核并发骨质疏松应用抗骨质疏松药物有利于术后内固定的稳定及患者脊柱生理曲度的保持
观察组术后Cobb角较对照组比较,差异无统计学意义,末次随访观察组与对照组Cobb角比较,差异有统计学意义;观察组无内固定断裂、拔出、松动失效,对照组1例椎弓根螺钉断裂,3例随访中发现有螺钉松动情况,2例拔出。术后两年102例患者均显示植骨融合或钛网植骨与椎体融合。基于自体骨移植和异体骨移植在矫形及骨融合方面表现差异无统计学意义[15],排除异体骨及自体骨差异的影响,表明抗骨质疏松治疗对于脊柱结核并发骨质疏松患者术后内固定的稳定方面取得了良好的疗效,并可减少术后Cobb角的丢失,有利于生理曲度的保持。虽然本研究数据未显示出应用抗骨质疏松药物可能会增加脊柱融合的成功率,但Buerba等[16]通过研究证实抗骨质疏松药物可以增加脊柱融合成功率。目前有学者[17]采用椎体强化联合椎弓根螺钉治疗伴发严重骨质疏松症的无菌性脊柱病变,而椎体强化术应用在结核治疗上则存在争议,部分学者[18]认为椎体强化术可用来治疗早期非典型结核,而对于应用椎体强化术治疗典型脊柱结核并发骨质疏松症患者则未见报道。结核治愈的关键是有效的抗结核药物治疗、病灶清除与脊柱稳定性的重建[19]。脊柱结核并发骨质疏松患者,其骨密度明显减低,骨小梁组织紊乱,内固定装置置入椎体后,不能提供足够的把持力,因此易出现内固定不稳定的相关术后并发症,不利于脊柱结核的治愈。应用抗骨质疏松药物不但对抗结核药物疗效无明显影响[20],而且能够加强患者内固定稳定性,有利于脊柱融合及结核的治愈。
脊柱结核并发骨质疏松症,属于非废用性骨质疏松,骨量急剧下降,破骨细胞活性增强,对这类患者除了外科手术外,必须重视抗骨质疏松症的治疗,给予抑制破骨细胞活性药物较为理想,否则容易出现内固定松动或甚至失败等并发症。而且应用抗骨质疏松药物治疗可能对手术后脊柱融合有促进作用[21-22],改善脊柱结核并发骨质疏松症患者预后。目前骨科医生多不重视骨质疏松症的诊断及治疗,认为骨质疏松症属于内科疾病。但从我们的研究可以看出,骨质疏松症对脊柱结核患者的预后有重大影响。因此必须重视骨质疏松症的治疗。
本研究仅针对脊柱结核并发骨质疏松患者预后及其骨代谢指标等进行研究分析,未对除脊柱结核外其他需要内固定器械骨科疾病并发骨质疏松患者进行研究分析,后续需补充研究分析。
