中低强度跑台运动结合低频振动干预对阿霉素诱发的心脏毒性作用和骨质疏松的影响研究
2019-03-19傅文生张庭然
傅文生 张庭然
1.重庆商务职业学院,重庆 4013312.西南大学体育学院国家体育总局体质评价与运功机能监控重点实验室,重庆 400715
癌症发病率的持续上升已经成为严重的社会问题,有流行病学研究报告指出每年新增罹患的癌症人数约为1 400万,由于社会、自然等环境的影响新增发病人数还在持续上升,2035 年预计会达到每年新增2 000万患者[1]。但因为科技的进步和医疗技术的提升以及人们对癌症的认知的深入,癌症的5年存活率大幅提升,癌症患者的生存期也有所延长,癌症生还者的人口数也持续增加中。虽然死于癌症的病患减少,但癌症治疗后所引起的并发症却是癌症生还者必须面对的现实困难,如何帮助癌症生还者提升体适能对抗并发症,回归正常的工作和生活,已经成为癌症后续治疗的热点议题。阿霉素(doxorubicin,Dox)是一种蒽环类抗生素可以用来治疗多种癌症,但其副作用是会引起不可逆转的致命性心毒素和严重的骨质疏松。阿霉素的心脏毒性可能会导致心脏衰竭而其对成骨细胞的抑制作用使得骨髓质和骨皮质厚度下降[2],但是因为阿霉素的治癌疗效显著,副作用相比癌症的威胁可以被接受,因此阿霉素仍是治疗癌症常用药。阿霉素导致心肌内活性氧化物(reactive oxygen species,ROS)的增加被认为是其引起心脏功能不良的最主要原因,若增加心脏的抗氧化能力有可能能够降低阿霉素对心脏所造成的伤害[3]。大量研究证实运动预适应能减缓心肌梗塞发生时造成心肌缺血再灌注的伤害,而活性氧化物是造成缺血再灌注伤害的主要原因,这与阿霉素所引起心脏功能不良的机制是相同的,因此生理学家也利用运动来对抗阿霉素所引起心脏毒性[4]。Sturgeon等发现小鼠进行跑台训练有助于阿霉素对癌细胞生长的抑制作用,但无法减缓阿霉素引起的心脏毒性。而Parry等[5]的研究认为自主运动预适应可以减缓阿霉素引起的心脏毒性,且不会降低阿霉素的抗癌功效。但是目前此类研究较少,且研究结果不一致,运动对阿霉素引起的心脏毒性的影响效果尚不能确认。阿霉素的另一大副作用,即诱发严重骨质疏松。也被认为通过运动干预能够得到有效改善[5]。苏红燕等[6]研究发现对小鼠进行高强度跑台运动可以有效降低阿霉素诱导的骨密度下降和骨代谢失平衡,降低小鼠骨质疏松的程度。综上所述,进行运动干预能够对对阿霉素导致的心脏毒性和骨质疏松起到缓解作用。但是先前苏红燕等的研究中,采用的运动强度为高强度,虽然能够改善骨质疏松,但使用阿霉素进行治疗的患者多为身体虚弱的癌症患者,是难以完成如此高强度运动,该方案实践有较大困难。本研究中将以低强度跑台运动结合低频振动为运动干预方案,对使用阿霉素的小鼠进行运动干预,旨在探讨运动干预对于阿霉素引发的机体性毒性和骨质疏松的影响效果,为具有癌症患者体适能的恢复制定具有可操作性的运动处方提供理论参考。
1 材料和方法
1.1 实验动物及分组
1.1.1实验动物:本研究采用50只SPF 级,雄性昆明种小鼠,体重20.0~25.0 g,由河南省实验动物中心提供,动物许可证号为SCXK(豫) 2005-0001。8 周龄雌性SD小鼠 64 只。动物购入后,在(22±3)℃,相对湿度45%~60%的动物房环境下进行分笼饲养,每日提供足够食物,自由饮水,明暗期12 h/12 h。饲养员对小鼠饮食量、饮水量、排泄物、背毛进行日常观察。
1.1.2实验分组:动物购回适应本实验室环境和饮食1周后,被随机分为5组,每组10只:安静对照组(control group,C组,n=10)、阿霉素对照组(Dox group,D组,n=10)、跑台运动+阿霉素组(run+Dox group,RD组,n=10)、振动训练+阿霉素组(vibration+Dox group,VD组,n=10)、跑台+振动+阿霉素组(run+ vibration+Dox group,RVD组,n=10)。
1.1.3干预方案:运动干预方案:RD组、VD组、RVD组中都采用了运动方案,在适应性饲养后1周后进行运动干预,共为期8周,每周训练次数为5次,其中跑台运动采用速度为12 m/min,振动干预中振幅为2 mm、振频为30 Hz,跑台运动利用江苏赛昂斯公司生产的SA101小动物跑台执行,振动干预利用美国Power plate PRO5振动训练台执行。药物干预方案:参考苏红燕等的Dox给药方案[6],D组、RD组、VD组、RVD组在进行运动干预的第15天开始,每天腹腔注射方式对小鼠进行给药。剂量为1.5 mg/kg 体重的2 mg/mL 的盐酸阿霉素,连续该药10 d,C组小鼠在同一周期内每日注射等量的生理盐水。
1.2 实验方法
1.2.1实验设计与流程:①将所有小鼠进行1周的适应性喂养,并在这一周内对小鼠骨密度和骨质代谢进行前测;②对小鼠进行分组,RD组、VD组、RVD组开始执行运动方案,C组和D组小鼠在笼内正常喂养活动;③在D组、RD组、VD组、RVD组进行运动干预的第15天开始,每天腹腔注射方式对小鼠进行Dox给药,连续10 d。C组小鼠在同一周期内每日注射等量的生理盐水;④8周训练结束后进行后测(包括骨密度、骨质代谢、心脏超声波图像、心脏功能)。
1.2.2样本采集:(1)血样采集:所有小鼠保持禁食12 h,后抽取腹部主动脉血3 mL,在常温下静置 30 min后,利用低温离心机以4 000 r/min 离心10 min,提取血清,置于-20 ℃冰箱进行保存。(2)股骨样本采集:小鼠处死条件及方法同前期研究,处死后剥离小鼠双侧股骨,去除股骨上的肌肉和结缔组织后,分别称双侧股骨鲜重,分别用浸透生理盐水的纱布包裹每侧股骨,做好标记,-20 ℃保持待检。
1.2.3心脏超声波检测:将小鼠放置于一个含有2%动物用吸入式麻醉气体异氟烷(深圳瑞沃德生命科技有限公司生产)的密封置物盒内进行麻醉。麻醉完成后,将小鼠置于心肺功能测试和心电图(ECG)的检测平台上。利用固定装置将小鼠四肢进行完全固定,利用去毛膏(美国产Church & Dwight生物科技公司生产)将前胸和左侧胸外侧区域进行清除,并在该处涂抹超声波传导胶(Home Care Technology Co., Ltd, Tainan, Taiwan)以便减少探头与皮肤接触面间空隙,并加强探头表面与体内超声波的相互传送。本研究探头的频率与速率 (frame rate) 分别是 40 MHz和 30 Hz。小鼠的体内心脏功能测量使用小型动物专用的超声波系统(S-Sharp Corporation, Taipei, Taiwan)。首先检测小鼠心脏长轴(long-axis)以取得左心室 M-mode 影像(用来判左心室心壁厚度和左心室心腔的宽度)。接着将探头放在心尖(apical)利用脉冲多普勒(pulsed-wave doppler)影像侦测心脏四腔(four-chamber views)来分析小鼠的二尖瓣(mitral valve)和主动脉瓣(aortic valve)血流速度。检测主要指标包括:心室后壁收缩厚度(posterior wall systole,PWs)、心室后壁舒张厚度(posterior wall diastole,PWd)、心室中膈壁收缩厚度(interventricular septum systole,IVSs)、心室中膈壁舒张厚度(interventricular septum diastole,IVSs)、心室内径收缩(interior dimention systole,IDs)、心室内径舒张(interior dimention diastole,IDs)、心脏收缩时心室壁相对厚度(relative wall thickness systole,RWTs)、心脏舒张时心室壁相对厚度(relative wall thickness diastole,RWTs)、二尖瓣血流速度(mitral valve,MV)、主动脉瓣血流速度(aortic valve blood flow velocity,AV)、心肌缩短率(fractional shortening,FS)、射血分数(ejection fraction,EF)、心率(heart rate,HR)、心搏量(stroke volume,SV)、心输出量(cardiac output,CO)、等容舒张时间(isovolumic relaxation time,IVRT)、等容收缩时间(isovolumic contraction time,IVCT)、心肌性能指数(myocardial performance Index,MPI)。
1.2.4股骨骨密度检测:股骨骨密度测定从-80 ℃冰箱中取出各组小鼠左侧股骨,室温放置,待其自然解冻后,检测使用美国产Faxitron ultrafocus100双能X线骨密度仪测小型动物模式测量各组股骨远端骨密度。
1.2.5骨质代谢指标检测:本研究利用邻-甲酚酞络合酮终点比色法对血钙浓度(Ca2+)进行测定,试剂盒由上海恒远公司提供,利用日本厂日立-7100全自动生化分析仪;采用酶免法和上海信帆生物科技有限公司提供的试剂盒测定血清碱性磷酸酶(ALP)、骨钙素(BGP)、抗酒石酸酸性磷酸酶5b(TRACP5b),用美国 MUL2TISCAN MK3 酶标仪进行检测。
1.3 统计学处理
2 结果
2.1 分组及干预方案(表1)

表1 分组干预方案Table 1 Grouping intervention plan
2.2 心脏超声波影响测试结果(表2)

表2 各组心脏超声波测试结果(mm)Table 2 Results of heart ultrasound test(mm)
注:与C组比较,1P<0.05;与D组比较,2P<0.05;与RD组比较,3P<0.05;与VD组比较,4P<0.05。
表2显示:①心室后壁收缩(PWs)指标,D组心室厚度显著低于C组(P<0.05),RD组、VD组厚度显著高于D组(P<0.05),且显著低于C组(P<0.05);RVD组心室厚度显著高于D组(P<0.05),其厚度虽低于C组,高于RD组和VD组,但差异均不具有统计学意义(P>0.05)。②心脏后壁舒张(PWd)指标,D组心室厚度显著低于C组(P<0.05),RVD组心室厚度显著高于D组(P<0.05),其厚度虽低于C组,高于RD组和D组,但差异均不具有统计学意义(P>0.05)。③心室间隔收缩(IVSs)指标,D组心室厚度显著低于C组(P<0.05),RD组、VD组厚度显著高于D组(P<0.05),且显著低于C组后壁舒张(P<0.05);RVD组心室厚度显著高于D组和VD组(P<0.05),其厚度虽低于C组,高于RD组组,但差异均不具有统计学意义(P>0.05)。④心室中膈壁舒张厚度(IVSs),心室内径收缩(IDs),心室内径舒张(IDs),心脏收缩时心室壁相对厚度(RWTs),心脏舒张时心室壁相对厚度(RWTs)等指标方面,各组差异不具有统计学意义(P>0.05)。该结果表明阿霉素会导致小鼠左心室心壁变薄,而跑台干预和振动干预会一定程度抑制阿霉素导致的小鼠左心室心壁厚度变薄,而跑台结合振动干预能够显著抑制阿霉素导致的小鼠左心室心壁厚度变薄,且与控制组没有显著性差异。
2.3 心脏血流检测结果(表3)
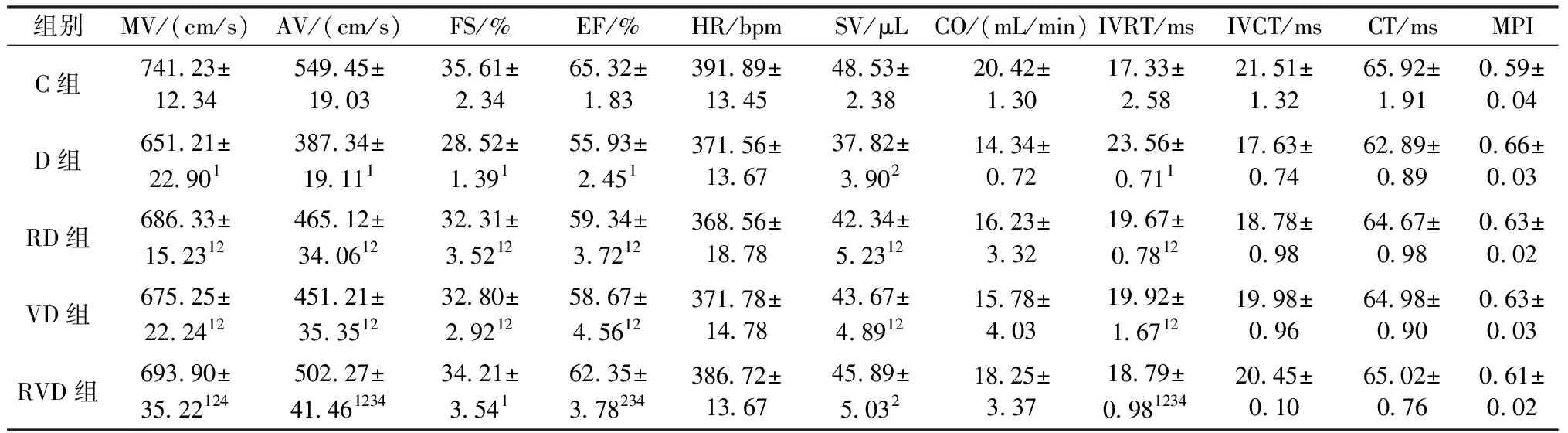
表3 各组心脏血流检测结果Table 3 Results of cardiac blood flow test
注:与C组比较,1P<0.05;与D组比较,2P<0.05;与RD组比较,3P<0.05;与VD组比较,4P<0.05。
表3显示:①二尖瓣血流速度(MV)指标,D组二尖瓣血流速度显著小于C组(P<0.05),RD组、VD组二尖瓣血流速度显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组二尖瓣血流速度显著大于D组和VD组(P<0.05),显著小于C组(P<0.05)。②主动脉瓣血流速度(AV)指标,D组主动脉瓣血流速度显著小于C组(P<0.05),RD组、VD组主动脉瓣血流速度显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组主动脉瓣血流速度显著大于D组、RD组和VD组(P<0.05),显著小于C组(P<0.05)。③心肌缩短率(FS)指标,D组心肌缩短率显著小于C组(P<0.05),RD组、VD组心肌缩短率显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组心肌缩短率显著大于D组,与C组、RD组、VD组不具有显著性差异(P>0.05)。④射血分数(EF)指标,D组射血分数显著小于C组(P<0.05),RD组、VD组射血分数显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组射血分数显著大于D组、RD组和VD组(P<0.05),与C组不具有显著性差异(P>0.05)。⑤心搏量(SV)指标,D组心搏量显著小于C组(P<0.05),RD组、VD组心搏量显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组心搏量显著大于D组(P<0.05)。⑥等容舒张时间(IVRT),D组等容舒张时间显著小于C组(P<0.05),RD组、VD组等容舒张时间显著大于D组(P<0.05),且显著小于C组(P<0.05);RVD组等容舒张时间显著大于D组、RD组和VD组(P<0.05),显著小于C组(P<0.05)。⑦心率(HR)、心输出量(cardiac output,CO)、等容收缩时间(IVCT);心肌性能指数(MPI)指标,C组、D组、RD组、VD组、RVD组组间差异不具有统计学意义(P>0.05)。本研究结果表明阿霉素会造成心脏功能减退,跑台干预和振动干预会一定程度缓解阿霉素诱发的心脏毒性作用。跑台结合振动干预会一定程度缓解阿霉素诱发的心脏毒性作用。
2.4 骨密度、骨质代谢测试结果(表4)
表4显示:①骨密度指标,各组前测差异不具有统计学意义(P>0.05)。D组、RD组、VD组后测结果显著低于前测(P<0.05)。C组、RVD组后测与前测差异不具有统计学意义(P>0.05)。D组后测结果显著低于C组(P<0.05),RD组、VD组后测结果显著高于D组(P<0.05),且显著低于C组(P<0.05);RVD组后测结果显著大于D组。②Ca2+指标,各组前测差异不具有统计学意义(P>0.05)。D组、RD组、VD组、RVD组后测结果显著高于前测(P<0.05)。C组后测与前测差异不具有统计学意义(P>0.05)。D组后测结果显著低于C组(P<0.05),RD组、VD组后测结果显著低于D组(P<0.05),且显著高于C组(P<0.05);RVD组后测结果显著低于D组、RD组、VD组(P<0.05)、显著高于C组(P<0.05)。③ALP指标,各组前测差异不具有统计学意义(P>0.05)。D组、RD组、VD组、RVD组后测结果显著高于前测(P<0.05)。C组后测与前测差异不具有统计学意义(P>0.05)。D组后测结果显著低于C组(P<0.05),RD组、VD组后测结果显著低于D组(P<0.05),且显著高于C组(P<0.05);RVD组后测结果显著低于D组(P<0.05)、显著高于C组(P<0.05)。④BGP指标,各组前测差异不具有统计学意义(P>0.05)。D组、RD组、VD组后测结果显著高于前测(P<0.05)。C组、RVD组后测与前测差异不具有统计学意义(P>0.05)。D组后测结果显著低于C组(P<0.05),RD组、VD组后测结果显著低于D组(P<0.05),且显著高于C组(P<0.05);RVD组后测结果显著低于D组(P<0.05)。⑤TRACP5b指标,各组前测差异不具有统计学意义(P>0.05)。D组、RD组、VD组后测结果显著低于前测(P<0.05)。C组、RVD组后测与前测差异不具有统计学意义(P>0.05)。D组后测结果显著低于C组(P<0.05),RD组、VD组后测结果显著高于D组(P<0.05),且显著低于C组(P<0.05);RVD组后测结果显著低于D组、RD组、VD组(P<0.05)。

表4 各组骨密度和骨质代谢检测结果Table 4 Results of bone mineral density and bone metabolism tests
注:与前测比较,*P<0.05;与C组比较,1P<0.05;与D组比较,2P<0.05;与RD组比较,3P<0.05;与VD组比较,4P<0.05。
3 讨论
3.1 运动干预对阿霉素诱发的心脏毒性作用的影响
目前癌症和治疗癌症产生的副作用严重影响癌症患者的生活质量和生命安全。许多学者开始尝试利用运动干预来降低癌症产生的毒副作用进而提高长期接受药物治疗者的生活质量,并被证明有较好的效果[7]。利用运动干预减轻阿霉素心脏毒性的研究也成为近年研究热点之一,大量研究结果表明运动能够显著缓解阿霉素导致的心脏功能不良。Xing等[8]研究将小鼠分成不运动、运动、不运动+阿霉素及运动+阿霉素4组,在注射肿瘤细胞后进行2周的低强度运动训练,结果发现运动干预能够提升阿霉素抗癌的功效,阿霉素会诱发心功能减退,运动能够缓解阿霉素所引起的心功能衰退。Xing等[8]的研究结果还显示运动干预无法缓解阿霉素导致的心脏功能衰退。Parry等[5]研究显示阿霉素可以有效的抑制肿瘤的成长,但并未发现运动可以增加阿霉素的抗癌功效,但运动可以降低阿霉素的心脏毒性,减缓阿霉素对心脏的伤害。各研究结果不一致的原因可能是运动形式、强度存在差异,以及运动干预的时间点不一致。本研究结果表明阿霉素会导致小鼠左心室心壁变薄,而跑台干预和振动干预会一定程度抑制阿霉素导致的小鼠左心室心壁厚度变薄,而跑台结合振动干预能够显著抑制阿霉素导致的小鼠左心室心壁厚度变薄,且与控制组差异没有统计学意义。Nishida等[9]发现接受阿霉素注射小鼠的左心室收缩及舒张功能 (心搏量及等量舒张时间) 似乎比注射癌细胞+阿霉素 (有无运动) 组的心脏功能差,当观察左心室心壁厚度时,同样发现只注射阿霉素小鼠的左心室壁变薄。本研究显示阿霉素会导致小鼠左心室心壁变薄和心脏血流量减少,而跑台干预和振动干预会一定程度抑制阿霉素导致的小鼠左心室心壁厚度变薄和心脏血流量减少,而跑台结合振动干预能够显著抑制阿霉素导致的小鼠左心室心壁厚度变薄和心脏血流量减少;当下关于阿霉素产生心脏毒性的作用机制尚不十分明确,但目前有阿霉素引起氧自由基过量导致的氧化损伤、Fe2+代谢紊乱、Ca2+超量代谢、TOPⅡβ介导的蒽环类心脏毒性分子机制被提出等。其中阿霉素诱发氧自由基过量心肌氧化伤害得到较多的认同[10]。阿霉素诱发的心脏毒性具有进展性和不可逆性特征,会导致患者出现心肌疾病、心力衰竭,严重者甚至死亡。目前有部分药物能够缓解阿霉素导致的心脏毒性,但是由于阿霉素等蒽环类药物基本作为二线抗肿瘤药物用于临床,针对患者多为已经经历一线药物使用,且有一定病程,身体状态较差,过多用药可能会增加身体负担,一些患者还会出现肾毒性和耳毒性表现。大多数研究认为,进行规律运动能够增加生物体抗氧化伤害能力,其中对心肌缺血再灌注造成的氧化伤害的预防效应尤其明显。结合阿霉素心脏毒性的产生机制,进行分析发现运动能够显著缓解阿霉素导致的心脏形态及机能变化。以往研究认为,需要在中强度(70%最大摄氧量强度)跑步运动能够达到抗氧化作用,但是对于癌症患者,70%最大摄氧量强度跑步运动强度太高,本研究尝试将低强度(50%~60%最大摄氧量强度)跑步运动结合低强度振动训练结合作为运动处方进行使用,结果发现单纯进行低强度跑台训练或者低强度振动训练虽然对心脏起到一定保护作用,但还是产生明显的心脏形态和功能的变化,而低强度跑步运动结合低强度振动训练能够明显防止阿霉素心脏毒性导致的心室变薄以及心脏血流减小等问题出现,并且与先前学者研究中强度训练跑台干预的所达到的效果基本一致。综上所述,低强度跑步运动结合低强度振动训练对于利用阿霉素进行治疗的癌症患者具有较高的可操作性,且其能够对阿霉素心脏毒性作用具有较好预防效果。
3.2 运动干预对阿霉素诱发骨质疏松的影响
阿霉素虽然抗肿瘤方面具有较好的疗效,但是阿霉素除具有心脏毒性外,其能显著降低骨矿含量和骨密度也被众多研究所证实[11]。本研究显示,D组与前测以及对照组相比与其骨密度显著下降,而血清碱性磷酸酶、骨钙素、抗酒石酸酸性磷酸酶 5b等骨代谢标志物显著上升,出现显著性差异,这说明阿霉素确实可以导致骨密度下降和骨吸收作用增加。Orcy等[12]认为阿霉素诱发骨质疏松的发病的机制是阿霉素的使用导致成骨细胞数量减少和活性降低,而破骨细胞数量和活性大幅增加,最终成骨细胞的骨生成作用减弱与破骨细胞的骨吸收作用增强。苏红燕等[6]认为,阿霉素作用线粒体导致其过度氧化, 进而造成细胞的损伤,阿霉素与成骨细胞线粒体相互作用导致氧自由基对成骨细胞损伤,进而使成骨作用下降,RD组VD组与前测和对照组相比其骨密度显著下降,而血清碱性磷酸酶、骨钙素、抗酒石酸酸性磷酸酶5b等骨代谢标志物显著上升,但骨密度显著高于D组、骨吸收标志物显著低于D组,这表明单纯进行低强度跑台运动或者低强度振动训练,能够一定程度阻止破骨细胞骨吸收作用和骨密度的下降,但是因为运动强度或者运动量的限制导致该作用收到限制。Moreira等[13]认为利用运动改善骨健康的方案中,运动强度、运动时间是对骨密度和骨代谢影响的重要因素,一般低强度的运动对骨骼基本上产生作用较小,而过度的运动对于骨骼是有害的,中等强度运动较为适合。但本研究秉持制定对癌症患者提供具有现实可操作性的改善骨健康运动处方的理念,根据癌症患者身体状况,认为中高强度运动和过大运动量不适用于癌症患者,本研究将低强度跑台运动结合低频振动干预作为运动馆处方,RVD组骨密度与前测和对照组相比,没有显著性差异,虽然部分骨吸收标志物显著高于前测和对照组,但并未导致骨密度的显著变化。该结果可能与运动量和运动方式两因素有关,该组运动强度与D组和VD组基本一致,均属低强度运动,但RVD组运动时间较长,骨骼能够收到较多的冲击力,跑台运动已被多次证实能够改善骨代谢,降低骨吸收,跑台运动时肌肉产生的SSD收缩和蹬伸过程中地面给予的反作用力,均对下肢骨产生应力性刺激,能够帮助骨量的积累。振动干预作为功能性训练常用手段[14],Bezrati-Benayed、巴洪冰等[15-16]证明振动训练能够显著改善骨密度和骨质代谢,振动干预能产生与跑台运动相似的下肢应力刺激促进骨量积累。振动干预还能显著增加外周和循环系统血量、淋巴和静脉引流量,进而导致腿部骨和骨骼肌血流灌注量提升,从而促进骨密度提升[17],此外振动干预还会显著提升IGF-1和GH的血样浓度,IGF-1和GH已被证明其水平变化与骨密度变化具有显著关系[18]。综上所述,低强度跑步运动结合低强度振动训练能够对阿霉素诱发的骨质疏松具有较好预防和治疗作用。
4 结论
阿霉素的使用会导致小鼠左心室心壁变薄和心脏血流量减少,而跑台干预和振动干预会一定程度抑制阿霉素导致的小鼠左心室心壁厚度变薄和心脏血流量减少,而跑台结合振动干预能够显著抑制阿霉素导致的小鼠左心室心壁厚度变薄和心脏血流量减少。
阿霉素的使用会导致小鼠骨密度下降和骨吸收作用的增加,低强度跑步运动结合低强度振动训练对于利用阿霉素进行治疗的癌症患者具有较高的可操作性,且其能够对阿霉素诱发的骨质疏松具有较好预防和治疗作用。
