LncRNA SOX21-AS1靶向调控miR-202-5p影响结直肠癌细胞生物学行为的实验研究*
2019-03-17刘艳红陈文霞屈重行李琨琨姜媛媛吴慧丽
刘艳红 陈文霞 屈重行 李琨琨 姜媛媛 吴慧丽
郑州大学附属郑州中心医院消化内科(450007)
背景:长链非编码RNA(lncRNA)可通过调控miRNA的表达来参与肿瘤发生、发展过程,但lncRNA在结直肠癌发展和转移中的分子机制尚未阐明。目的:探讨lncRNA SOX21-AS1通过调控微小RNA-202-5p(miR-202-5p)的表达影响结直肠癌细胞生物学过程的分子机制。方法:以SOX21-AS1小分子干扰RNA(si-SOX21-AS1)、miR-202-5p模拟物及其抑制剂转染结直肠癌HCT116、SW480细胞,采用实时荧光定量聚合酶链反应(qRT-PCR)法检测结直肠癌细胞株SOX21-AS1、miR-202-5p mRNA表达,MTT法检测细胞增殖情况,流式细胞术检测细胞凋亡情况,Transwell实验检测细胞迁移和侵袭情况,双萤光素酶报告实验检测SOX21-AS1与miR-202-5p的靶向调控关系,蛋白质印迹法检测细胞周期蛋白1(cyclin D1)、MMP-2、cleaved caspase-3蛋白表达。结果:结直肠癌细胞中SOX21-AS1 mRNA表达显著高于人正常结肠黏膜上皮细胞(P<0.05),miR-202-5p mRNA表达显著降低(P<0.05)。沉默SOX21-AS1或上调miR-202-5p表达可显著抑制HCT116、SW480细胞增殖、迁移和侵袭,细胞凋亡率显著增加(P<0.05),并可抑制cyclin D1、MMP-2蛋白表达(P<0.05),促进cleaved caspase-3蛋白表达(P<0.05)。SOX21-AS1可靶向结合miR-202-5p,并可负向调控miR-202-5p的表达和活性;抑制miR-202-5p表达可逆转沉默SOX21-AS1对结直肠癌细胞增殖、凋亡、迁移和侵袭的影响。结论:沉默SOX21-AS1表达可通过上调miR-202-5p的表达从而抑制结直肠癌细胞增殖、迁移和侵袭,并可诱导细胞凋亡。
结直肠癌是一种发病率和死亡率均较高的恶性肿瘤,肿瘤生长、恶性进展是结直肠癌患者死亡的主要原因[1]。目前临床多采用手术、靶向治疗、免疫治疗等手段治疗结直肠癌,但患者的预后较差[2]。既往研究显示癌基因的激活或抑癌基因的失活等可增强肿瘤细胞侵袭能力从而促进结直肠癌的恶性转移[3]。目前结直肠癌的致病机制尚未完全阐明,需进一步探究结直肠癌发展、转移的分子机制。长链非编码RNA(long non-coding RNA, lncRNA)在不同疾病中的表达趋势不同,可参与细胞增殖、分化等生物学过程,有研究表明lncRNA SOX21-AS1可能促进结直肠癌的发生[4]。SOX21-AS1还可通过竞争性结合微小RNA-7(microRNA-7, miR-7)来促进宫颈癌的进展[5]。但SOX21-AS1在结直肠癌发展、转移过程中的分子机制尚未完全阐明。通过DIANA预测发现SOX21-AS1与miR-202-5p存在靶向序列。有研究表明miR-202-5p通过直接靶向SMARCC1在结直肠癌中发挥抑癌作用[6]。LncRNA NORAD通过抑制miR-202-5p表达来促进结直肠癌的进展[7]。本研究通过在不同结直肠癌细胞株中沉默SOX21-AS1表达或上调miR-202-5p表达,旨在验证SOX21-AS1对miR-202-5p表达的调控作用,从而探讨SOX21-AS1调控结直肠癌发生、转移的分子机制。
材料与方法
一、主要材料与试剂
人正常结肠黏膜上皮细胞NCM460购自上海联迈生物工程有限公司;人结直肠癌细胞株HCT116、SW480、SW620、LoVo、HT29购自中国科学院上海细胞库。DMEM培养基、胰蛋白酶、Lipofectamine 2000转染试剂盒均购自美国Thermo Fisher公司;SOX21-AS1小分子干扰RNA(si-SOX21-AS1)、无意义阴性序列(si-con)、miR-202-5p模拟物(mimics)、阴性对照(miR-con)、miR-202-5p特异性寡核苷酸抑制剂(anti-miR-202-5p)及其阴性对照(anti-miR-con)均购自广州锐博生物科技有限公司;Trizol、反转录试剂盒、SYBR Green试剂盒均购自宝生物工程(大连)有限公司;甲基噻唑基四唑(methylthiazolyl tetrazolium, MTT)购自北京鼎国昌盛生物技术有限责任公司;细胞凋亡检测试剂盒购自美国Sigma公司;Transwell小室、Matrigel基质胶均购自美国Corning公司;双萤光素酶报告基因检测试剂盒购自威格拉斯生物技术(北京)有限公司;蛋白裂解液、BCA蛋白定量试剂盒购自北京全式金生物技术有限公司;兔抗人细胞周期蛋白D1(cyclin D1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(cleaved caspase-3)、基质金属蛋白酶-2(matrix metallopro-teinases-2, MMP-2)单抗购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉艾美捷科技有限公司。
二、方法
1. 细胞转染和分组:所有细胞培养于DMEM培养基,置于37 ℃、5% CO2培养箱内培养,传代培养。收集对数生长期结直肠癌HCT116、SW480细胞,胰蛋白酶消化,制备细胞悬液接种于24孔板,待细胞生长融合至70%时进行转染,转染前更换为不含胎牛血清的DMEM培养基,随机分为NC组(未经任何处理的细胞)、si-con组(转染si-con的细胞)、si-SOX21-AS1组(转染si-SOX21-AS1的细胞)、miR-con组(转染miR-con的细胞)、miR-202-5p组(转染miR-202-5p mimics的细胞)、si-SOX21-AS1+anti-miR-con组(共转染si-SOX21-AS1与anti-miR-con的细胞)、si-SOX21-AS1+anti-miR-202-5p组(共转染si-SOX21-AS1与anti-miR-202-5p的细胞),各组细胞转染6 h后更换为含有10%胎牛血清和双抗的DMEM培养基,继续培养48 h,收集对数生长期细胞进行功能验证实验。
2. 实时荧光定量聚合酶链反应(qRT-PCR)检测SOX21-AS1、miR-202-5p mRNA表达:收集各组细胞,采用Trizol法提取细胞总RNA,参照反转录试剂盒合成cDNA。SOX21-AS1正向引物:5’-TTT GCT TTC GAG CTA TGA-3’,反向引物:5’-CTT AAT TGC CTG ATA CGC-3’;GAPDH正向引物:5’-GGA GCG AGA TCC CTC CAA AAT-3’,反向引物:5’-GGC TGT TGT CAT ACT TCT CAT GG-3’;miR-202-5p正向引物:5’-ACA CTC CAG CTG GGT TCC TAT GCA TAT A-3’,反向引物:5’-CTC AAC TGG TGT CGT GGA GT-3’;U6正向引物:5’-ATT GGA ACG ATA CAG AGA AGA TT-3’,反向引物:5’-GGA ACG CTT CAC GAT TTG-3’,引物均由生工生物工程(上海)股份有限公司设计并合成。以cDNA为模板进行qRT-PCR,参照试剂盒配置反应体系,反应条件:95 ℃ 2 min(循环1次);95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s(循环40次)。SOX21-AS1以GAPDH为内参,miR-202-5p则以U6为内参,采用2-ΔΔCt法计算SOX21-AS1、miR-202-5p mRNA相对表达量。
3. MTT法检测细胞增殖:收集各组对数生长期结直肠癌HCT116、SW480细胞,胰蛋白酶消化,制备单细胞悬液,调整细胞密度为3×104个/mL,按照每孔200 μL细胞悬液接种于96孔板,分别于转染24 h、48 h、72 h时向每孔中加入20 μL MTT溶液(5 mg/mL),室温孵育4 h,弃上清,每孔分别加入150 μL二甲基亚砜(DMSO),低速振荡10 min,上酶标仪检测波长490 nm处各孔吸光度值(A值)。
4. 流式细胞术检测细胞凋亡:分别取各组对数生长期结直肠癌HCT116、SW480细胞,0.25%胰蛋白酶消化,收集细胞,室温条件下1 000 r/min离心6 min(离心半径6 cm),弃上清,预冷PBS清洗,加入500 μL结合缓冲液,加入5 μL Annexin V-FITC,充分混匀,加入5 μL PI,室温避光孵育10 min,应用流式细胞仪检测细胞凋亡率。
5. Transwell实验检测细胞迁移:取对数生长期结直肠癌HCT116、SW480细胞,弃上清,0.25%胰蛋白酶消化,加入不含血清的DMEM培养基制备单细胞悬液,调整细胞密度为5×104个/mL,按照每孔200 μL将细胞悬液接种于24孔板Transwell小室的上室。取600 μL培养液(含有10%胎牛血清)加入Transwell小室的下室,放入37 ℃、5% CO2培养箱内培养24 h,PBS洗涤,多聚甲醛固定10 min,PBS洗涤,0.1%结晶紫染液染色10 min,擦拭未迁移细胞,显微镜下随机选取5个视野观察迁移细胞数。
6. Transwell实验检测细胞侵袭:以预冷培养液稀释Matrigel基质胶(稀释比例为9∶1),24孔板Transwell小室上室每孔加入40 μL Matrigel稀释液,置于37 ℃ 5% CO2培养箱孵育5 h。取对数生长期结直肠癌HCT116、SW480细胞,弃培养液,PBS洗涤,0.25%胰蛋白酶消化,加入不含胎牛血清的培养液制备单细胞悬液,调整细胞密度为5×104个/mL,按照每孔200 μL单细胞悬液Transwell小室的上室,37 ℃恒温培养箱内培养24 h,PBS洗涤3次×5 min,多聚甲醛溶液固定10 min,0.1%结晶紫染液染色10 min,擦去未侵袭细胞,显微镜下随机选取5个视野观察侵袭细胞数。
7. 双萤光素酶报告基因检测:将萤光素酶报告载体SOX21-AS1-WT、SOX21-AS1-MUT分别与miR-202-5p mimics、miR-con共转染结直肠癌HCT116、SW480细胞,转染24 h后收集细胞,根据萤光素酶活性检测试剂盒说明书检测细胞相对萤光素酶活性。分别将si-con、si-SOX21-AS1、pcDNA、pcDNA-SOX21-AS1转染各组结直肠癌HCT116、SW480细胞,采用qRT-PCR法检测细胞中miR-202-5p mRNA表达。
8. 蛋白质印迹法检测各组cyclin D1、MMP-2、cleaved caspase-3蛋白表达:收集各组结直肠癌HCT116、SW480细胞,加入蛋白裂解液提取细胞总蛋白,采用BCA法测定蛋白浓度,蛋白高温变性,取30 μg变性蛋白进行SDS-PAGE电泳。电泳结束后将分离的蛋白凝胶转移至PVDF膜,采用5%脱脂奶粉封闭2 h,室温条件下孵育一抗(稀释比例为1∶1 000),摇床孵育过夜,TBST洗涤3次×15 min,孵育二抗(稀释比例为1∶2 000),摇床孵育1 h,TBST洗涤3次×15 min,曝光,显影,凝胶成像分析系统,并应用Image J软件分析各条带灰度值。
三、统计学分析
结 果
一、SOX21-AS1和miR-202-5p在人结直肠癌细胞和人正常结肠黏膜上皮细胞中的表达
实验结果显示,与人正常结肠黏膜上皮细胞NCM460相比,结肠癌细胞HCT116、SW480、SW620、LoVo、HT29中SOX21-AS1表达显著升高,miR-202-5p表达显著降低(图1)。其中SOX21-AS1在结直肠癌HCT116、SW480细胞中的表达较其他细胞株明显升高,miR-202-5p在结直肠癌HCT116、SW480细胞中的表达相对较低,因而选用结直肠癌HCT116、SW480细胞为研究对象进行后续实验。
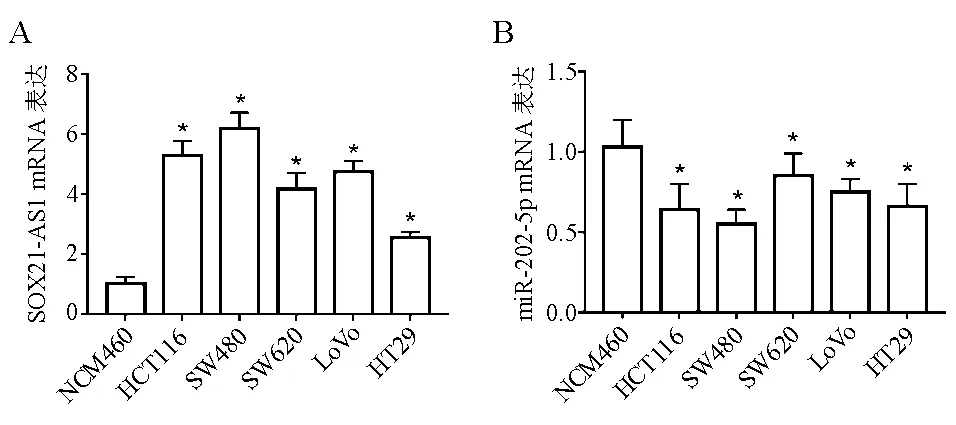
*与NCM460细胞比较,P<0.05
图1人结直肠癌细胞和人正常结肠黏膜上皮细胞中SOX21-AS1、miR-202-5p表达(qRT-PCR法)
二、沉默SOX21-AS1表达对人结直肠癌细胞增殖和细胞凋亡的影响
与si-con组相比,si-SOX21-AS1组结直肠癌HCT116、SW480细胞中SOX21-AS1 mRNA表达显著降低(P<0.05;图2A、2B),提示转染成功。与si-con组相比,si-SOX21-AS1组结直肠癌HCT116、SW480细胞活力显著降低(P<0.05;图2C、2D),细胞凋亡率显著升高(P<0.05;图2E-2H),cyclin D1蛋白表达显著降低(P<0.05),cleaved caspase-3蛋白表达显著升高(P<0.05;图2I-2K);而si-con组上述指标与NC组相比差异均无统计学意义(P>0.05;图2)。

*与si-con组比较,P<0.05
A-B:qRT-PCR法检测SOX21-AS1 mRNA表达;C-D:MTT法检测细胞活力;E-H:流式细胞术检测细胞凋亡;I-K:蛋白质印迹法检测cyclin D1和cleaved caspase-3蛋白表达
图2 沉默SOX21-AS1表达对人结直肠癌HCT116和SW480细胞增殖和凋亡的影响
三、沉默SOX21-AS1表达对人结直肠癌细胞迁移和侵袭的影响
与si-con组相比,si-SOX21-AS1组结直肠癌HCT116、SW480细胞迁移和侵袭能力均显著降低(P<0.05),MMP-2蛋白表达显著降低(P<0.05);而si-con组上述指标与NC组相比差异均无统计学意义(P>0.05;图3)。
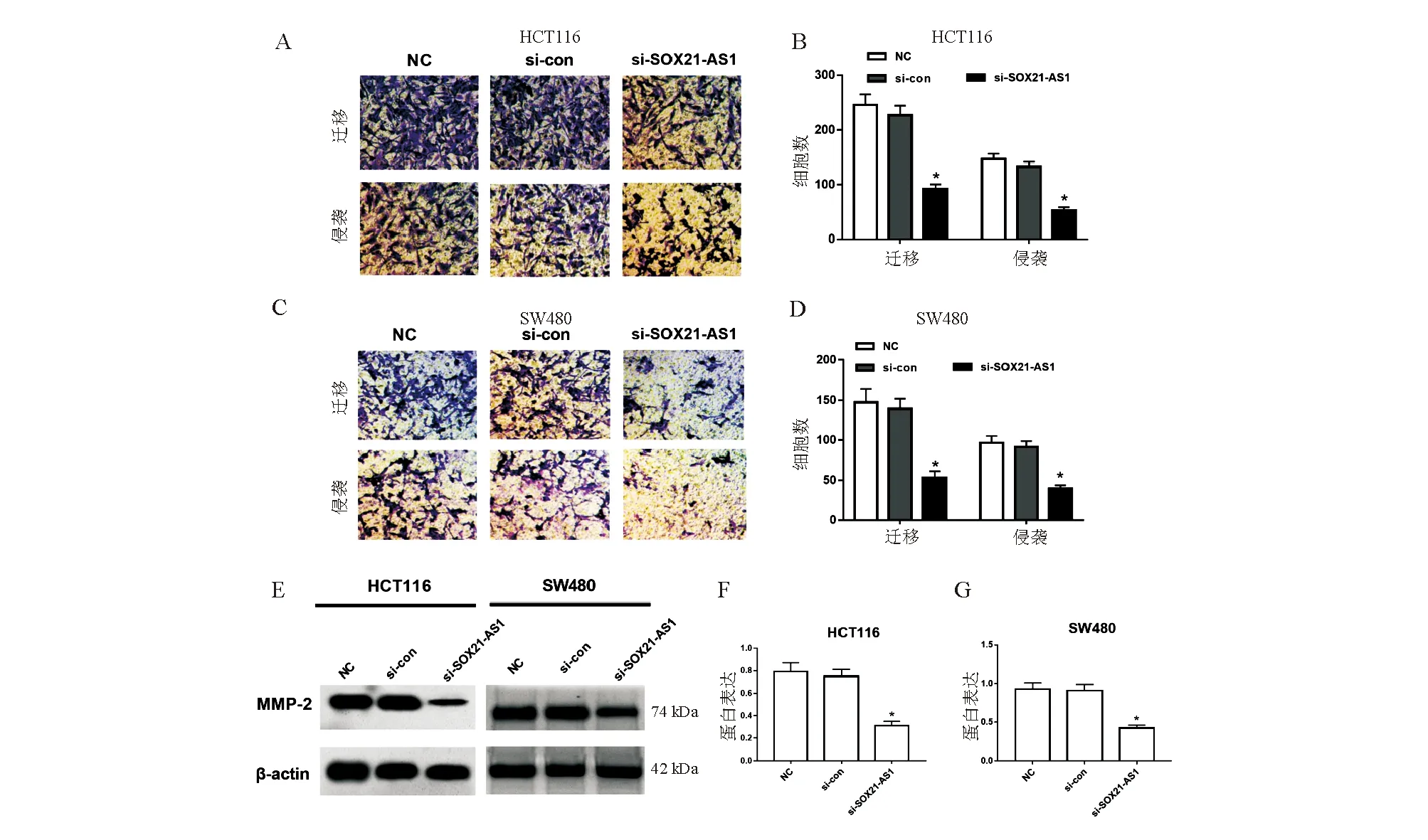
*与si-con组比较,P<0.05
图3 沉默SOX21-AS1表达对人结直肠癌HCT116和SW480细胞迁移和侵袭的影响
四、SOX21-AS1靶向调控miR-202-5p表达
通过DIANA预测到SOX21-AS1与miR-202-5p存在靶向序列(图4A)。双萤光素酶报告实验结果显示,转染克隆有SOX21-AS1-3’UTR突变型载体质粒实验中,miR-202-5p组与miR-con组萤光素酶活性相比无明显差异;转染克隆有SOX21-AS1-3’UTR野生型载体质粒实验中,miR-202-5p组萤光素酶活性显著低于miR-con组(P<0.05;图4B、4C)。qRT-PCR检测结果显示si-SOX21-AS1组结直肠癌HCT116、SW480细胞中miR-202-5p mRNA表达显著高于si-con组(P<0.05),pcDNA-SOX21-AS1组结直肠癌HCT116、SW480细胞中miR-202-5p表达显著低于pcDNA组(P<0.05;图4D、4E)。
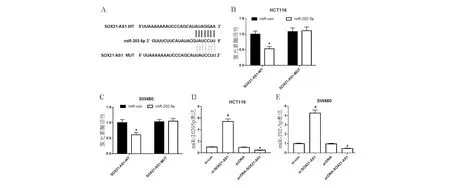
*与miR-con组比较,P<0.05;#与si-con组比较,P<0.05;▲与pcDNA组比较,P<0.05
A:SOX21-AS1与miR-202-5p存在靶向序列;B-C:萤光素酶报告实验结果;D-E:结直肠癌细胞HCT116和SW480中miR-202-5p表达
图4 SOX21-AS1靶向调控miR-202-5p的表达
五、MiR-202-5p模拟物对人结直肠癌细胞增殖、凋亡、迁移和侵袭的影响
实验结果显示,与miR-con组相比,miR-202-5p组结直肠癌HCT116、SW480细胞中miR-202-5p mRNA表达显著升高(P<0.05;图5A、5B),提示转染成功。与miR-con组相比,miR-202-5p组结直肠癌HCT116、SW480细胞活力显著降低(P<0.05),迁移、侵袭细胞数显著减少(P<0.05),细胞凋亡率显著增高(P<0.05),cyclin D1、MMP-2蛋白表达显著降低(P<0.05),cleaved caspase-3蛋白表达显著升高(P<0.05;图5C-5K)。

*与miR-con组比较,P<0.05
A-B:qRT-PCR法检测miR-202-5p mRNA表达;C-D:MTT法检测细胞活力;E-F:Transwell实验检测细胞迁移和侵袭;G-H:流式细胞术检测细胞凋亡;I-K:蛋白质印迹法检测cyclin D1、MMP-2和cleaved caspase-3蛋白表达
图5 MiR-202-5p模拟物对人结直肠癌细胞增殖、凋亡、迁移和侵袭的影响
六、MiR-202-5p抑制物部分逆转沉默SOX21-AS1对人结直肠癌细胞增殖、凋亡、迁移和侵袭的影响
与si-SOX21-AS1+anti-miR-con组相比,si-SOX21-AS1+anti-miR-202-5p组结直肠癌HCT116、SW480细胞中miR-202-5p mRNA表达显著降低(P<0.05),细胞活力显著增强(P<0.05),迁移和侵袭细胞数显著增加(P<0.05),细胞凋亡率显著降低(P<0.05),cyclin D1、MMP-2蛋白表达显著升高(P<0.05),cleaved caspase-3蛋白表达显著降低(P<0.05;图6)。
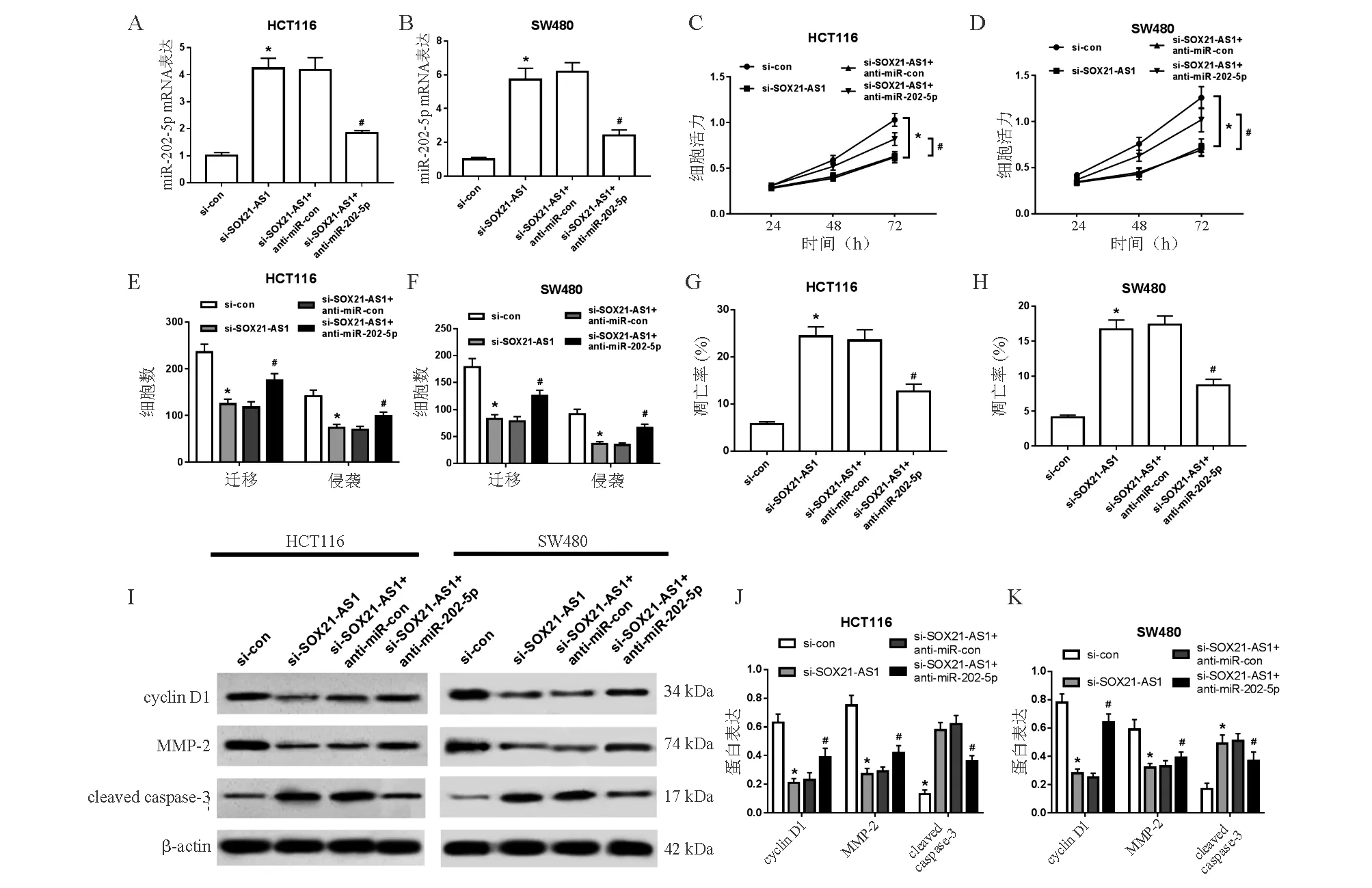
*与si-con组比较,P<0.05;#与si-SOX21-AS1+anti-miR-con组比较,P<0.05
A-B:qRT-PCR法检测miR-202-5p表达;C-D:MTT法检测细胞活力;E-F:Transwell实验检测细胞迁移和侵袭;G-H:流式细胞术检测细胞凋亡;I-K:蛋白质印迹法检测cyclin D1、MMP-2和cleaved caspase-3蛋白表达
图6 抑制miR-202-5p表达可逆转沉默SOX21-AS1对结直肠癌HCT116和SW480细胞增殖、凋亡、迁移和侵袭的影响
讨 论
LncRNA可通过与miRNA、lncRNA-蛋白相互作用等多种机制参与恶性肿瘤的发生、发展进程,既往研究显示部分lncRNA在结直肠癌组织中异常表达并可通过调控靶基因的表达来参与结直肠癌细胞增殖、凋亡等过程[8-10]。因此本研究积极探寻lncRNA在结直肠癌发生和转移过程中的分子机制,对提高临床治疗效果以及改善患者预后均具有重要意义。
有研究[11]显示SOX21-AS1在肾母细胞瘤中呈高表达并可促进细胞增殖。SOX21-AS1表达升高可预示肺腺癌、肝细胞癌患者的预后不良[12-13]。但SOX21-AS1在结直肠癌中的表达及其调控机制尚未完全阐明。本研究结果显示不同结直肠癌细胞株中SOX21-AS1表达均显著升高,表明SOX21-AS1在结直肠癌发生过程中可能发挥重要作用。进一步细胞实验结果证实,沉默SOX21-AS1表达可显著抑制结直肠癌细胞增殖、迁移和侵袭,并可促进细胞凋亡,提示沉默SOX21-AS1表达可降低结直肠癌细胞增殖、迁移和侵袭能力并诱导细胞凋亡,从而抑制癌症进展。有研究表明cyclin D1可正向调控细胞周期进程,促进细胞生长;细胞接收凋亡信号时可激活线粒体凋亡途径,激活细胞凋亡执行因子caspase-3形成cleaved caspase-3,从而促进细胞凋亡;细胞外基质降解可促进肿瘤细胞侵袭,其中MMP-2作为基质金属蛋白酶家族成员,可通过降解细胞外基质成分从而促进结直肠癌细胞浸润和转移[14-16]。本研究结果显示沉默SOX21-AS1表达可显著抑制结直肠癌细胞中cyclin D1、MMP-2表达,并促进cleaved caspase-3表达,提示沉默SOX21-AS1表达可能通过上调cleaved caspase-3和下调cyclin D1、MMP-2表达,从而影响结直肠癌细胞增殖、迁移、侵袭和凋亡过程。
MiR-202在肺癌细胞中呈低表达,可通过抑制下游靶基因GLI-2表达来调控细胞增殖和凋亡过程[17]。LncRNA NORAD可通过靶向miR-202-5p促进肝细胞癌进展[18]。研究表明miR-202-5p可通过靶向ROCK1抑制骨肉瘤细胞迁移和侵袭[19]。本研究结果显示不同结直肠癌细胞株中miR-202-5p表达显著降低,细胞实验证实上调miR-202-5p表达可抑制结直肠癌细胞增殖、迁移和侵袭,并促进细胞凋亡。同时双萤光素酶报告实验证实SOX21-AS1可靶向调控miR-202-5p表达,抑制miR-202-5p表达可部分逆转沉默SOX21-AS1对结直肠癌细胞增殖、凋亡、迁移和侵袭的作用,说明沉默SOX21-AS1可通过上调miR-202-5p表达来改善结直肠癌细胞的恶性生物学行为。提示SOX21-AS1有望作为结直肠癌诊断和治疗的潜在靶点。
综上所述,SOX21-AS1在结直肠癌细胞中呈高表达,沉默SOX21-AS1表达可通过上调miR-202-5p表达进而影响结直肠癌细胞增殖、迁移、侵袭和凋亡过程,SOX21-AS1可通过负向调控miR-202-5p的表达从而促进结肠癌发生、发展,可为结直肠癌的靶向治疗提供新方向。但结直肠癌的发生是一个多步骤、多因素的复杂过程,关于结直肠癌发生、转移过程中miR-202-5p对下游靶基因和其他相关信号通路的调控作用仍需行进一步探讨。
