儿童ABO血型不合肝移植术后抗体介导的排斥反应的诊治经验分析
2019-03-15王凯王政禄孙超高伟天津市第一中心医院器官移植科天津市器官移植重点实验室天津市器官移植临床医学研究中心天津300192
王凯,王政禄,孙超,高伟(天津市第一中心医院器官移植科,天津市器官移植重点实验室,天津市器官移植临床医学研究中心,天津 300192)
ABO血型不合肝移植虽然可明显缩短受者等待时间,但术后胆道并发症、排斥反应的发生率较高,尤其是抗体介导的排斥反应(antibody mediated rejection,AMR),因此在临床肝移植中采用较少。儿童肝移植由于受者免疫系统尚未健全,接受ABO血型不合肝移植可取得较好的预后[1]。本文总结1例ABO血型不合肝移植术后发生AMR儿童患者的临床资料,探讨儿童肝移植术后AMR的诊断和治疗,现报道如下。
1 材料与方法
1.1 患者基本情况:该患者为女性,2016年4月于天津市第一中心医院行亲体肝移植术,术前原发病为胆道闭锁(biliary atresia,BA)、高胆红素血症,术时年龄为9个月。供者为其父亲,移植物为供肝的左外叶。受者的血型为O型Rh阳性,其供者血型为A型Rh阳性,肝移植术前抗红细胞抗体( 抗A) 滴度为1:4,符合ABO血型不合肝移植标准。手术方式采用背驮式肝移植。胆道重建采取Roux-en-Y胆肠吻合。术中输血量为浓缩红细胞4 U、冰冻血浆400 ml。
1.2 免疫抑制剂应用方案:分别于术中及术后第4天给予巴利昔单抗10 mg,术中给予静脉甲泼尼龙1次(10 mg/kg),此后每日递减,直至1周后改为口服甲泼尼龙(4 mg/d)。采用他克莫司联合甲泼尼龙的两联治疗方案,他克莫司目标浓度维持在6~8 ng/ml。
1.3 AMR的判断标准:AMR的诊断标准包括:① 血清供者特异性抗体(donor specific antibody,DSA)阳性;② 肝穿刺组织出现弥散性血管内皮损伤及小血管周围炎和/或组织中C4d阳性;③ 排除其他可引起类似损伤的原因。
1.4 伦理学:本研究符合医学伦理学标准,得到医院伦理委员会审批(审批号:2018N102KY)。
2 结 果
患者肝移植术后早期肝功能恢复顺利,术后10 d肝功能恢复正常。术后2周后出现肝功能异常,以丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)升高为主,其余指标正常。增加他克莫司用量后,浓度明显升高,但肝功能异常继续加重,除转氨酶升高外,尚伴有碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)、总胆红素(total bilirubin,TB)、直接胆红素(direct bilirubin,DB)等异常升高,抗红细胞抗体(抗A)为阴性。1周后行肝穿活检,病理结果提示中度急性排斥反应(Banff评分5分)、C4d染色阴性,给予静脉甲泼尼龙冲击治疗3 d〔10 mg /(kg·d)〕,此后2 d逐步减量后改为口服甲泼尼龙。
但患者肝功能继续恶化,遂于前次肝穿活检1周后再次行肝穿刺活检,病理结果提示轻度急性排斥反应(Banff评分4分)、C4d染色阳性(图1)。再次给予静脉甲泼尼龙冲击治疗7 d〔5 mg /(kg·d)〕,此后改为口服甲泼尼龙8 mg/d。激素冲击治疗后,患者肝功能未进一步恶化,仍维持原有异常状态。同时采用Luminex技术行人类白细胞抗原 (human lymphocyte antigen,HLA)抗体检测(LIFECODES LMX试剂盒及LIFECODES LSA Single Antigen试剂盒)。HLA抗体检测结果显示患者HLA-Ⅰ类抗体阴性,但多个HLA-Ⅱ类抗体强阳性,经与供者HLA配型比对后发现存在DSA,为HLA-DQ抗体,平均荧光强度(mean fluorescence intensity,MFI)为 13 707。

图1 肝移植术后肝活组织检查病理(C4d免疫组化染色 低倍放大)
结合患者的肝功能变化、2次肝穿刺病理结果及HLA抗体检测情况,患者确诊为DSA导致的AMR。明确诊断后,即给予患者口服吗替麦考酚酸酯(mycophenolate mofetil,MMF)治疗〔口服剂量为600 mg/(m2·次),每12 h 1次〕。先后行血浆置换3次(隔日1次),在血浆置换的次日应用静脉用人免疫球蛋白(intravenous immunoglobulin,IVIG)滴注(2.5 g/d)。上述治疗结束后,患者于明确诊断后1周时接受利妥昔单抗治疗1次〔375 mg /(m2·次)〕。经治疗,患者DSA的MFI持续下降(图2),至治疗4周后肝功能恢复至正常(图3)。但患者随后出现严重的肺感染表现,诊断为间质性肺炎。经长达1个月的抗感染治疗后,患者肺感染痊愈,肝功能持续正常。至目前,随访2年余,肝功能正常,群反应抗体为阴性,抗红细胞抗体(抗A)为阴性。
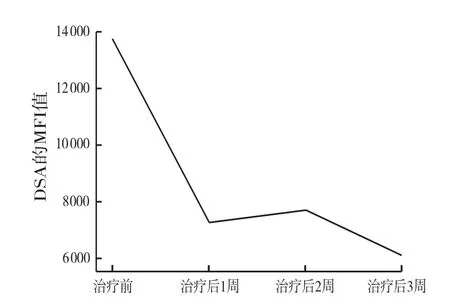
图2 AMR治疗前后的DSA强度变化

图3 AMR治疗前后的肝功能变化
3 讨 论
尽管ABO血型不合肝移植的移植物和受者存活率显著降低,但由于等待移植群体增大与供肝短缺的矛盾日益突出,其已成为扩大供体池的有效手段。一项来自英国的研究表明,对于1岁以内的儿童受者而言,血型不合肝移植的效果与血型相合肝移植相当[2]。我们总结本中心的临床资料后发现,只要术前受者体内的抗红细胞抗体维持在较低水平,低龄儿童患者接受血型不合肝移植是安全有效的。
肝脏作为免疫特惠器官,相比于其他器官,移植术后出现AMR的风险较低,这主要是由于肝脏自身独特的解剖与功能决定的,包括肝脏具有门静脉和肝动脉的双重血液供应、大面积的窦状与库普弗(Kupffer)细胞可稀释及清除免疫复合物、强大的再生能力等[3-4]。
尽管如此,AMR仍是肝移植术后较为常见的难治性并发症之一。早期诊断是AMR治疗的关键,延迟诊断将出现激素耐受、不可逆的移植物功能损害,甚至在后期引发细胞性排斥反应。DSA绝大部分出现在肝移植术后的前几周,在术后早期(<90 d)肝功能衰竭的患者中约占1%,但在DSA阳性患者中早期肝功能衰竭的比例可达10%[5]。在一项随访10年的儿童肝移植的研究中,24例肝功能正常的受者中,33%的受者出现DSA阳性[6]。
肝移植术后出现DSA的危险因素很多,包括使用环孢素而非他克莫司、低免疫抑制水平、术前的终末期肝病评分(model for end-stage liver disease,MELD)<15、低龄等[7]。儿童肝移植受者中发现,受者年龄小于3岁以及钙调神经酶抑制剂浓度过低(他克莫司 <3 ng/ml或环孢素 <30 ng/ml)与DSA的发生明显相关[8]。除此以外,还有研究认为HLA-Ⅱ类抗体错配及之前发生过细胞性排斥反应也是产生DSA的危险因素[9]。但对于环孢素影响也有不同观点。国内宁禹等[10]报道了3例儿童亲体肝移植术后成功撤除免疫抑制剂的病例,研究人员认为术后全部应用环孢素为该部分患者的共同特征之一,但缺乏病理学支持。
在儿童肝移植术后DSA导致的AMR中,有一个显著特征就是抗体位点集中于HLA-Ⅱ类抗体,主要是DQ、DR位点,且其表达强度较高。Valenzuela等[11]的研究发现,27例DSA阳性的儿童受者中,DSA主要针对HLA-Ⅱ类抗原(41% HLA-DR, 53% HLA-DQ),其中非耐受组患者DQ DSA的比例高达61%,高于稳定组(占20%)与耐受组(占29%)(P=0.021)。而在非耐受患者中,DQ DSA的MFI可达13 000以上[12]。
C4d染色阳性是急性AMR的常见特征。有研究指出,发生排斥后DSA可高达75%,排斥反应患者中DSA与C4d同时阳性的比例达54%,这表明此前伴随排斥反应出现了尚未认识到的体液变化[13]。但在肝移植中C4d并不是一个严格反映AMR的标志物。Ali等[14]发现C4d染色阳性可出现在急性细胞性排斥反应(52%)、引起胆管消失的慢性排斥(50%)、原发病复发(48%)、保存损伤(18%)和肝坏死(54%)等不同的肝脏病变中。目前AMR的诊断标准包括以下几点[5]:① 血清DSA阳性;② 肝穿组织出现弥散性血管内皮损伤及小血管周围炎和/或组织中C4d阳性;③ 排除其他可引起类似损伤的原因。
提高对AMR的重视程度、密切监测、维持免疫抑制剂浓度在正常浓度范围,是预防AMR最有效的方法。最理想的就是所有受者移植前都检测DSA,阳性受者术后1~2周再次检测,判断其状态。AMR的治疗主要是降低DSA活性、减少DSA产生,常用方法包括血浆置换、静脉IVIG、单克隆抗体、蛋白酶抑制剂等。在不同治疗方案中,血浆置换都是最常用的方法,可有效清除外周血中的DSA、降低其强度,同时对于伴有高胆红素血症的肝功能异常患者,还可有效改善肝脏功能。IVIG具有免疫调节特性,可中和抗体,抑制补体,竞争性抑制自身IgG,抑制某些涉及免疫反应的细胞,阻断γ-干扰素(γ-interferon,IFN-γ)信号,扩增调节性细胞等[15]。吗替麦考酚酸酯作为一种干扰细胞代谢的免疫抑制剂,可同时抑制T细胞和B细胞的增殖以及T细胞间单磷酸鸟苷(guanosine monophosphate,GMP)的转运,从而起到抑制AMR的作用[16]。作为抗CD20单克隆抗体,利妥昔单抗通过清除记忆性B细胞、减少浆细胞的生成,进而减少DSA的产生,用于治疗顽固性AMR以及预防DSA的产生,其作用明确[17]。而硼替唑米作为蛋白酶抑制剂的一线用药,可明显减少DSA的生成,有效控制AMR[18]。根据本例成功救治的经验,我们认为早期诊断、加用吗替麦考酚酸酯后交替给予血浆置换与IVIG可有效清除体内DSA,减弱其作用,阻止排斥反应进展,而后应用清除B细胞药物,可彻底消除DSA、治愈AMR。
ABO血型不合肝移植术后发生排斥反应的风险较高,尤其需要提高对AMR的重视,常规治疗中维持免疫抑制剂浓度在较高水平。AMR一旦诊断,给予血浆置换、IVIG输入及单克隆抗体等联合治疗方案,可以挽救移植物失功,使其恢复正常功能。
