SP1及HIF-1α在胰腺癌组织中的表达及其与预后的关系
2019-03-15翁美玲吴锡林陈建新郑勤红
翁美玲,吴锡林,陈建新,郑勤红
(衢州市人民医院 肿瘤内科,浙江 衢州 324000)
恶性程度高、难以早期发现、手术切除率低、高侵袭性、对放化疗欠敏感等因素导致了胰腺癌治疗难度大,生存期短。有报道预测[1],2018年美国新发胰腺癌病例将高达55 440 例,死亡病例约达44 330例,占男性恶性肿瘤死因第3位、女性第4位。在中国,2015年新发胰腺癌9万余人,发病率居恶性肿瘤第9位;死亡人数达7.9万人,死亡率居恶性肿瘤第6位[2]。SPl (specificity protein 1)蛋白和HIF-1α (hypoxia inducible factor-1α)都参与调控磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide3-kinase/protein kinase B, PI3K/AKT)通路的异常激活[3-4],本文检测SP1和HIF-1α在胰腺癌中的表达并分析其与胰腺癌临床病理学特征及预后的关系。
1 资料与方法
1.1 一般资料 选取2009年1月—2015年12月于衢州市人民医院收治的未经放化疗的胰腺癌手术标本共42例,其中男22例,女20例;年龄28~75岁,平均58.10±10.30 岁,≤60岁20例,>60岁22例;病理类型均为腺癌,高分化13例,中分化24例,低分化5例;肿瘤直径大小≤2cm者9例,>2cm者33例;胰头颈癌35例,胰体尾癌7例;浸润深度为T1+T2者14例,T3+T4者28例;有淋巴结转移者12例,无淋巴结转移者30例;术前血液 CA199≤300 U/mL者30例,CA199>300 U/mL者12例;按照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第八版胰腺癌TNM分期标准,Ⅰ期14例,Ⅱ期24例,Ⅲ期4例,IV期0例。同时选取癌旁组织15例,其中男8例,女7例;≤60岁7例,>60岁8例。本研究经医院伦理委员会批准,所选患者均签署知情同意书。
1.2 检测方法 4 μm胰腺癌及癌旁组织石蜡标本切片中SP1和HIF-1α的表达采用免疫组化法测定,兔抗人SP1多克隆抗体浓缩液购自美国Bioworld Technology公司,兔抗人缺氧诱导因子1α单克隆抗体浓缩液、SP通用型两步法检测试剂盒、DAB显色液试剂盒均购自北京中杉金桥生物技术公司。免疫组化步骤按照试剂盒说明进行,胰腺癌标本阳性切片作为阳性对照,PBS液置换一抗作为阴性对照。采用查询住院病例与电话随访相结合的方式(随访时间截止至2016年12月31日)记录总生存期(overall survival, OS),OS即由确诊之日起至死亡或者末次随访的时间,时间以月为单位计算。
1.3 结果判定 SP1蛋白定位于胰腺癌细胞核中,细胞核呈棕黄色为阳性细胞;HIF-1α蛋白定位于胰腺癌细胞浆中,胞浆内含有棕黄色颗粒为阳性细胞。SP1和HIF-1α结果的判定分别根据染色强度及阳性细胞比例判定:染色强度无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;每张切片随机选取4个高倍镜(×400)视野计数阳性细胞比例,0%为0分,>0%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分;染色强度评分与阳性细胞比例评分之和≤4分为阴性,>4分为阳性。
1.4 统计学分析 采用SPSS 20.0统计软件,组间比较用χ2检验,相关性分析采用Spearman法,生存期分析采用Kaplan-Meier法和Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 SP1和HIF-1α在胰腺癌组织的表达 胰腺癌组织中SP1的阳性率为69.05%(29/42),癌旁组织中阳性率为20.00%(3/15),差异有统计学意义(P=0.001);胰腺癌组织中HIF-1α的阳性率为64.29%(27/42),癌旁组织中阳性率为0(0/15),差异有统计学意义(P<0.001);见图1。
2.2 胰腺癌组织中SP1和HIF-1α的表达与临床病理特征的关系 在胰腺癌组织中,SP1的表达与患者的浸润深度、淋巴结转移及TNM分期有关,差异有统计学意义(P<0.05);与性别、年龄、肿瘤大小、原发部位、分化程度及术前CA199水平无关(P>0.05)。HIF-1α的表达与患者的肿瘤大小、淋巴结转移及TNM分期有关,差异有统计学意义(P<0.05);与性别、年龄、原发部位、浸润深度、分化程度及术前CA199水平无关(P>0.05)(表 1)。
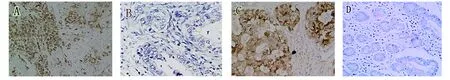
A:SP1的阳性表达;B:SP1的阴性表达;C:HIF-1α的阳性表达;D:HIF-1α 的阴性表达。图1 SP1和HIF-1α在胰腺癌组织的表达(×200)
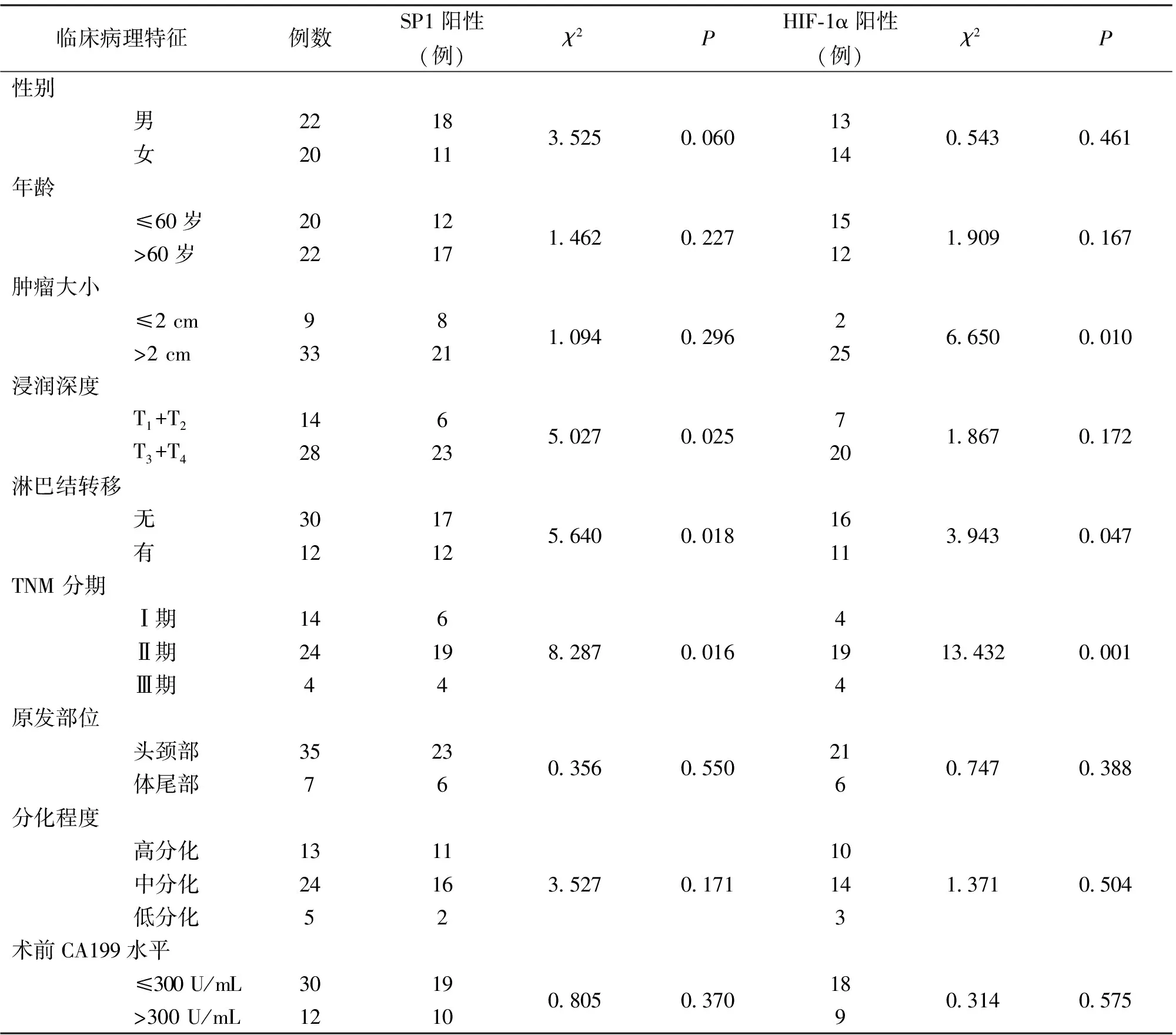
临床病理特征例数SP1阳性(例)χ2PHIF-1α阳性(例)χ2P性别男2218女20113.5250.06013140.5430.461年龄≤60岁2012>60岁22171.4620.22715121.9090.167肿瘤大小≤2 cm98>2 cm33211.0940.2962256.6500.010浸润深度T1+T2146T3+T428235.0270.0257201.8670.172淋巴结转移无3017有12125.6400.01816113.9430.047TNM 分期Ⅰ期146Ⅱ期2419Ⅲ期448.2870.016419413.4320.001原发部位头颈部3523体尾部760.3560.5502160.7470.388分化程度高分化1311中分化2416低分化523.5270.171101431.3710.504术前CA199水平≤300 U/mL30 19>300 U/mL12100.8050.3701890.3140.575
2.3 胰腺癌组织SP1和HIF-1α的表达与生存期的关系 SP1阳性患者的中位总生存期(mOS)为15.1±1.5个月,低于SP1阴性患者的19.4±1.2个月,差异有统计学意义(P=0.002),见图2A。HIF-1α阳性患者的mOS为14.5±1.4个月,低于HIF-1α阴性患者的20.7±0.9个月,差异有统计学意义(P=0.001),见图2B。
2.4 SP1、HIF-1α在胰腺癌组织中表达的相关性及其联合表达与预后的关系 胰腺癌组织中SP1和HIF-1α的表达呈正相关(r=0.361,P=0.019),见表2。SP1、HIF-1α均为阳性的胰腺癌患者mOS为12.2±0.9个月,SP1阳性、HIF-1α阴性的患者mOS为19.7±1.3个月,SP1阴性、HIF-1α阳性的患者mOS为17.6±1.1个月,SP1、HIF-1α均阴性的患者mOS为23.4±1.3个月,差异有统计学意义(P<0.001),见图3。

A:SP1;B:HIF-1α。图2 SP1和HIF-1α阳性和阴性胰腺癌患者的生存曲线
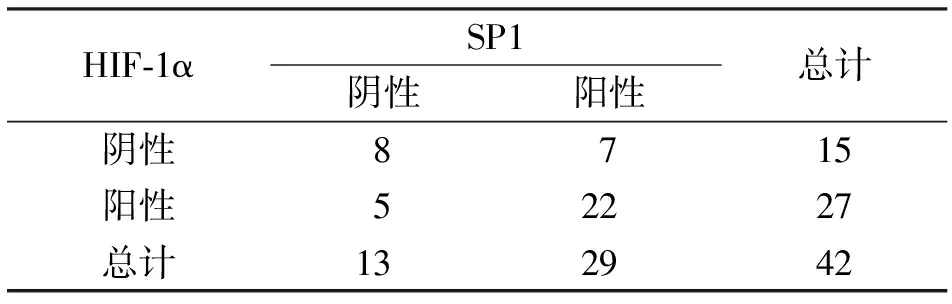
HIF-1αSP1阴性阳性总计阴性8715阳性52227总计132942

图3 SP1 和HIF-1α联合检测与胰腺癌患者生存期的关系
3 讨论
血管内皮生长因子(vascular endothelial growth factor, VEGF)启动子上有HIF-1α、SP1结合位点,近端是富含GC/GT区域,SP1与其结合上调VEGF表达。於永爱等[5]检测SP1在卵巢癌中的表达率为42.5%,显著高于良性上皮性肿瘤组(15.0%)。晚期卵巢癌组SP1表达率上升(57.14%),显著高于早期卵巢癌组(26.32%)。洪亮等[6]发现结肠癌中SP1表达率(74.68%)明显高于癌旁组织(21.52%)。王时光等[7]从形态学和分子学证实缺氧上调了HIF-1α的表达,促进胰腺癌细胞上皮间质转化(epithelial-mesenchumal transition, EMT)及侵袭迁移。贾如江等[8]检测了HIF-1α在胰腺癌组织中阳性率为52.4%,其表达与分期、淋巴结转移、神经受侵及脉管癌栓有关。本研究结果显示,胰腺癌组织中SP1和HIF-1α的阳性率明显高于癌旁组织中的阳性率;SP1的表达与患者的浸润深度、淋巴结转移及TNM分期有关,HIF-1α的表达与患者的肿瘤大小、淋巴结转移及TNM分期有关;提示SP1可能参与了胰腺癌的浸润与淋巴道转移,HIF-1α可能参与了胰腺癌的生长及淋巴道转移过程。
在胰腺癌中,VEGF是重要的促肿瘤新生血管形成因子,PI3K/AKT通路参与了SP1对VEGF的正向调控,该通路的激活也可促进HIF-1α的表达,进而上调VEGF的表达。本研究结果显示,SP1、HIF-1α在胰腺癌中的表达呈正相关性,提示SP1和HIF-1α调控VEGF的机制虽不尽相同,但可能存在一定的协同作用。本研究结果还显示,SP1和HIF-1α均阳性患者生存期明显比单个蛋白阳性的患者短,SP1和HIF-1α均阴性患者生存期最长,提示联合检测两个蛋白可能有助于预测胰腺癌的预后。
