晚期卵巢癌患者卵巢癌组织中免疫细胞表达水平与新辅助化疗敏感性的关系
2019-03-14李贺群徐晖严波侯莹黄大福张雷
李贺群,徐晖,严波,侯莹,黄大福,张雷
南京市溧水区人民医院肿瘤内科,南京 2112000
卵巢癌是临床发病率较高的妇科恶性肿瘤之一。21世纪以来,女性承担的社会责任越来越重,工作和生活节奏日益紧张,卵巢癌的发病率逐年上升[1]。由于卵巢解剖位置隐匿,早期临床症状不典型,多数患者确诊时已至中晚期,甚至已发生盆腔和腹腔转移,预后较差,5年生存率仅为30%[2]。目前,国际上普遍认可的晚期卵巢癌标准的治疗方案为肿瘤细胞减灭术联合术后化疗[3]。但由于部分患者确诊时已发生盆腔和腹腔广泛的种植转移,难以实现满意减瘤,因此,越来越多的学者建议,卵巢癌可先进行新辅助化疗[4],降低肿瘤负荷从而为患者创造能够达到满意减瘤的手术条件。近年来,随着新辅助化疗方法的不断进展,越来越多的晚期卵巢癌患者可实现满意减瘤,但仍有部分患者对新辅助化疗的敏感性不高,因此,如何预测这类患者的复发转移风险,成为新辅助化疗亟待解决的难题。免疫微环境一直是肿瘤领域研究的热点,与多种恶性肿瘤的预后密切相关。研究显示,卵巢癌组织和癌旁组织中均浸润着大量的免疫细胞,包括CD8+细胞毒性T细胞(cytoxic T lymphocyte,CTL)和叉头/翼状螺旋转录因子(forkhead/wingedhelix transcription factor,FOXP3)调节性T细胞(regulatory T cell,Treg)[5],但目前关于肿瘤局部免疫与新辅助化疗预后的相关性研究仍较少。本研究分析晚期卵巢癌患者肿瘤浸润免疫细胞对新辅助化疗敏感性的预测价值,为后续个体化治疗提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2013年7月至2017年6月在南京市溧水区人民医院接受新辅助化疗的晚期卵巢癌患者的临床资料。纳入标准:①经病理学活检和细胞学检查确诊为晚期卵巢癌;②术前接受1~2个疗程的以铂类药物为基础的新辅助化疗方案治疗;③临床资料完整;④复发后随访时间≥6个月。排除标准:①新辅助化疗前接受放疗或化疗的患者;②新辅助化疗前接受激素替代治疗或免疫治疗的患者;③依从性差的患者。依据纳入和排除标准,共纳入82例晚期卵巢癌患者,年龄26~71岁,平均年龄为(51.05±7.17)岁;依据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准,所有患者均为Ⅲ~Ⅳ期。
1.2 方法
1.2.1 治疗方法 所有患者均接受紫杉醇/多西他赛+卡铂/顺铂化疗方案:第1天,紫杉醇135~175 mg/m2或多西他赛75~100 mg/m2,静脉滴注;第2 天,卡铂 300~400 mg/m2或顺铂75~100 mg/m2,静脉滴注。同时给予对症处理,每3周为1个疗程,共治疗1~2个疗程,疗程结束停药2周,所有患者接受妇科检查和影像学检查,无手术禁忌证的患者可接受肿瘤细胞减灭术。
1.2.2 染色方法 按照病例编号调取在本院病理科存档的石蜡包埋的病理组织,脱蜡水化后切片,置于载玻片上,烘干48 h后备用。将组织切片逐步进行二甲苯脱蜡(二甲苯I和二甲苯Ⅱ各5 min)和乙醇梯度水化(100%乙醇和95%乙醇各5 min),加入磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗5 min,重复3次;然后加入柠檬酸缓冲液进行组织抗原修复,室温下冷却30~60 min,PBS冲洗3次。滴加H2O2,室温下孵育10 min,PBS冲洗3次;滴加一抗(1∶200稀释),4℃孵育过夜,PBS冲洗3次;滴加二抗,室温下孵育60 min,PBS冲洗3次;加入二氨基联苯胺(diaminobenzidine,DAB)试剂显色;苏木精复染;脱水后,采用中性树胶封片。室温下干燥48 h后,由2名以上经验丰富的病理科医师读片并分析免疫组织化学染色结果,不一致时由第3名医师按照评分标准进行评定。
1.3 观察指标和评价标准
1.3.1 临床疗效 依据实体瘤疗效评价标准(RECIST 1.1)[6]评估临床疗效:完全缓解(complete response,CR),肿瘤病灶完全消失;部分缓解(partial response,PR),靶病灶最大径之和缩小≥30%;疾病进展(progressive disease,PD),靶病灶最大径之和增加≥20%或出现新病灶;疾病稳定(stable disease,SD),介于PR和PD之间。客观缓解率(objective response rate,ORR)=(CR+PR)例 数/总 例 数 ×100%。病理学完全缓解(pathologic complete response,pCR):卵巢癌组织和淋巴结内未见浸润性肿瘤细胞残留[7]。
1.3.2 染色结果判定 CD8+CTL和FOXP3+Treg均定位于细胞核,免疫组织化学染色均呈棕黄色,选择细胞浸润的中位数作为判定截点,高于中位数即为高表达,低于中位数即为低表达。由2名经验丰富的病理科专业医师单独读片,若判定结果不一致,协商后确定最终结果。
1.4 统计学方法
采用SPSS 19.0软件对-数据进行统计分析。计量资料以均数±标准差(x±s)表示,组内比较采用配对样本t检验,组间比较采用两独立样本t检验;计数资料以例数和率(%)表示,组间比较用χ2检验;晚期卵巢癌患者ORR的影响因素采用Logistic回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1 CD8+CTL和FOXP3+Treg在卵巢癌组织和癌旁组织中的表达
CD8表达于细胞膜,散在分布于卵巢癌组织内,聚集分布于癌旁组织;FOXP3表达于细胞核,在卵巢癌组织和癌旁组织多呈散在分布,少部分呈聚集分布(图1)。新辅助化疗前,癌旁组织中CD8+CTL和FOXP3+Treg表达水平均明显高于卵巢癌组织(t=12.598,P<0.01;t=17.537,P<0.01)。新辅助化疗后,癌旁组织中CD8+CTL和FOXP3+Treg的表达水平均明显高于卵巢癌组织(t=12.172,P<0.01;t=9.467,P<0.01);且FOXP3+Treg在卵巢癌组织和癌旁组织中的表达水平均明显低于新辅助化疗前(t=13.555,P<0.01;t=18.034,P<0.01);但CD8+CTL在卵巢癌组织和癌旁组织中的表达水平与新辅助化疗前比较,差异均无统计学意义(P>0.05)。(表1)

图1 CD8+CTL和FOXP3+Treg在卵巢癌组织和癌旁组织中的表达情况(×100)

表1 CD8+CTL和FOXP3-+Treg在卵巢癌组织和癌旁组织中的表达水平(%,x±s)
2.2 CD8+CTL和FOXP3+Treg的阳性表达率与晚期卵巢癌患者临床特征的关系
不同分化程度和FIGO分期的晚期卵巢癌患者的卵巢癌组织和癌旁组织CD8+CTL和FOXP3+Treg阳性表达率比较,差异均无统计学意义(P>0.05)。(表 2)

表2 不同临床特征晚期卵巢癌患者CD8+CTL和FOXP3+Treg的阳性表达情况
2.3 晚期卵巢癌患者ORR影响因素的单因素分析
新辅助化疗后,61例患者达到客观缓解,ORR为74.39%。单因素分析结果显示,不同FIGO分期、卵巢癌组织FOXP3+Treg表达水平、癌旁组织CD8+CTL表达水平的晚期卵巢癌患者的ORR比较,差异均有统计学意义(P<0.01)。(表3)
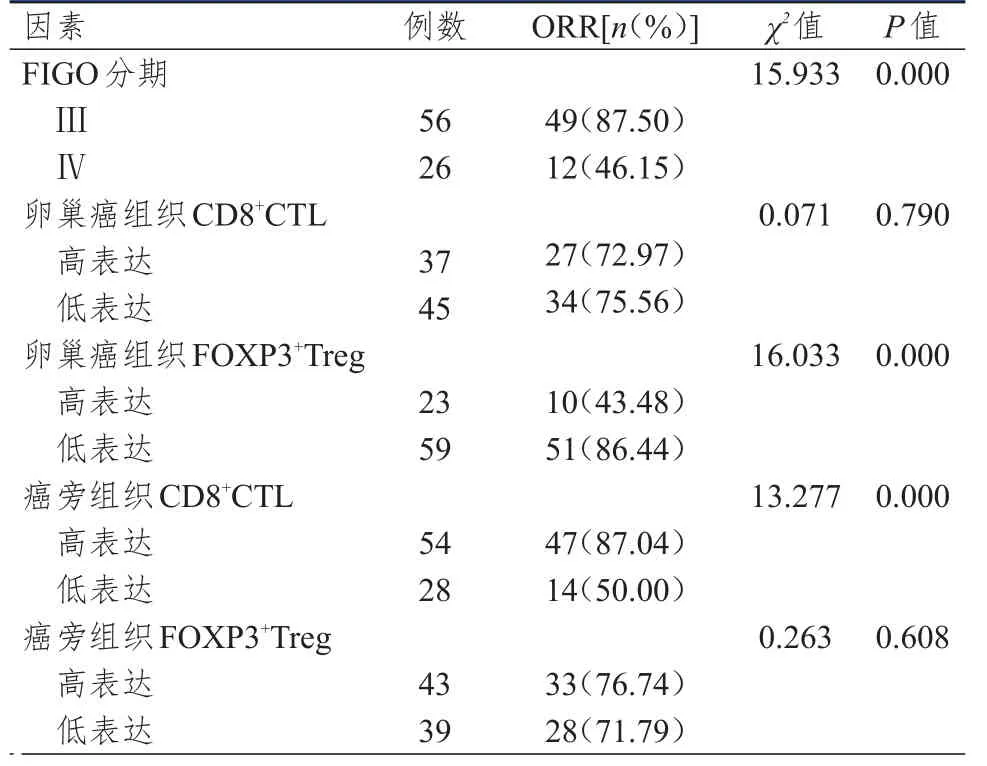
表3 82例晚期卵巢癌患者ORR影响因素的单因素分析
2.4 新辅助化疗后晚期卵巢癌患者ORR影响因素的多因素分析
将单因素分析中差异有统计学意义的FIGO分期、卵巢癌组织FOXP3+Treg表达水平、癌旁组织CD8+CTL表达水平纳入多因素Logistic回归分析,结果显示,癌旁组织CD8+CTL高表达、卵巢癌组织FOXP3+Treg低表达、FIGO分期为Ⅳ期是ORR的影响因素。(表 4)

表4 新辅助化疗后82例晚期卵巢癌患者ORR影响因素的多因素Logistic回归分析
2.5 缓解组和未缓解组CD8+CTL和FOXP3+Treg的表达情况
新辅助化疗后,15例患者达到pCR,pCR率为18.29%,并依据是否达到pCR分为缓解组(n=15)和未缓解组(n=67)。未缓解组患者卵巢癌组织和癌旁组织中FOXP3+Treg表达水平均高于缓解组患者(t=2.144,P=0.035;t=8.765,P<0.01);但两组患者CD8+CTL表达水平比较,差异均无统计学意义(P>0.05)。(表5)
3 讨论
肿瘤免疫微环境一直都是肿瘤研究领域的热点和难点。肿瘤细胞本身具有免疫原性,可被正常的免疫系统识别并杀灭;但肿瘤细胞又可以分泌炎性因子,降低自身免疫原性,从而逃脱免疫系统的攻击,这就是所谓的“免疫逃逸”。研究显示,化疗、放疗等抗肿瘤治疗的敏感性均与肿瘤免疫微环境密切相关[8]。

表5 缓解组和未缓解组晚期卵巢癌-患者CD8+CTL和FOXP3+Treg的表达情况(%,x±s)
卵巢癌是病死率最高的女性生殖系统恶性肿瘤之一[9],因卵巢的解剖位置特殊且缺乏典型的早期临床表现,多数患者确诊时已至中晚期。目前,临床一般采用减瘤术联合术后辅助放化疗治疗晚期卵巢癌,但多数患者很难达到满意减瘤。为提高满意减瘤率,20世纪70年代,Griffiths提出将新辅助化疗作为晚期卵巢癌患者可供选择的治疗方案,即在减瘤术前先进行数个疗程的化疗,使病灶松动坏死、腹腔积液量减少后再实施减瘤术。Denkert等[10]学者认为,新辅助化疗前肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)数 与pCR密切相关,TIL数越多,患者接受新辅助化疗后pCR率越高。表明肿瘤局部免疫反应可提高化疗的敏感性。CD8+CTL和FOXP3+Treg是两类最重要的免疫功能相反的淋巴细胞,前者具有细胞毒性可使肿瘤细胞凋亡,而后者可抑制或分泌抑制性细胞因子诱导T细胞耐受,从而导致免疫抑制[11-12]。本研究旨在探讨新辅助化疗对晚期卵巢癌患者局部免疫微环境的影响,以及CD8+CTL和FOXP3+Treg对新辅助化疗敏感性的影响。
本研究首先探讨新辅助化疗前后肿瘤局部免疫细胞浸润的变化情况,结果显示,FOXP3+Treg在卵巢癌组织和癌旁组织中的表达水平均明显低于新辅助化疗前(P<0.05);但CD8+CTL在卵巢癌组织和癌旁组织中的表达水平与新辅助化疗前比较,差异均无统计学意义(P>0.05)。表明卵巢癌组织局部免疫能力增强,且FOXP3+Treg对化疗的敏感性更强。但有研究显示,化疗后CD8+和FOXP3+细胞数均有所降低,且CD8+/FOXP3+比值与化疗前相比有所增加[13]。这可能是因为肿瘤免疫微环境本身极为复杂,不同的化疗方案、化疗时间和肿瘤类型会导致肿瘤的免疫状态不甚相同。此外,Li等[11]研究发现,肿瘤组织中FOXP3+低表达水平的卵巢癌患者的pCR率更高,与本研究结果基本一致。本研究结果显示,未缓解组患者卵巢癌组织和癌旁组织FOXP3+Treg表达水平均高于缓解组患者,表明癌旁组织FOXP3+Treg表达水平可能与化疗达到pCR密切相关。
对新辅助化疗敏感性较高的肿瘤患者更容易实现满意减瘤,因此,评估新辅助化疗的治疗效果,对实施后续个体化治疗至关重要。本研究结果显示,新辅助化疗前,癌旁组织CD8+CTL高表达、卵巢癌组织FOXP3+Treg低表达是ORR的影响因素。表明新辅助化疗前,患者肿瘤局部免疫反应越高,对新辅助化疗敏感性越高。
综上所述,晚期卵巢癌患者肿瘤局部组织FOXP3+细胞浸润状态可作为新辅助化疗敏感性的有效预测指标,且新辅助化疗后患者肿瘤局部组织FOXP3+低表达可能与实现pCR密切相关。目前,临床采用单抗抑制T细胞免疫抑制及肿瘤局部的免疫抑制状态,以期提高机体的免疫反应,治疗效果较理想。但仍需进一步探讨肿瘤患者在接受新辅助化疗前,是否可先给予某种单抗以提高其对化疗的敏感性。
