肺原位腺癌与微浸润腺癌能谱CT特征及病理分化的对比研究
2019-03-14杨俊潇安冬会屈亚林谢慧吴绍全
杨俊潇,安冬会,屈亚林,谢慧,吴绍全
重庆医科大学附属第一医院大足医院/重庆市大足区人民医院放射科,重庆 4023600
随着影像技术的发展和胸部计算机体层摄影(computerized tomography,CT)检查的普及,肺部小结节的检出率越来越高。研究显示,胸部CT筛查可以降低肺癌患者的病死率[1],尤其是肺腺癌的检出结果显示,女性肺腺癌的发病率高于男性[2]。宝石能谱CT相对于传统的螺旋CT有更高的时间、空间分辨率,扫描速度更快,成像更清晰,对肺部小结节的检出率更高。肺原位腺癌(adenocarci-noma in situ,AIS)和微浸润腺癌(microinvasive adenocarcinoma,MIA)的 CT表现均为磨玻璃影(ground-glass opacity,GGO)。国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)认为,AIS和MIA从病理角度上是同一种疾病的不同发展阶段[3]。本文应用宝石能谱CT薄层扫描,结合后处理技术对137个肺小结节的CT特征及病理分化程度进行分析,探讨其影像学特征,为临床诊断及治疗提供有力的依据。
1 资料与方法
1.1 一般资料
回顾性分析2013年3月至2017年5月于重庆医科大学附属第一医院大足医院诊治的AIS和MIA患者的临床资料。纳入标准:①病理诊断为AIS或MIA;②新发病灶;③接受手术切除术治疗;④接受胸部高分辨率CT(high resolution CT,HRCT)检查;⑤病灶直径<2 cm;⑥临床资料完整。排除标准:①有淋巴结、胸膜及远处脏器转移;②有肺结核或其他肿瘤。根据纳入、排除标准,共纳入137例患者,CT平扫结果显示共137个小结节。采用2011年IASLC、美国胸科学会(American Thoracic Society,ATS)和欧洲呼吸学会(European Respiratory Society,ERS)新病理分类标准[3],将137例患者分为AIS组78例和MIA组59例。57.7%患者(79/137)为体检时发现小结节影,来院行进一步检查;42.3%患者(58/137)以咳嗽、咳痰等症状来院就诊,行胸部CT检查时发现病灶。AIS组78例患者的年龄为31~68岁,平均年龄为(53.48±12.17)岁;男36例,女42例。MIA组59例患者的年龄为39~70岁,平均年龄为(57.63±11.25)岁;男27例,女32例。两组患者的年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 检查仪器及方法
胸部扫描采用GE宝石能谱CT扫描机平扫。患者仰卧位,平静呼吸,扫描参数:扫描层厚、层间距均为5 mm,管电压为80~120 kV,自动管电流;以高分辨率算法重建,重建层厚为0.625 mm。CT图像传入GE AW4.3工作站,运用多平面重组(multi-planar reformation,MPR),以邻近支气管血管和胸膜为参照,完成三维显示,以肺窗和纵隔窗观察病灶的特征。
1.3 观察指标及评价方法
由两位从事影像诊断工作10年以上的放射科主治医师在工作站上对影像资料共同进行分析,指标包括病灶的直径、密度(GGO区域及实性区域的CT值)、毛刺征、空泡征及胸膜凹陷征。比较两组患者的病理分化情况。肺结节大小在MPR正交图像最大截面上测量,主观判定密度均匀的实性结节,在最大层面中心区域取CT值,GGO密度测定时选取最大中心层面,测量3次,取平均值;按照通常阅片规律,判断结节内部是否有空泡征,边缘是否有毛刺征和胸膜凹陷征。利用图像处理软件分析病灶的能量衰减曲线,观察能谱衰减曲线变化并根据公式 K80~120keV=(CT 值80keV-CT值120keV)/50,计算曲线斜率。
1.4 统计学方法
采用SPSS 17.0统计软件分析数据。计数资料以例数和-率(%)表示,采用χ2检验;计量资料以均数±标准差(x±s)表示,采用t检验;等级资料比较采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 病灶直径及CT值
137例病灶中GGO 109例(79.6%),混合磨玻璃影(mixed ground-glass opacity,mGGO)28例(20.4%);GGO区域的平均CT值为(578±97)Hu,实性区域的平均CT值为(321±101)Hu。137例病灶的直径为4.1~19.8 mm。AIS组病灶的平均直径为(9.1±0.8)mm,短于MIA组的(9.6±1.1)mm,差异有统计学意义(t=3.081,P<0.05);AIS组病灶的平均CT值为(581±78)Hu,明显大于MIA组的(479±107)Hu,差异有统计学意义(t=6.454,P<0.01)。
2.2 病灶边缘及内部HRCT特征
137例病灶中边界清晰75例(54.7%),边缘可见毛刺征15例(10.9%)、胸膜凹陷征21例(15.3%),内部可见空泡征26例(19.0%)。两组病灶上述CT特征比较,差异有统计学意义(χ2=16.545,P<0.01)(表1)。
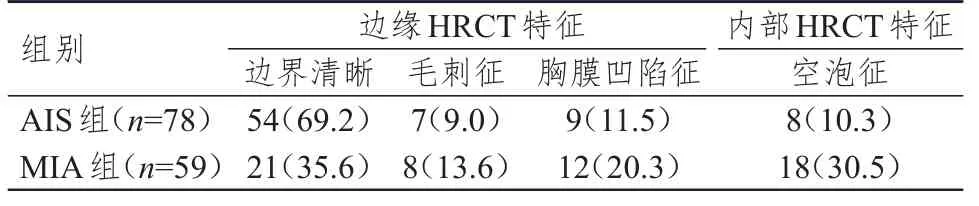
表1 两组病灶边缘及内部HRCT特征[n(%)]
2.3 能谱CT能量衰减曲线
两组患者的能谱CT能量衰减曲线均为下降型。AIS组和MIA组患者的能量衰减曲线斜率为分别为(1.78±0.31)和(1.83±0.54),两组比较,差异无统计学意义(P>0.05)。(图1)
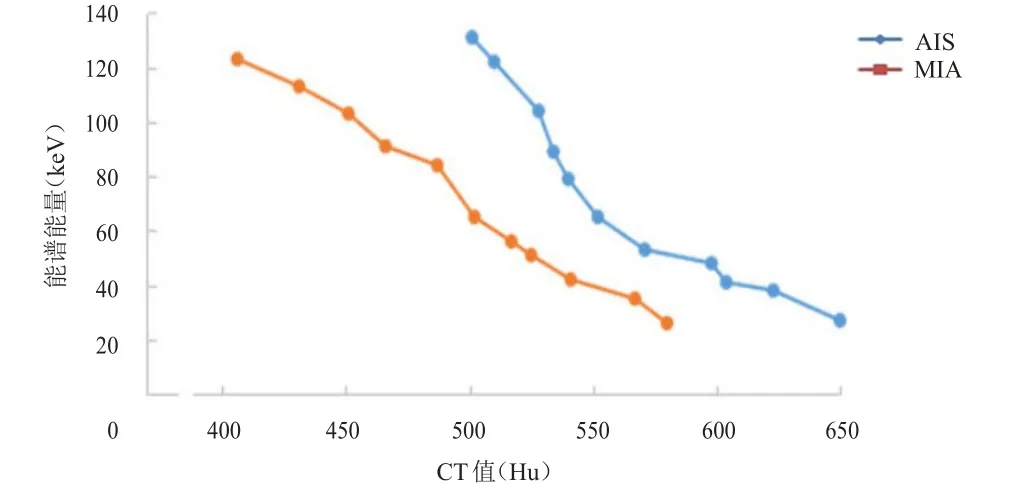
图1 AIS患者(n=11)和MIA患者(n=11)的能谱CT能量衰减曲线
2.4 病理分化情况
两组患者高分化、中分化、低分化情况比较,差异无统计学意义(P>0.05)。(表2)

表2 两组患者的病理分化程度[n(%)]
3 讨论
3.1 AIS与MIA的直径、CT值、HRCT特征的研究现状
近年来,随着肺GGO检出率的增加及肺腺癌发病率的上升,现有的病理类型已经不足以反映其分子生物学、病理学及影像学的新进展。2011年IASLC、ATS和ERS的新病理类型中结合了病理、临床、影像及分子遗传学等学科,取消“细支气管肺泡癌”,引入了“AIS”及“MIA”这两个概念;直径<1 cm的GGO病理类型,除了不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、AIS,还存在MIA和肺浸润性腺癌(invasive pulmonary adenocarcinoma,IPA)的可能,这4种病理类型多种CT征象有重叠[3]。目前,国内外许多学者研究了AIS和MIA的HRCT征象,但结合病理类型的研究相对较少。Lee等[4]发现用GGO横断面最大径鉴别肺腺癌侵袭性病变和侵袭前病变时纯磨玻璃影(pure ground-glass opacity,pGGO)的最佳直径为10 mm,而mGGO的临界最大径为14 mm,多为IPA。本研究中AIS组和MIA组病灶的平均直径分别为(9.1±0.8)mm和(9.6±1.1)mm,多为pGGO,与上述研究结果相符。IKeda等[5]对 AAH、AIS、MIA、IPA病灶的GGO区CT值进行测量,结果显示,584 Hu是鉴别AAH和AIS的最佳临界值,472 Hu为鉴别AIS和IPA的最佳CT值。本研究中MIA组和AIS组病灶的CT值均在上述范围内。空泡征的病理学基础是肿瘤细胞沿肺泡壁生长过程中伴有周围含气肺组织受压,使肺泡或小支气管呈充气性改变[6]。本研究137例病灶中26例有空泡征,其中AIS组占30.8%(8/26),MIA组占69.2%(18/26),由此可见,随着病灶的发展,空泡征的发生率升高。Lee等[7]提出空泡征的发生率随GGO内实性成分增加而增加,从AIS到MIA进展中,肺泡壁肿瘤组织进一步增生,而肺泡内气体减少。毛刺征对应的病理特征是肿瘤组织侵犯小支气管、邻近小血管和淋巴管,并伴有纤维组织增生[8],而AIS不侵犯胸膜、基质和血管,在理论上不应该出现毛刺征。吴芳等[9]认为,随着肺腺癌恶性程度的增高,病变直径增大,密度增加,病灶边缘不光滑,分叶征和毛刺征出现的概率相应增加。胸膜凹陷征并非等于侵犯胸膜,影像上是指肺结节表面与胸膜表面之间形成的线状或三角形影,理论上AIS没有促使结缔组织形成,不会造成胸膜凹陷,但不排除受结节及周围良性结构的塌陷影响,导致肺小叶不张或纤维化,形成胸膜凹陷征。李铭等[10]认为,肿瘤恶性程度的进展会刺激纤维成分增生,导致血管牵拉及胸膜凹陷明显。本研究中AIS和MIA的HRCT特征(边界清晰、毛刺征、胸膜凹陷征、空泡征)比较,差异有统计学意义(P<0.01),说明在肺小腺癌早期随着疾病进展会出现毛刺征和胸膜凹陷征等,但在鉴别诊断上仍需要结合其他特异性征象综合分析。
3.2 AIS与MIA的病理表现及分化程度比较
HE染色后高倍镜下观察AIS,可见肺泡结构存在,间隔增厚,肺泡间质增生,细胞核异型性不显著,无分层[11];MIA病理表现主要为沿肺泡壁伏壁生长为主的病灶,浸润表现是肿瘤细胞穿透基底膜,浸润间质,细胞出现分层现象,排列成乳头状及腺泡样,少部分呈实体型,最大浸润直径≤5 mm,且AIS和MIA均无淋巴结转移及胸膜受累[12]。高分化的AIS组织由单层或复层柱状上皮细胞构成,低分化的AIS则常见实性癌巢,腺泡样结构少见。本研究的低分化AIS病灶较少,中、高分化AIS病灶较多,但AIS组和MIA组病灶高、中、低分化情况比较,差异无统计学意义(P>0.05),这可能是由于病灶从AIS到MIA是一个多基因参与的连续进展的动态过程,只在局部出现侵袭性,所以病理分化的变化不明显。但是在镜下AIS到MIA,各种肺腺癌的典型特征逐步形成,AIS中肺泡腔的脱落细胞在细胞壁一侧聚集,相邻细胞壁开始逐渐变性,为血管生长侵犯基底膜做准备。从AIS到MIA,肿瘤细胞的排列方式表现出连续性生长,但AIS面对的是肺泡腔内气体,而MIA面对则是液体,从而细胞形态转为适应性生长,这是病理分化上较大的区别所在。
3.3 能谱CT的优势
宝石能谱CT为近年来新兴起的一项CT扫描单源双能技术,通过X线球管高低双能瞬时切换获得高分辨率图像,有效避免硬化、运动伪影等对图像的影响,可更准确地反映病灶的本质。宝石能谱CT用宝石做探测器材料,与传统CT稀土陶瓷探测器等比较,稳定性更高,透气性更好,可以实现瞬时双能采集数据,保证在更低的辐射剂量下得到更好的图像质量,可以扫描传统CT不能发现的微小病灶[13]。本研究中,AIS组和MIA组患者的能量衰减曲线斜率比较,差异无统计学意义(P>0.05),考虑可能是因为肿瘤内部组织分化不明显,只在局部有区别,加之样本量小,因此计算出的斜率差异不大。国内有研究显示,不同病理类型的肺癌患者的能谱CT曲线斜率比较,差异有统计学意义(P<0.05),可以起到鉴别诊断的作用[14]。另有研究显示,孤立性肺结节能谱CT分析发现,与传统低剂量CT比较,能谱CT诊断良恶性结节的准确率更高,具有明显优势[15]。
3.4 本研究的不足
本研究存在一定的局限性。第一,样本量小,大多数直径1 cm左右的磨玻璃结节患者选择随访观察,未选择手术治疗,导致病例收集不多;第二,分组存在偏倚,男女未分组,混合磨玻璃结节及多发结节均未讨论;第三,混合磨玻璃结节的CT值测量容易存在误差。
综上所述,能谱CT可以较好地鉴别AIS和MIA,有助于临床肺腺癌患者的早期诊断。
