泡盛曲霉β-1,3-1,4-葡聚糖酶的纯化、性质及其用于制备β-葡寡糖
2019-03-14陈子贤刘学强闫巧娟江正强
陈子贤,刘学强, 张 彬, 闫巧娟,江正强
(1.河南科技大学 食品与生物工程学院,洛阳 471023;2.中国农业大学 工学院,北京 100083;3.中国农业大学食品科学与营养工程学院,北京 100083)
β-1,3-1,4-葡聚糖主要存在于谷物胚乳和麸皮的细胞壁中,是由葡萄糖通过β-1,3和β-1,4混合糖苷键连接而成[1]。β-1,3-1,4-葡聚糖可用于生产β-葡寡糖。β-葡寡糖具有较好的生理活性,如燕麦β-葡寡糖对鼠李糖乳杆菌(Lactobacillus rhammosus)、嗜酸乳杆菌(Lactobacillus acidophilus)和双歧杆菌(Bifidobacterium bifidum)等益生菌有较好增殖效果[2];地衣多糖葡寡糖对大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、肺炎克雷伯菌(Klebsiella pneumoniae)和鼠伤寒沙门氏菌(Salmonella typhimurium)等有害菌具有较高的抑制活性[3];还有研究报道β-葡寡糖具有改善脂代谢和延缓衰老的功能活性[4]。目前,生物酶解β-1,3-1,4-葡聚糖是制备β-葡寡糖的主要方法。
β-1,3-1,4-葡聚糖酶(EC 3.2.1.73)又称地衣多糖酶,能专一性水解β-1,3-1,4-葡聚糖中临近β-1,3-糖苷键的 β-1,4-糖苷键生成 β-葡寡糖。β-1,3-1,4-葡聚糖酶在啤酒和饲料工业中具有重要的应用价值[5]。该酶可降解大麦中β-葡聚糖,从而降低啤酒醪黏度,提高过滤速度,提升啤酒生产效率和品质[6]。该酶添加于饲料中可有效降低动物消化道食糜的黏度,提高饲料利用率,促进动物生长[7]。
β-1,3-1,4-葡聚糖酶来源广泛,微生物 β-1,3-1,4-葡聚糖酶是报道最多的,其中细菌来源多以芽孢杆菌属和类芽孢杆菌属为主,如枯草芽孢杆菌 (Bacillus subtilis)[8]、 地衣芽孢杆菌(Bacillus licheniformis)[9]、巴伦葛兹类芽孢杆菌(Paenibacillus barengoltzii)[10]等。真菌来源相对较少,如嗜热拟青霉(Paecilomycesthermophila)[11]、 米 黑 根 毛 霉(Rhizomucor miehei)[12]、 樟 绒 枝 霉 (Malbranchea cinnamomea)[13]、黑曲霉(Aspergillus niger)[14]、黄曲霉(Aspergillus flavus)[15]等报道产 β-1,3-1,4-葡聚糖酶。目前已有一些真菌β-1,3-1,4-葡聚糖酶纯化和性质的报道,如:丁叶梅等[16]从碎囊毛霉(Mucorpetrinsularis)发酵液中分离纯化了一个 β-1,3-1,4-葡聚糖酶,该酶相对分子质量为17.2×103,其最适pH和温度分别为5.5和55℃。Elgharbi等[17]从黑曲霉发酵液中分离纯化了一个 β-1,3-1,4-葡聚糖酶,该酶相对分子质量为3.2×104,其最适pH和温度分别为5.0和60℃。但目前尚未有泡盛曲霉β-1,3-1,4-葡聚糖酶纯化和性质的报道。
泡盛曲霉CAU33是作者所在研究室筛选的一株高产β-1,3-1,4-葡聚糖酶的真菌。前期研究优化了泡盛曲霉液体发酵和固体发酵产β-1,3-1,4-葡聚糖酶的条件,最终发酵酶活力分别可达8 447 U/mL和40 833 U/g[18-19],但并未研究分离纯化和酶学性质。根据泡盛曲霉的葡聚糖酶酶谱分析表明,该菌在液体发酵时能够分泌一种β-1,3-1,4-葡聚糖酶 (29 kDa),而固体发酵时可同时分泌3种β-1,3-1,4-葡聚糖酶,其中最主要的是相对分子质量2.9×104的 β-1,3-1,4-葡聚糖酶。 因此作者主要研究该酶(AaBglu29)的纯化和酶学性质。另外,燕麦麸皮作为一种农业废弃物,其β-1,3-1,4-葡聚糖质量分数可达5.5%~9.0%[10],可做为一种优良的葡寡糖制备原料,故进一步考察了AaBglu29水解燕麦麸皮制备葡寡糖。
1 材料与方法
1.1 材料与仪器
泡盛曲霉CAU33:作者所在实验室筛选并保存;燕麦葡聚糖:购于武汉百特纯产品;大麦葡聚糖、地衣多糖、榉木木聚糖、CMC、可得然胶、昆布多糖、壳聚糖、槐豆胶和对硝基苯酚化合物(pNP-βxylopyranoside,pNP-β -galactopyranoside,pNP-β -glucopyranoside和 pNP-β-cellobioside):购于 Sigma公司;纤维二糖、纤维三糖和纤维四糖购于上海源叶生物公司;低相对分子质量标准蛋白购于日本Takara公司;阴离子亲和层析QSFF和DEAE-52柱料:购于美国GE Healthcare公司;薄层层析Gel Plate:购于德国Merck产品;其他试剂均为国产分析纯。
LRH-恒温恒湿培养箱:广东省医疗器械厂产品;HZQ-F160全温振荡培养箱:太仓实验设备厂产品;TU-1900PC紫外可见分光光度计:北京普析通用仪器设备有限责任公司产品;Power Pac BasicTM型电泳仪 BIO-RAD、GL-20B高速冷冻离心机:上海安亭科学仪器厂产品;PB21型pH计:德国赛多利斯公司产品;ÄKTA蛋白纯化系统 美国GE Healthcare公司产品;立式圆形压力灭菌锅:上海医用核子仪器厂产品;JJT-900型洁净工作台:北京半导体设备一厂产品;DK-S24电热恒温水浴锅:上海精宏实验设备有限公司产品;恒温水浴摇床:金坛市荣华仪器公司产品;Agilent 1260 InfinityⅡ型高效液相色谱仪、G7162A型示差折光检测器:美国Agilent公司产品;Shodex Sugar KS-802色谱柱:日本Shodex公司产品。
1.2 泡盛曲霉β-1,3-1,4-葡聚糖酶的纯化
将泡盛曲霉液体发酵粗酶液[18]置于冰水浴中,缓慢搅拌,同时缓慢加入硫酸铵干粉,至粗酶液硫酸铵饱和度达到质量分数60%,继续搅拌30 min后,10 000g离心10 min收集上清液。向上清液中继续加入硫酸铵,至硫酸铵饱和度至质量分数80%,10 000g离心10 min收集沉淀。将沉淀用20 mmol/L pH 7.0磷酸缓冲液溶解,在相同缓冲体系中4℃透析4~5 h。将透析好的酶液上样于QSFF强阴离子交换柱 (20 mmol/L pH 7.0磷酸缓冲液平衡),流量为1.0 mL/min,用0~500 mmol/L的NaCl溶液洗脱,收集具有β-1,3-1,4-葡聚糖酶酶活性组分。收集部分于20 mM pH 7.0 Tris-HCl缓冲液透析过夜,透析好的酶液上样于DE52弱阴离子交换柱(20 mmol/L pH 7.0 Tris-HCl缓冲液平衡), 用 0~500 mmol/L的NaCl溶液线性洗脱,流量为1.0 mL/min,收集有活性的组分,最后通过SDS-PAGE检测纯化蛋白质的纯度。
1.3 β-1,3-1,4-葡聚糖酶活力及蛋白质浓度的测定
β-1,3-1,4-葡聚糖酶酶活力测定参照Yang等[11]的方法:添加50 μL质量分数1%的大麦β-葡聚糖于小试管中,55℃预热3 min,然后加入150 μL用50 mmol/L乙酸-乙酸钠 (Acetate)缓冲液(pH 5.0)适当稀释的酶液,55℃反应10 min后加入200 μLDNS试剂,煮沸15 min后加入200 μL质量分数40%酒石酸钾钠溶液,冷却后于540 nm波长下测定吸光值,以葡萄糖作为标准。β-1,3-1,4-葡聚糖酶酶活力单位(U)的定义为:在上述条件下每分钟水解大麦β-葡聚糖生成1 μmol葡萄糖所需要的酶量。
蛋白质浓度的测定按照Lowry法进行,以牛血清蛋白(BSA)作为标准蛋白[20]。
1.4 SDS-PAGE、β-1,3-1,4-葡聚糖酶酶谱和相对分子质量测定
SDS-PAGE电泳按照Laemmli[21]的方法进行。分离胶质量浓度为12.5 g/dL,浓缩胶质量浓度为4.5 g/dL,电泳结束后用考马斯亮蓝R-250染色。β-1,3-1,4-葡聚糖酶酶谱参照 Yang等[13]的方法。
β-1,3-1,4-葡聚糖酶变性和活性状态下的相对分子质量分别采用SDS-PAGE和Sephacryl S-100 HR凝胶过滤层析法测定。SDS-PAGE测定方法:以标准蛋白相对分子质量的对数值为纵坐标,迁移率为横坐标,根据目标蛋白的迁移率计算出目标蛋白的相对分子质量。Sephacryl S-100 HR凝胶层析测定:葡聚糖酶活性状态下的相对分子质量采用S-100凝胶过滤法测定。凝胶柱预先用乙酸-乙酸钠缓冲液(20 mmol/L,pH 5.0,0.15 mol/L NaCl)平衡,分别将2 mg/mL的标准蛋白和目标蛋白以0.33 mL/min的流量过凝胶柱,以洗脱体积Ve为横坐标,标准蛋白分别是:细胞色素 C(12.4×103),胰凝乳蛋白酶原(25.6×103),鸡卵清蛋白(44.3×103),牛血清白蛋白(66.5×103),磷酸酶 B(97.2×103)。
1.5 β-1,3-1,4-葡聚糖酶的最适pH和最适温度
β-1,3-1,4-葡聚糖酶最适pH的测定:采用50 mmol/L pH 2.0-11.0范围内的不同缓冲液配制质量分数1%大麦葡聚糖底物,然后在55℃下按标准方法测定 β-1,3-1,4-葡聚糖酶酶活,以最大值为100%,分别计算各pH条件下的相对酶活。缓冲体系包括:Glycine-HCl (pH 2.0~4.0)、Mcllvaine(pH 3.0~7.0)、Acetate (pH 4.0~6.0)、Na2HPO4-NaH2PO4(pH 6.0~8.0)、CHES(pH 8.0~10.0)、CAPS(pH 10.0~11.0)。
β-1,3-1,4-葡聚糖酶最适温度的测定:采用50 mmol/L pH 5.0的乙酸-乙酸钠缓冲液配制质量分数1%大麦葡聚糖底物,在30~80℃范围内测定β-1,3-1,4-葡聚糖酶酶活力,以最大值 100%,分别计算各温度下的相对酶活。
1.6 β-1,3-1,4-葡聚糖酶的底物特异性
用50 mmol/L pH 5.0乙酸-乙酸钠缓冲液配制不同的聚糖底物(质量分数%)。于55℃下参照标准方法测定酶活力,以葡聚糖酶对大麦葡聚糖的酶活力为100%,分别计算葡聚糖酶对各种底物的比酶活力和相对酶活力。聚糖底物包括:大麦葡聚糖、燕麦葡聚糖、地衣多糖、可得然胶、昆布多糖、CMC、榉木木聚糖、槐豆胶、壳聚糖。另人工合成糖苷类底物pNP-glycosides:pNP-β -xylopyranoside,pNP-β -glucopyranoside,pNP-β-galactopyranoside 和 pNP-β-cellobioside用50 mmol/L pH 5.0乙酸-乙酸钠缓冲液配制成5 mmol/L浓度的底物,55℃反应10 min,测定410 nm处的吸光值。酶活力(U)定义为,在上述反应条件下每分钟水解底物释放1 μmol pNP所需要的酶量。
1.7 β-1,3-1,4-葡聚糖酶的水解特性
最适缓冲体系下,底物质量分数为1%的大麦葡聚糖,加酶量为10 U/mL,50℃水浴反应,间隔一定时间取样,沸水5 min灭活,之后采用薄层层析法(TLC)分析水解产物。
薄层层析法:硅胶板 Merck Slica Gel 254,展层液为V(正丁醇)∶V(乙酸)∶V(水)=2∶1∶1 系统,样品点样后将硅胶板用展层剂展开两次,吹干后在其表面均匀用V(硫酸)∶V(甲醇)=5∶95 溶液浸湿,最后在150℃烘箱中烘烤3 min显色。以葡萄糖及纤维寡糖(DP 2-4)的混合物为标准。
1.8 AaBglu29酶解燕麦麸皮制备葡寡糖
燕麦麸皮中β-1,3-1,4葡聚糖含量的测定参照Megazyme Mixed-linkage β-glucan含量测定试剂盒。燕麦麸皮内源酶灭活参照Zhang等[10]的方法。以下所提到的燕麦麸皮均为内源酶失活燕麦麸皮。
取40目燕麦麸皮2 g,加50 mL乙酸-乙酸钠缓冲液(50 mmol/L pH 5.0),加酶 200 U/g 底物,于50℃酶解8 h后,煮沸10 min终止酶解反应,10 000 g离心10 min后取上清液过0.45 μm滤膜备TLC和HPLC分析。
按照如下顺序依次优化产糖条件:固液质量体积比:1 g∶15 mL~1 g∶30 mL;酶解温度:45~60 ℃;加酶量:50~150 U/g;酶解时间:0~8 h 间于不同时间取样。TLC分析同1.7。HPLC分析:Agilent高效液相,RID检测器,色谱条件:色谱柱为Shodex KS-802,流动相:水,流量:0.8 mL/min,柱温:65 ℃,运行时间:20 min。
β-葡寡糖得率:YGOS=CG2-G4×V/2000×8.9%×100%式中:CG2-G4为酶解上清液二糖~四糖的质量浓度,mg/mL;V为酶解完成后离心上清液体积,mL;2 000为燕麦麸皮质量,8.9%为本实验燕麦麸皮中的β-1,3-1,4 葡聚糖质量分数。
2 结 果
2.1 β-1,3-1,4-葡聚糖酶的纯化
粗酶液经硫酸铵沉淀、QSFF强阴离子柱和DEAE-52弱阴离子柱3步交换层析纯化后得到电泳级纯酶(AaBglu29)(图1)。纯化过程中酶活力回收率为13.9%,纯化倍数为6.6,比酶活由1 432 U/mg提高到9 500 U/mg(表1)。SDS-PAGE法测定的酶相对分子质量为30.7×103,Sephacryl-100凝胶层析方法测定的酶相对分子质量为27.6×103,表明该酶为单亚基蛋白。
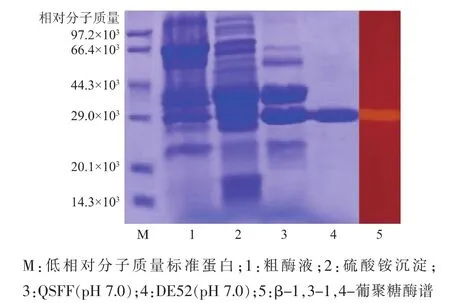
图 1 泡盛曲霉 β-1,3-1,4-葡聚糖酶(AaBglu29)的纯化电泳图Fig.1 Purification of the β -1,3-1,4-glucanase from Aspergillus awamori
2.2 β-1,3-1,4-葡聚糖酶的最适pH和最适温度
在不同pH下测定酶活力,AaBglu29的最适pH为5.0,在pH 3-8之间时,酶活力残留50%以上(图2a)。AaBglu29的最适温度为55℃,当反应温度为30-65 ℃时,β-1,3-1,4-葡聚糖酶残余酶活力在50%以上(图 2(b))。
2.3 β-1,3-1,4-葡聚糖酶的底物特异性
如表2所示,AaBglu29对大麦葡聚糖的比酶活力最高(9 500 U/mg),其次是燕麦葡聚糖(7 950 U/mg),最后是地衣多糖(5 180 U/mg)。 该酶对 CMC、榉木木聚糖、可得然胶、昆布多糖、槐豆胶、壳聚糖和人工合成糖苷底物均没有表现出活性,说明该酶底物特异性专一。
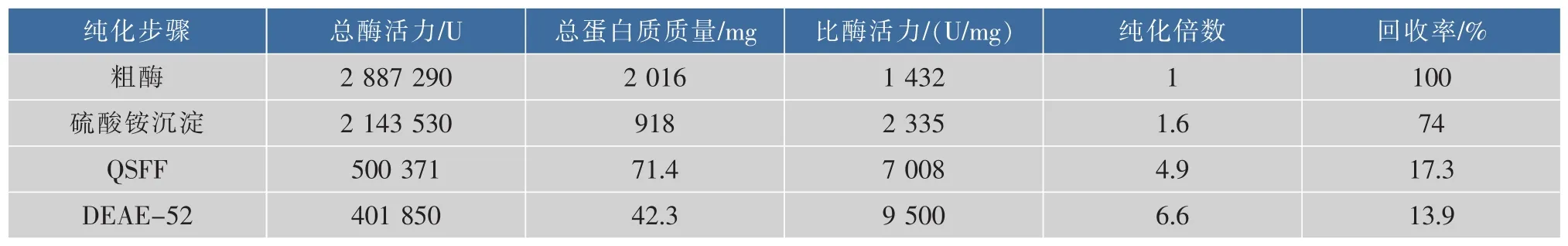
表1 泡盛曲霉β-1,3-1,4-葡聚糖酶(AaBglu29)的纯化表Table 1 Purification of the β-1,3-1,4-glucanase from Aspergillus awamori
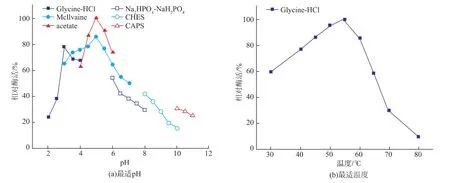
图2 AaBglu29的最适pH和最适温度Fig.2 Optimal pH and temperature of AaBglu29
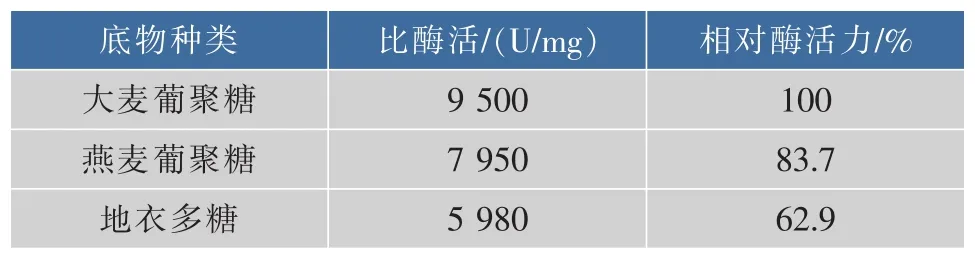
表2 泡盛曲霉AaBglu29底物特异性Table 2 Substrate specificity of the purified AaBglu29
2.4 β-1,3-1,4-葡聚糖酶的水解特性
AaBglu29水解大麦葡聚糖的前期产物是聚合度5以上的葡寡糖和少量的葡三糖,随着水解时间的延长,聚合度5以上的葡寡糖转化为葡三糖和葡四糖,最终水解产物主要是葡三糖和葡四糖(图3)。
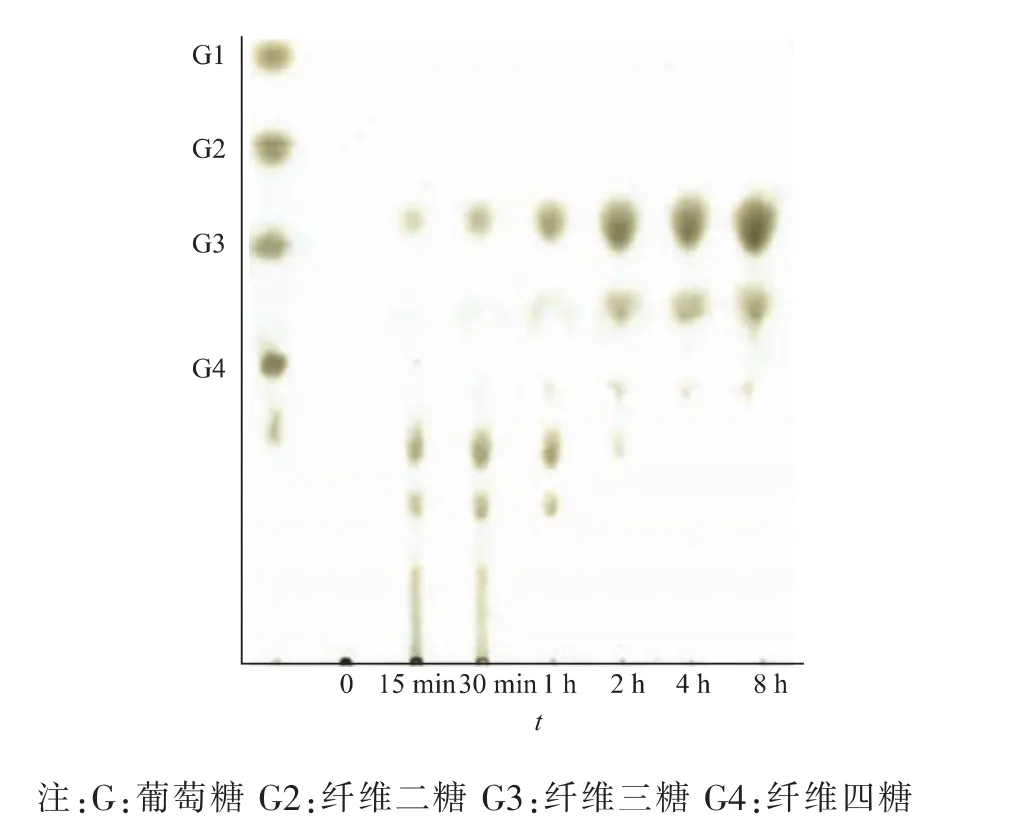
图3 AaBglu29水解大麦葡聚糖TLC图Fig.3 TLC analysis of the hydrolytic products of barley β-glucan by AaBglu29
2.5 AaBglu29水解燕麦麸皮制备葡寡糖
燕麦麸皮中通常含有质量分数5.5%~9.0%的β-1,3-1,4-葡聚糖,但不同地区产地的含量略有差异。燕麦麸皮含有质量分数8.7%的β-1,3-1,4-葡聚糖,经内源酶灭活预处理后,其β-1,3-1,4-葡聚糖质量分数为8.9%。
内源酶失活前后的燕麦麸皮经β-1,3-1,4-葡聚糖酶水解8 h后,水解产物均主要为葡三糖和葡四糖,但葡寡糖转化率有较大差别,水解燕麦麸皮葡寡糖转化率为70%,水解内源酶失活后的燕麦麸皮葡寡糖转化率达90%。故以下所提到的燕麦麸皮均为内源酶失活燕麦麸皮。
首先考察不同燕麦麸皮底物质量浓度对制备葡寡糖的影响(图 4(a))。固液质量体积比为 1 g∶15 mL时,葡寡糖转化率为80%,提高固液质量体积比至 1 g∶20 mL 时,葡寡糖转化率(90%)达到最高,再提高固液质量体积比对葡寡糖转化率影响不大。其次研究水解温度对制备葡寡糖的影响(图4(b))。水解温度为50℃时,葡寡糖转化率最高,水解温度高于55℃,葡寡糖转化率则出现明显下降。加酶量对制备葡寡糖的影响如图4(c)所示。加酶量为50 U/g底物时,葡寡糖转化率为75%,提高至100 U/g底物时,葡寡糖转化率为90%,再提高加酶量,则对葡寡糖转化率影响不大。
在最优水解条件基础上,考察了AaBglu29水解燕麦麸皮制备葡寡糖的水解历程(图5)。随着水解时间的增加,葡三糖和葡四糖得率不断提高,当酶解时间为4 h时,葡寡糖转化率达到最高(90%),此时葡三糖和葡四糖的得率分别为53.3%和33.8%。酶解时间继续增至8 h时,葡寡糖转化率不再变化。
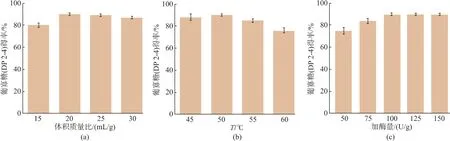
图4 AaBglu29酶解燕麦麸皮制备葡寡糖条件优化Fig.4 Optimization of conditions for production of glucooligosaccharides from oat bran by AaBglu29
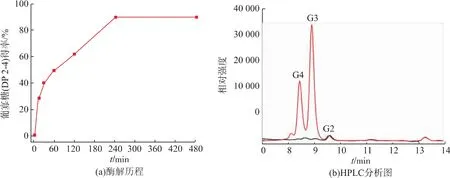
图5 AaBglu29酶解燕麦麸皮产葡寡糖酶解历程及HPLC分析图Fig.5 Time course profile of glucooligosaccharides production from oat bran by AaBglu29
3 讨 论
β-1,3-1,4-葡聚糖酶在食品和饲料等领域具有广泛的应用并受到很多研究者的关注[5]。目前,已经有很多细菌β-1,3-1,4-葡聚糖酶的纯化和性质报道,但真菌 β-1,3-1,4-葡聚糖酶报道较少[5]。 作者从泡盛曲霉液体发酵液中分离纯化出一个酸性β-1,3-1,4-葡聚糖酶(AaBglu29),并对其酶学性质和应用进行了研究。
粗酶液经3步纯化得到电泳级纯酶,比酶活(9 500 U/mg) 高于绝大多数微生物 β-1,3-1,4-葡聚糖酶,如来源于枯草芽孢杆菌(Bacillus subtilisLC-9,3 502 U/mg)[8]、 甲基营养 型芽 孢杆 菌(Bacillus methylotrophicus363.55 U/mg)[22]、巴伦葛兹类芽孢杆菌(Paenibacillus barengoltzii431 U/mg)[10]、碎囊毛霉 (Mucor petrsularis225.02 U/mg)[16]、 樟绒枝 霉(Malbranchea cinnamomea52.7 U/mg)[13]和嗜热拟青霉(Paecilomyces thermophila6 241.6 U/mg)[11]的 β-1,3-1,4-葡聚糖酶,但低于黑曲霉(Aspergillus niger12 450.6 U/mg)[14], 嗜 热 子 囊 菌 (Thermoascus aurantiascus13 527 U/mg)[23]和米黑根毛霉(Rhizomucor miehei28 818 U/mg)[12]的 β-1,3-1,4-葡聚糖酶。AaBglu29的相对分子质量为29×103,低于多数真菌 β-1,3-1,4-葡聚糖酶,如:嗜热拟青霉(38.6×103)[11]、米黑根毛霉(35.4×103)[12]、樟绒枝霉(44.7×103)[13]和黑曲霉 (52×103)[14]来源的β-1,3-1,4-葡聚糖酶,但高于碎囊毛霉(17.2×103)的 β-1,3-1,4-葡聚糖酶[16]。
一般说来,酸性和耐热性的β-1,3-1,4-葡聚糖酶更加适合应用于啤酒酿造和饲料加工工业中[5]。但已报道的β-1,3-1,4-葡聚糖酶的最适pH大多处在中性范围内 (pH 6.5~7.5),如碎囊毛霉(pH 6.0)[16]、嗜热子囊菌(pH 6.0)[23]、枯草芽孢杆菌(pH 6.5)[8]、嗜热拟青霉(pH 7.0)[11]和甲基营养型芽孢杆菌(7.5)[22]的 β-1,3-1,4-葡聚糖酶,均高于本研究的 AaBglu29(pH 5.0)。 另外,樟绒枝霉 β-1,3-1,4-葡聚糖酶的最适pH为10.0,是目前真菌来源报道中最为耐碱的β-1,3-1,4-葡聚糖酶[13]。AaBglu29的最适温度为55℃,高于碎囊毛霉(40℃)[16]和枯草芽孢杆菌(45 ℃)[8]的 β-1,3-1,4-葡聚糖酶,与樟绒枝霉[13]、甲基营养型芽孢杆菌[22]和巴伦葛兹类芽孢杆菌[10]的 β-1,3-1,4-葡聚糖酶(55 ℃)相同,但低于少数嗜热真菌的β-1,3-1,4-葡聚糖酶 (嗜热拟青霉 70 ℃和嗜热子囊菌 75 ℃)[11,23]。AaBglu29 对β-1,3-1,4-葡聚糖表现出严格的底物专一性,与嗜热拟青霉[11]、樟绒枝霉[13]、碎囊毛霉[16]和枯草芽孢杆菌[8]的β-1,3-1,4-葡聚糖酶是相似的。但也有一些β-1,3-1,4-葡聚糖酶表现出较宽泛的底物特异性,如米黑根毛霉的β-1,3-1,4-葡聚糖酶不仅对β-1,3-1,4-葡聚糖表现出活力,还对昆布多糖 (β-1,3-葡聚糖)表现出较高酶活力[12]。黑曲霉和甲基营养型芽孢杆菌的β-1,3-1,4-葡聚糖酶不仅对β-1,3-1,4-葡聚糖表现酶活力,还对羧甲基纤维素钠(β-1,4-葡聚糖)呈现酶活力[14,22]。 AaBglu29 水解大麦葡聚糖的产物为葡三糖和葡四糖,与樟绒枝霉[13]、米黑根毛霉[12]和枯草芽孢杆菌[8]的 β-1,3-1,4-葡聚糖酶相似,但与嗜热拟青霉(葡二糖和葡三糖)[11]和嗜热子囊菌(葡二糖和葡三糖)[23]的 β-1,3-1,4-葡聚糖酶不同。综合比较而言,AaBglu29在食品和饲料领域具有很大的工业应用潜力。
燕麦麸皮作为一种β-1,3-1,4-葡聚糖含量丰富的农业废弃物,其利用价值较大。目前国内外研究大多集中于寻找从中提取β-1,3-1,4-葡聚糖的廉价、高效且环保的方法[23]。但随着β-葡寡糖越来越多的功能活性报道[2-4],利用燕麦麸皮制备葡寡糖的研究受到一些研究者的关注。如:Zhang等[10]利用巴伦葛兹类芽孢杆菌β-1,3-1,4-葡聚糖酶水解燕麦麸皮制备以葡三糖和葡四糖为主的葡寡糖,转化率为77.2%。 Yan等[23]利用嗜热子囊菌β-1,3-1,4-葡聚糖酶水解燕麦麸皮制备以葡二糖、葡三糖和葡四糖为主的葡寡糖,转化率为47.1%。作者利用AaBglu29水解燕麦麸皮制备葡寡糖,经优化β-1,3-1,4-葡聚糖转化率达90%,终产物为葡三糖和葡四糖。因此,AaBglu29在制备葡寡糖工业中具有较大的应用潜力。
4 结 语
泡盛曲霉液体发酵液经硫酸铵沉淀和两步阴离子交换层析纯化后,可得到一个比酶活为9 500 U/mg 的 β-1,3-1,4-葡聚糖酶(AaBglu29)。该酶最适pH和最适温度分别为5.0和55℃,其底物特异性专一,高效水解燕麦麸皮90%的β-1,3-1,4-葡聚糖转化为葡寡糖。该酶优良的酶学性质说明其工业应用潜力较大。
