壳聚糖酶的基因克隆表达及酶学性质研究
2019-03-14刘进宝孙慧慧孙建安毛相朝
王 琦, 崔 阳,刘进宝,孙慧慧, 郭 娜, 孙建安,毛相朝*,3
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;3.青岛海洋科学与技术国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237)
壳聚糖是一种阳离子碱性多糖,由D-氨基葡萄糖(葡萄糖胺)通过β-1,4糖苷键连接而成,是甲壳素部分或完全脱去乙酰基后得到的产物。当甲壳素脱乙酰度(degree of deacetylation,DD)大于 55%时则为壳聚糖[1]。作为阳离子多糖,壳聚糖具有抑菌杀菌、降低胆固醇、预防高血压以及吸附重金属的重要机能。
尽管壳聚糖具有重要的生物活性,但溶解度低,不能溶于水和有机溶剂等缺点限制了其在食品、药品、化工制品中的应用。而壳聚糖的水解产物壳寡糖[2]由于分子链长较短和D-氨基葡萄糖中游离的氨基而具有很好的水溶性,得以更为广泛地应用于食品[3]、农业、生物医药[4]等领域。在食品行业中,壳寡糖是一种良好的天然防腐剂,安全且无毒副作用[5],壳寡糖还可用作天然保鲜剂,可保持食品中的水分,并促进矿物质的吸收[6]。农业上,壳寡糖可用作生物农药发挥抗虫害作用以提高植物抗病性,加速植株生长发育。在生物医药领域,具有潜在的医学应用价值[7]。壳寡糖还能够保护人体胚胎干细胞的氧化应激反应,并有效抑制脯氨酰肽链内切酶活性[8]。
壳聚糖酶可水解壳聚糖产生壳寡糖,是一种专一性作用于糖苷键,降解壳聚糖的水解酶[9-10]。与非专一性酶相比,壳聚糖酶水解壳聚糖所需酶量较少,水解更彻底,产物活性更高,反应速度快,产物更单一,易于控制条件得到特定相对分子质量的产品[11]。壳聚糖酶最适反应温度为30~70℃,反应的最适 pH 为 4~8,等电点在 4.0~10.1 之间[12]。
壳聚糖酶按照不同的分类方式可分为不同类型。按氨基酸序列来划分,壳聚糖酶共分为2、5、8、46、75、80 6个糖苷水解酶家族,且以46族[13-15]最多。按作用机制来划分,壳聚糖酶分为内切型和外切型,内切型壳聚糖酶在糖链上随机切割,产生聚合度不同且以低聚物为主的寡糖混合物,大多壳聚糖酶为内切型。而外切型壳聚糖酶从糖链的非还原端进行切割,依次切下单体,得到单一产物。按水解方式划分,壳聚糖酶分为专一水解壳聚糖的酶和可水解壳聚糖和羧甲基纤维素两种物质的酶[16]。虽然多种微生物可产生壳聚糖酶,但酶活性低,成分复杂难以分离纯化,较高的成本限制了壳聚糖酶的生产[17]。作者通过克隆表达得到的酶与其它壳聚糖酶不完全相同,是一种较为新型的壳聚糖酶,且酶活较高,易于分离纯化。
近些年,由NCBI数据库进行基因挖掘已成为一种高效、便捷、筛选得到目的产物的重要方法得到广泛应用。作者通过基因挖掘由NCBI数据库检索到来源于Butyrivibriosp.MC2013的壳聚糖酶基因,并尝试对基因进行克隆,与表达载体连接构建重组质粒,转入E.coliBL21(DE3)表达宿主进行表达。然后研究重组壳聚糖酶的酶学性质和水解产物,为其工业制备和应用提供理论依据[18]。
1 材料与方法
1.1 主要材料
BamH I和HindIII等限制性内切酶及T4DNA连接酶:Thermo Fisher Scientific公司产品;感受态细胞E.coliDH5α、E.coliBL21(DE3):北京天根生化科技公司产品;壳聚糖:Solarbio公司产品;壳寡糖样品(聚合度1-6):青岛博智汇力生物科技有限公司产品;琼脂糖:Invitrogen公司产品;核酸染料Redsafe:iNtRON公司产品;蛋白胨、酵母粉、琼脂粉:Oxiod公司产品;其他试剂等均为国产分析纯。
1.2 仪器与设备
WD-9405B型水平摇床:北京市六一仪器厂产品;HH-3A水浴锅:常州智博瑞仪仪器制造有限公司产品;TGL16离心机:长沙英泰仪器有限公司产品;高速离心机:Sigma公司产品;PCR仪:Eppendorf公司产品;DYY-6C型电泳仪:北京市六一仪器厂产品;凝胶成像仪:上海培清科技有限公司产品;酶标仪:基因有限公司产品;JY92-IIN超声波细胞破碎仪:宁波新芝生物科技公司产品;恒温培养箱:上海喆图科学仪器公司产品;Haier生物冰箱:青岛海尔产品;DW-86L386立式超低温保存箱:青岛海尔特种电器产品;酶标仪:基因有限公司产品;JY92-IIN超声波细胞破碎仪:宁波新芝生物科技公司产品。
1.3 培养基
LB培养基:酵母提取物5 g/L,蛋白胨10 g/L,氯化钠10 g/L,琼脂粉15 g/L(固体培养基时加入),121℃灭菌20 min。
ZYP-5052培养基:25 mL体系中,23.2 mL (胰蛋白胨 10 g/L, 酵母提取物 5 g/L),50 μL MgSO4(1 mol/L),1.25 mL 20×P(1 mol/L 磷酸氢二钠;1 mol/L磷酸二氢钾;0.5 mol/L硫酸铵),高压灭菌后加入 0.5 mL 的母液(25 g/L 葡萄糖,100 g/L α-乳糖和体积分数25%的甘油)。
1.4 壳聚糖酶重组质粒构建
1.4.1 目的基因选取 从NCBI数据库中检索到Butyrivibriosp.MC2013菌种的基因序列中含有编码壳聚糖酶基因的序列 (Genbank序列号:WP_026508362)。密码子优化后,进行全基因序列合成。
1.4.2 引物设计 Primer premier设计PCR上游、下游引物,引物序列包含BamH I和HindIII的酶切位点。上游引物 BUT-F:5'CGGGATCCATG CGTAAAGAAAAAAAC3', 下游引物 BUT-R:5'CCCAAGCTTTTTAGCGATAGCTTTCAGT 3'。
1.4.3 BUT菌的目的片段扩增 以合成好的基因片段为模板进行PCR扩增。反应体系(50 μL)为:KOD 酶 1 μL,基因片段 DNA 1 μL,上下游引物各1 μL,dNTP 10 μL,2×buffer 25 μL,ddH2O 10 μL。PCR Touchdown程序为:95℃预变性5 min;95℃变性 20 s,65~50℃退火 (每 2次循环降低 1℃)20 s,72℃延伸60 s,循环30次;95℃变性5 min;95℃再变性 20 s,50 ℃退火 20 s,72 ℃延伸 60 s,15个循环;最终72℃延伸8 min。
1.4.4 核酸电泳及目的片段回收 制备10 g/L的琼脂糖凝胶,凝胶冷却凝固后将所有PCR产物注入凝胶孔中并于120 V电压下进行琼脂糖凝胶电泳。电泳结束后使用紫外投射仪观察条带结果,切下含有单一条带的胶条并称重记录,使用Omega公司的DNA胶回收试剂盒进行目的片段的回收,得到的产物于-20℃低温保存。
1.4.5 质粒 pET21a(+)的提取 将含 pET21a(+)的E.coli接种于LB培养基,37℃,培养8 h。质粒pET21a(+)的提取使用Omega公司的质粒提取试剂盒完成。
1.4.6 目的片段及载体的双酶切与回收 使用BamH I和HindIII双酶切目的片段及 pET21a(+),酶切体系(50 μL)为:BamH I和HindIII各 2.5 μL,DNA 25 μL,buffer 5 μL,ddH2O 15 μL。 在 37 ℃下酶切2 h。酶切完成后进行琼脂糖凝胶电泳,并以未酶切的空质粒作为对照,核酸电泳方法同1.4.4。酶切后的DNA片段在进行下一步连接前要进行纯化,使用Omega公司的DNA纯化试剂盒完成。
1.4.7 目的片段与载体的连接 连接反应总体系为10 μL,按酶切片段和酶切质粒摩尔浓度3∶1计算连接体系,加入样品和T4DNA连接酶后,放置16℃下进行过夜连接。
1.4.8 转化 10 μL的重组质粒与50 μL感受态细胞E.coliDH5α均匀混合,静置冰浴30 min,再于42℃热激2 min, 重复冰浴1~5 min, 加入900 μL LB液体培养基,37℃下培养45 min。将转化后的培养液5 000 r/min离心2 min,吸取弃去600 μL上清液,剩余部分均匀混合后吸取200 μL涂入含Amp抗性的LB平板,37℃静置培养12 h。
1.4.9 重组体的阳性克隆验证 挑取平板上的重组体单菌落,接种到含Amp抗性的LB液体培养基中,37℃摇床培养3~4 h后取出。培养结束后,进行PCR验证,体系为:重组体DNA 2 μL,上下游引物(T7 通用、T7ter通用) 各 1 μL,2×Taq 酶 12.5 μL,ddH2O 8.5 μL。琼脂糖凝胶电泳,以Marker作为标准参照对照条带大小以确定是否为阳性克隆,后将PCR验证成功的相应克隆子菌液送测序比对。
1.5 壳聚糖酶基因连接体培养
选择测序成功的阳性克隆子对应菌液,提取重组质粒转入表达宿主E.coliBL21内,方法同1.4.8。37℃过夜培养后,挑菌接种于LB试管,37℃摇床培养8~10 h,获得目的菌的菌液。取一部分菌液于体积分数20%甘油管中,-20℃低温保存。
1.6 壳聚糖酶重组蛋白的诱导表达
将构建好的重组pET-21a-BUT菌体接种至5 mL含Amp抗性 (1 000 μg/mL)的LB液体培养基中,菌体接种量为培养基液体体积的1%,置于37℃摇床内震荡培养12 h以活化菌种。按体积分数1%接种量接种活化菌种至ZYP-5052诱导培养基中,20℃,200 r/min诱导48 h。用含空载体的菌株,在相同条件下进行诱导表达作为空对照。
1.7 SDS-PAGE蛋白电泳
样品前处理:上样样品与蛋白上样缓冲液按体积比1∶1比例混合后,沸水处理10 min。煮沸后的样品与蛋白标准品各取15 μL注入胶孔内,调节电压为80 V使蛋白在浓缩胶中运动下移,当样品运动到分离胶后电压设定为120~150 V,当蛋白跑至胶底部时结束电泳,关闭电源后将胶取下依次进行染色、脱色,最后将胶样品放入凝胶成像仪拍照。
1.8 壳聚糖酶的纯化
ZYP-5052培养基诱导pET-21a-BUT表达后,收集菌液,8 000 r/min,4℃离心15 min,弃去上清,向菌体沉淀中加入10 mL pH为8的Tris-HCl缓冲液,超声波破碎处理40 min,在8 000 r/min、4℃条件下离心15 min收集破碎后获得的粗酶溶液。
采用镍离子亲和层析法纯化重组壳聚糖酶粗酶液。将粗酶液、水、体积分数20%的乙醇和各梯度洗脱液先进行过膜预处理。按照1 mL/min的速度将粗酶液加入Ni2+柱中,收集穿透峰,再用10 mmol/L的咪唑溶液洗去非特异性结合蛋白以平衡Ni2+柱。依次使用20~200 mmol/L的咪唑溶液 (溶于500 mmol/L NaCl、50 mmol/L的 pH 为 7.4的 Tris-HCl缓冲液中)进行洗脱,考马斯亮蓝G-250用于蛋白的检测,最后用500 mmol/L咪唑溶液将镍柱冲洗干净。收集的各梯度洗脱液后续进行SDS-PAGE蛋白电泳检测。
1.9 壳聚糖酶酶活测定
DNS方法用于确定重组酶的酶活性。壳聚糖酶将壳聚糖链上的糖苷键断裂,生成游离的还原糖,DNS与还原糖发生显色反应。底物:20 g/L壳聚糖醋酸溶液(醋酸溶液体积分数1%)。
反应体系:200 μL 壳聚糖底物,200 μL pH=8的Tris-HCl缓冲液,20 μL BUT酶液。45℃反应10 min。
壳聚糖酶酶活的定义:壳聚糖酶水解底物壳聚糖产生1 μmol还原糖所需要的酶量。比酶活是指1 mg酶蛋白具有的酶活。酶活计算公式(1),比酶活公式(2)如下[19]。

式中,Ct为实验组还原糖质量浓度,(mg/mL);C0为对照组还原糖质量浓度,(mg/mL);V0为反应体系体积,(mL);t为反应时间,min;0.18 为葡萄糖相对分子质量,(mg/μmol)。

式中,V1为反应体系中酶液体积,mL;Cp为酶蛋白质量浓度,(mg/mL)。
1.10 壳聚糖酶BUT的最适反应温度和温度稳定性
选择30~80℃(每隔5℃设置一个梯度)作为反应的温度范围,并在标准条件下取等量的酶液,测定其在30~80℃相应温度下的酶活力。逐一比较各结果,根据确定最大酶活性所对应的温度即可确定壳聚糖酶的最佳反应温度。分别在上述温度下将等量酶溶液孵育3 h,然后加入底物和缓冲液在45℃条件下反应,以探究壳聚糖酶的温度稳定性。以上每个处理做3个平行。
1.11 壳聚糖酶BUT的最适反应pH和pH稳定性
选取pH 3~10为本反应的pH范围,其中包括柠檬酸缓冲液pH 3~6,磷酸缓冲液 pH 6~8,Tris-HCl缓冲液pH 8~9,甘氨酸-氢氧化钠缓冲液pH 9~10。等量酶液内添加上述缓冲液作为反应的pH值进行反应,绘制pH曲线。测定酶的pH稳定性,需取等量酶液分别置于上述不同pH值的缓冲液中,37℃水浴3 h。处理后的酶液再加入底物反应,绘制酶的pH稳定性曲线。以上每个处理做3个平行。
1.12 金属离子及化学试剂对壳聚糖酶BUT酶活的影响
将金属离子溶液和化学试剂溶液加入到酶液中,并在37℃下水浴3 h,加入底物和缓冲液,并保证最终反应体系离子浓度均为10 mmol/L。分别测定酶活。空白对照为不加任何离子溶液及化学试剂的酶液,相同条件37℃水浴3 h后加入到底物和缓冲液中反应,测定酶活。以上每个处理做3个平行。
1.13 TLC薄层层析水解产物分析
选用TLC法分析壳聚糖酶水解壳聚糖的产物。使用壳寡糖混合物(1-6糖,相对分子质量≤1 000)作为标准品,相同的壳聚糖酶反应体系置于相同温度下反应(45℃),依次选取反应时间为15、30 min,1、6、12、24 h 的反应液进行实验。 毛细管点样于硅胶板,并重复4次。于体积比为2∶1的异丙醇和氨水中进行展开,展开结束后吹风机吹干,置于显色剂为1 g/L的茚三酮乙醇溶液中进行染色,110℃下显色5 min,观察壳寡糖条带。
2 结果与分析
2.1 Butyrivibrio sp.中壳聚糖酶重组质粒pET-21a-BUT的构建及分析
从NCBI数据库中检索到Butyrivibriosp.MC2013菌种中编码壳聚糖酶的基因序列,对该基因进行大肠杆菌的密码子优化后全基因序列合成。PCR扩增后,使用BamH I和HindIII进行双酶切处理,T4 DNA快速连接酶连接过夜,后续转化以E.coliDH5α作为表达载体构建重组质粒pET-21a-BUT。图1为pET-21a-BUT的重组质粒图谱,重组质粒大小为6 327 bp,存在C末端的His-tag标签。阳性克隆验证电泳检测结果如图2,挑取的4个克隆子均呈现相同相对分子质量的单一条带,且条带大小与预期吻合,经测序证实转化成功,重组质粒转入E.coliBL21(DE3)表达宿主内进行表达。
重组壳聚糖酶BUT,Genbank序列号为:WP_026508362。经过NCBI数据库比对,BUT属于GH-46。通过进化树序列分析发现,BUT与其他GH-46家族的壳聚糖酶相似性最高为59%且从图3进化树分析可知,BUT没有相同分支,说明BUT是一种新型的壳聚糖酶。

图1 pET-21a-BUT重组质粒图谱Fig.1 pET-21a-BUT recombinant plasmid map

图2 阳性克隆验证电泳图Fig.2 Positive clone verification electropherogram
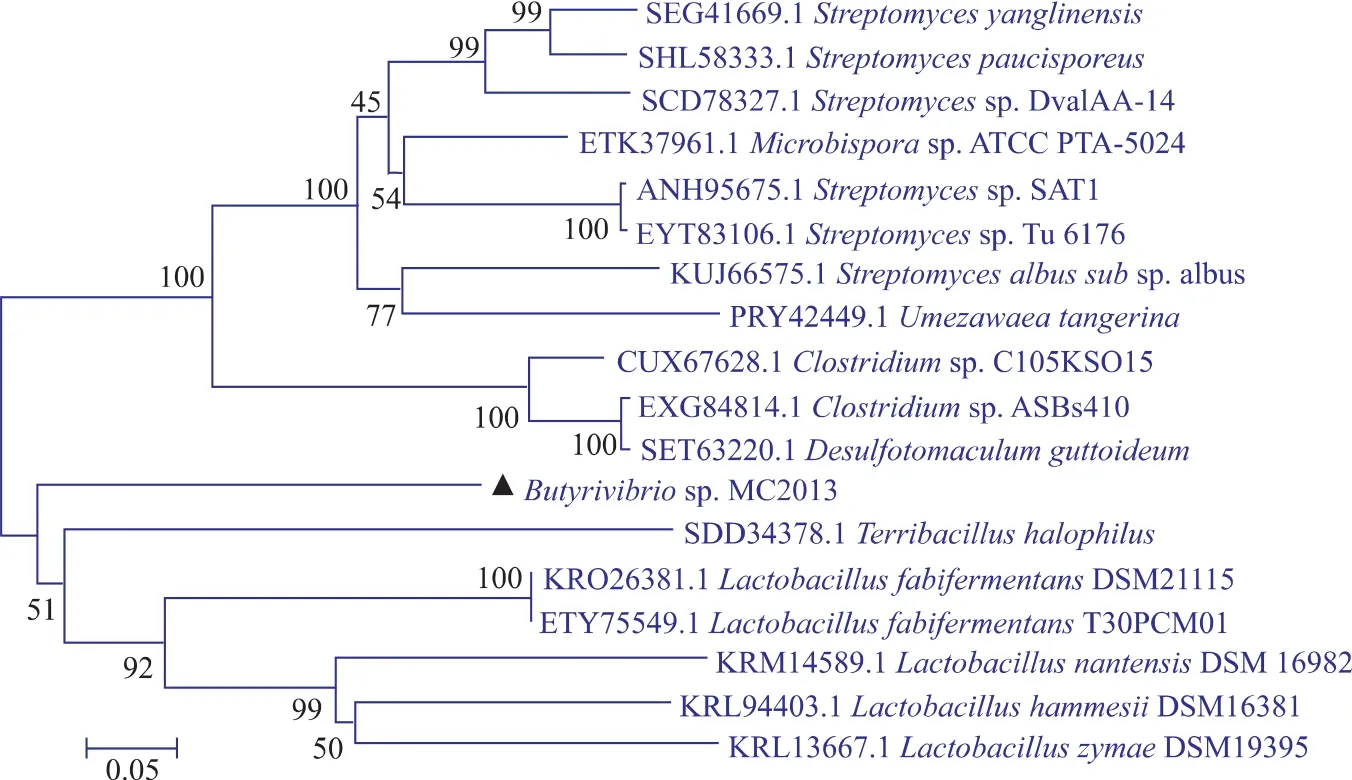
图3 BUT进化树分析Fig.3 BUT evolution tree analysis
2.2 壳聚糖酶BUT蛋白纯化
构建的表达菌株在自诱导培养基ZYP-5052诱导发酵48 h后,收集发酵液进行破碎离心,得到重组酶的粗酶液。经过纯化后获得单一目的蛋白,SDS-PAGE电泳结果如图4所示。150 mmol/L咪唑溶液洗脱出纯BUT酶蛋白,并呈现单一条带,经比对重组酶蛋白相对分子质量大小大约为3.5×104,与预期理论值相符。

图4 BUT蛋白纯化SDS-PAGE结果Fig.4 BUT protein purification SDS-PAGE results
2.3 壳聚糖酶BUT酶活测定
葡萄糖标准曲线:以0.1~1 g/L的不同浓度葡萄糖溶液代替200 μL反应上清液,制作标准曲线。如图 5所示,标准曲线方程:Y=0.949x-0.013,R2=0.997 73。
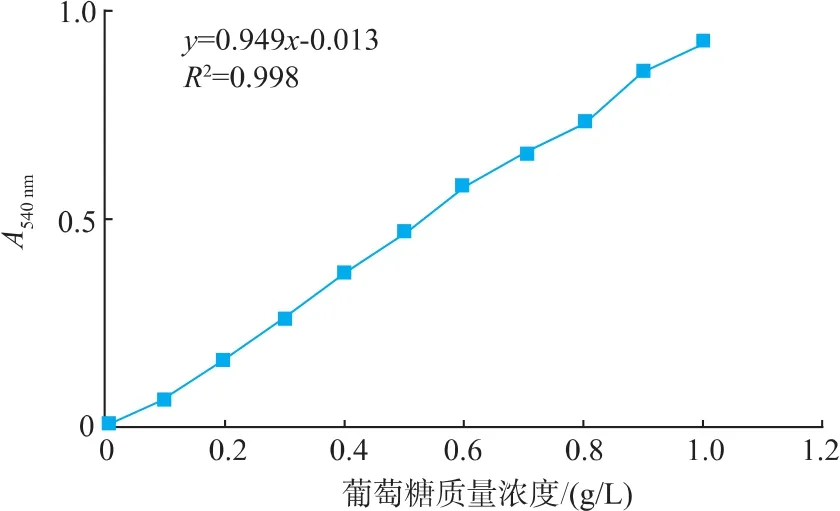
图5 葡萄糖标准曲线Fig.5 Glucose standard curve
酶活测定结果如表1所示,粗酶的比酶活为63.6 U/mg,纯酶为146.0 U/mg,纯化倍数为2.3倍。
2.4 壳聚糖酶BUT的最适反应温度和温度稳定性
在30~80℃范围内测定纯化后的重组壳聚糖酶相对酶活的温度梯度变化和温度稳定性。相对酶活以最高酶活为基准(100%),将其他梯度酶活进行换算,绘制温度曲线如图6(a),温度稳定性曲线如图 6(b)。 从图 6(a)的结果可以看出,壳聚糖酶最适反应温度为45℃,在30℃时相对酶活为45.7%。在30~45℃范围内,酶活逐渐增强至最大值。随后,随着温度升高,曲线持续下降,在80℃时相对酶活呈现极低状态,仅有10.8%。在40~50℃范围内,相对酶活力均在80%以上,在30~60℃范围内,相对酶活力保持在45%以上。酶的温度稳定性由图6(b)所示,30℃条件处理的酶活性最高,30~45℃范围内随温度升高,酶活呈下降趋势,但相对酶活都在88%以上,当温度达到50℃酶活急剧下降,随后50~80℃范围内,酶活持续下降,并维持在10%以下。说明此酶不宜在高于50℃条件下过久存放,在30~45℃范围内可稳定存在。
2.5 壳聚糖酶BUT的最适反应pH和pH稳定性
在pH 3.0~10.0范围下测定了重组壳聚糖酶的相对酶活的pH梯度变化和稳定性。从图7(a)可看出,壳聚糖酶的最适反应pH为8(Tris-HCl缓冲液)。在pH 3~6(柠檬酸盐缓冲液)范围内,相对酶活性较低,均低于40%。pH 6~9范围内,酶活都维持在77%以上。然而,具有相同pH值的不同类型的缓冲液对酶活会起到不同的影响。当pH为6时,柠檬酸缓冲液会明显抑制酶活,相对酶活为30%,而pH 6的磷酸缓冲液作用下相对酶活为88%。类似地,在pH 9的Tris-HCl缓冲液中相对酶活很低,仅为27%,而在同pH值的甘氨酸-氢氧化钠缓冲液中,酶活则高达80%。总体而言,重组酶的酶活性在酸性条件下较差,中性偏碱性条件下酶活较高。由图7(b)可看出,在 pH 为 8(Tris-HCl缓冲液)的条件下,重组酶不但酶活最高同时也最为稳定,说明此酶属于碱性壳聚糖酶,生产利用环节将环境pH控制在8时酶活最高最稳定。
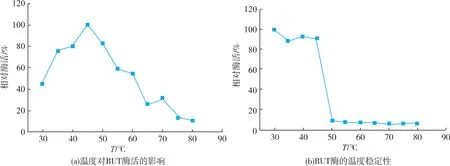
图6 温度对BUT酶活的影响及BUT酶的温度稳定性Fig.6 Effect of temperature on BUT enzyme activity and temperature stability of BUT enzyme
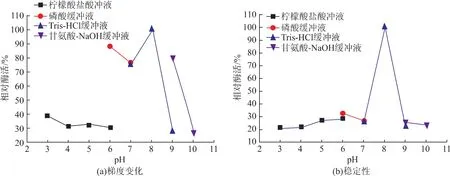
图7 pH对BUT酶活的影响及BUT酶的pH稳定性Fig.7 Effect of pH on BUT activity and PH stability of BUT enzyme
2.6 金属离子以及化学试剂对壳聚糖酶BUT酶活的影响
从图8可以看出,Mn2+增强了重组酶的酶活性,使其增加约6.7%。Ni2+处理后酶活仅有轻微抑制,变化不大。其他离子:Na+、K+、Ca2+、Mg2+、Fe3+、Co2+、Cu2+、Ba2+、Zn2+、以及化学试剂SDS和EDTA,抑制酶活性。 其中 SDS、Fe3+、Cu2+、Zn2+对酶活抑制作用显著,可使相对酶活抑制在10%以下。与Pseudomonassp.OUC1克隆表达的重组酶性质相似,Mn2+可促进酶活增强,Fe3+、Cu2+、Zn2+以及 SDS 和 EDTA 显著抑制酶的活性[19]。一般来说,金属离子不直接参与壳聚糖酶的催化过程,但会促进或抑制酶的活性,如Fe3+、Cu2+、Zn2+等金属离子通过共价配未键与酶的侧链基团连接,这种效应改变了蛋白质的构像并使酶失活。Mn2+可能在构建酶的活性中心方面有参与作用,进而影响酶解反应[20]。EDTA对重组酶有一定抑制作用表明,该重组酶属于金属酶,发挥作用时需要金属离子参与。在工业生产应用时应注意避免抑制性离子与酶接触,必要时可添加Mn2+提高酶活,弥补生产利用过程中出现的酶活损失。

图8 金属离子溶液及化学试剂对BUT酶活的影响Fig.8 Effect of metal ion solution and chemical reagent on BUT activity
2.7 壳聚糖酶BUT水解壳聚糖产物分析
作者使用壳聚糖(脱乙酰度>90%)为底物,壳寡糖混合物(1-6糖,相对分子质量≤1 000)作为标准品参照。相同的壳聚糖酶反应体系置于45℃条件下反应,图9反映了不同反应时间下的产物。由BUT壳聚糖酶水解底物壳聚糖后的产物主要是壳二糖、壳三糖和壳四糖[21]。到15 min时,产物以壳三糖和壳四糖为主,基本未产生壳二糖,反应6 h后壳二糖与壳三糖明显增多,且壳三糖占总水解产物的大部分。这与Streptomyces roseolusDH菌所产生壳聚糖酶水解产物相似,薄层层析结果显示产物同为壳二糖、壳三糖、壳四糖,且随时间延长三种产物变化趋势相同,都承上升状态[21]。观察到6、12、24 h的水解产物相似,表明壳聚糖已在6 h时水解彻底,最终水解产物为聚合度2-4的壳寡糖。

图9 BUT酶水解壳聚糖产物薄层层析分析Fig.9 Thin layer chromatography analysis of chitosan product hydrolyzed by BUT
3 结 语
壳寡糖由于相对分子质量小、溶解性强、以及多种药理功能,使其在保健品、食品、医药制品中有了更大的应用价值,因此,壳聚糖酶在壳寡糖生产及产业化利用中起到了重要作用。许多研究已将壳聚糖酶成功克隆表达,无论是产量还是生产速率上都有了明显提高。作者通过基因挖掘由NCBI数据库检索到来源于Butyrivibriosp.MC2013的壳聚糖酶基因,并尝试对基因进行克隆,与表达载体连接构建重组质粒,转入E.coliBL21(DE3)表达宿主进行表达,成功克隆表达了一个新型壳聚糖酶,经序列比对和进化树分析,此壳聚糖酶属于GH46。通过镍离子金属螯合亲和层析,获得蛋白质相对分子质量大小约为3.5×104的纯酶。测定了壳聚糖酶纯酶酶活为146.0 U/mg,纯化倍数为2.3。壳聚糖酶最适反应温度和pH分别为45℃、8.0(Tris-HCl缓冲液)。且在40~50℃温度范围下最稳定,保温3 h后相对酶活仍在80%以上,具有较好的热稳定性。Mn2+可促进酶活,SDS、Fe3+、Cu2+、Zn2+对酶活显著抑制,可使相对酶活抑制在10%以下。借助TLC进行分析酶解产物,结果显示壳聚糖酶6 h已完全水解,产物是聚合度为2~4的壳寡糖。壳聚糖酶酶学性质及水解机制对指导酶在生产应用有着重大的意义,研究酶的最适温度和pH有助于发挥酶的最大酶活,提高反应速率和降解产物产量,分析酶解产物有助于对重组酶性质的充分了解,因而为其在壳寡糖制备的工业化生产制备提供理论依据。
