江苏宿迁地区Hp感染及粪便基因检测克拉霉素耐药现状
2019-03-13刘伟王艳朱季军刘云云王玉欣王晓燕
刘伟 王艳 朱季军 刘云云 王玉欣 王晓燕

摘要:目的 了解江苏宿迁地区幽门螺杆菌(Hp)感染及对克拉霉素的耐药情况。方法 收集2016年10月~2017年10月在宿迁市第一人民医院行14C呼气试验检查的健康体检者的Hp检查结果,随机留取412例受检者的个人资料,并随机留取146例Hp感染者的粪便标本行粪便基因克拉霉素药敏试验,统计Hp感染率,比较相关因素对Hp感染的影响,初步了解Hp克拉霉素耐药情况。结果 共2919例纳入研究,1248例Hp阳性(42.75%),男性人群的Hp感染率为44.89%,高于女性的39.89%(P<0.05),20岁以下人群Hp阳性率最低(35.42%),21~40岁人群感染率最高(45.18%),40岁以上人群随年龄增大感染率有下降趋势,Hp感染与抽烟、饮酒、个人收入及空腹血糖值之间均无明显关系,146例Hp阳性的粪便标本中,137例可成功提取细菌基因组DNA,其中29个样本的PCR产物经BsaⅠ酶切出现两条目的条带,所有样本的PCR产物经MboⅡ酶切后均未被切开。结论 江苏宿迁地区Hp感染率为42.75%,男性人群及年龄在20~40岁感染率高,粪便基因药敏试验显示克拉霉素耐药率高于21.17%,这将为宿迁地区Hp感染防治提供更有力的依据。
关键词:幽门螺杆菌感染;宿迁地区;粪便基因检测;克拉霉素耐药
中图分类号:R378 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.02.026
文章编号:1006-1959(2019)02-0091-04
幽门螺杆菌(Helicobacter pylori,Hp)是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌的主要致病因素。流行病学研究表明,Hp是世界上感染率最高的细菌之一,尤其在发展中国家,严重威胁着人类健康[1]。在我国不同地区,Hp感染率不同,且各年龄阶段Hp感染率也不相同,详细了解各个地区Hp感染状况及易感因素,有助于该地区Hp感染及相关疾病的防治[2]。宿迁地区位于江苏北部,经济相对落后,有关该地区的Hp感染状况,尚无相关研究报道。Hp根除治疗方法较多,在中国大陆地区,含质子泵抑制剂(PPI)、克拉霉素、阿莫西林(或甲硝唑)的标准三联疗法常作为根除一线疗法,但随着Hp对克拉霉素及甲硝唑耐药率的逐年增加,标准三联的根除率在不断减低[3]。马斯特里赫特Ⅳ共识意见提出,当地区克拉霉素耐药率达到15%时,未经敏感性检测的含有PPI+克拉霉素的三联根除治疗方案应当被摒弃[4]。因此,了解一个地区的克拉霉素耐药情况对于指导Hp的根除治疗具有极其重要的意义。本研究中,我们统计了近1年来宿迁地区体检行14C呼气试验人群的Hp感染率和各种相关危险因素对Hp感染率的影响,并留取部分Hp感染者粪便标本行粪便基因克拉霉素耐药分析,进一步了解宿迁地区Hp感染及克拉霉素耐药情况,从而为临床医师根除Hp治疗提供有力的依据。
1资料与方法
1.1一般资料 纳入人群为2016年10月~2017年10月在宿迁市第一人民医院行14C呼气试验的健康体检者,所纳入者均为宿迁籍长期居住人员,受检前至少4周未服用抗生素、抑酸药或铋剂,排除有胃部手术史、孕妇及哺乳期妇女,共计2919例纳入研究,随机留取412例受检者个人资料,包括性别、年龄、抽烟饮酒情况、收入状况及空腹血糖值,并随机留取146例Hp感染者的粪便标本行粪便基因克拉霉素药敏试验。
1.2方法
1.2.1 14C呼气试验检测方法 使用安徽养和医疗器械设备公司生产的YH04E幽门螺旋杆菌检测仪和呼气卡,受检者至少空腹3 h以上,用温开水吞服14C-尿素胶囊后,静坐15 min后向呼气卡中吹气留取样本,卡上指示窗内颜色有蓝色变为白色时完成取样,将卡插入检测仪的进样口,14C-UBT≥100 dpm/mmol CO2时判定为Hp感染。
1.2.2粪便药敏试验方法 ①粪便细菌基因组DNA提取:称取180~220 mg冻存粪便标本,使用粪便DNA提取试剂盒(北京天根生化科技有限公司),按照操作步骤,提取粪便细菌基因组DNA,并通过Nano-Drop300(杭州奥盛仪器有限公司)检测DNA浓度及纯度,通过测定OD260/OD280比值估计DNA的纯度,OD260/OD280>1.8,说明DNA纯度较高,通过琼脂糖凝胶电泳检测提取DNA的完整性,凝胶电泳条带清晰说明无污染。②Hp 23s rRNA基因扩增:第一轮扩增引物为Hp 23s rRNA1835F:5'-GGTCTCAGCAAAGAGTCCCT-3',2327R:5'-CCCACCAAGCATTGTCCT-3',长度为493bp,第二轮扩增引物为Hp 23s rRNA 1942F:5'-AGGATGCGTCAGTCGCAAGAT-3',2308R:5'-CCTGTGGATAACACAGGCCAGT-3',长度为381bp。PCR反应体系包括:2x mix 15μl+MgCl2 1.2μl+上游引物(F)0.8μl+下游引物(R)0.8μl+模板1μl+灭菌H2O 11.2μl,反应体系中作为模板的基因组DNA浓度在5 μl/ml左右,引物浓度在10 nM。一轮扩增反应条件:95℃预变性2 min,94℃变性30 s,57℃退火30 s,72℃延伸30 s,5个循环,4℃变性15 s,57℃退火15 s,72℃延伸20 s,30个循环,4℃ 5 min。二轮扩增反应条件:95℃预变性2 min,94℃变性20 s,63℃退火20 s,72℃延伸20 s,28个循环,72℃延伸7 min,4℃ 5 min。反应结束后将PCR扩增产物取出,置于4℃冰箱保存备用。琼脂糖凝胶电泳成像检测PCR产物。③PCR产物酶切:使用限制性内切酶对PCR扩增产物进行特异性位点的酶切,BsaⅠ酶(2143)识别位点序列:5-GGTCTC(N)1,3-CCAGAG(N)5,酶切产物长度为208bp和173bp。MboⅡ酶(2142)识别位点序列:5-GAAGA(N)8,3-CTTCT9(N)5,酶切产物长度为191bp和190bp。酶切体系成分包括:10xBuffer 1.5μl+BsaⅠ/MboⅡ 0.5μl+PCR产物5μl+ddH2O 8μl,反应体系轻轻混匀置于37℃恒温水浴锅,孵育过夜,反应产物經2%琼脂糖凝胶电泳观察。④粪便基因组DNA测序验证:所有PCR扩增成功的样本中随机选取66个样本送上海生工测序,测序结果与酶切结果相互比较。
1.3观察指标 统计被纳入研究人群总的Hp感染率,包括不同性别、各年龄段、抽烟与否、饮酒与否、不同收入状态、不同空腹血糖值的Hp阳性率,并比较以上因素对Hp感染的影响。与克拉霉素耐药有关的23s rRNA V区本身不存在BsaⅠ、MboⅡ的酶切位点,若存在耐药突变2143位点上A→G突变、2142位点上A→G或A→C突变,则会出现相应酶切位点,产物会被酶切成不同的两条片段,观察成功提取细菌基因组DNA标本的酶切结果,初步评估Hp克拉霉素耐药情况。
1.4统计学方法 应用SPSS 16.0统计分析软件处理结果。计量资料以(x±s)表示,采用方差分析;计数资料以(%)表示,采用?字2检验或Fisher确切概率法,影响根除结果的相关因素分析采用单因素、多因素回归分析等方法,P<0.05认为差异有统计学意义。
2结果
2.1宿迁地区Hp感染现状 2919例健康体检者行14C呼气试验检查,年龄12~81岁,平均年龄(43.79±14.43)岁,Hp感染者共1248例(42.75%),其中男性751例(44.89%),感染率高于女性(?字2=7.300,P=0.007),见表1。
将所有受检者按年龄分组,分别为12~20岁组、21~40岁组、41~60岁组和60岁以上组,与12~20岁组相比,其余各组感染率差异无统计学意义(P>0.05),但Hp感染随年龄变化存在明显变化趋势,其中20岁以下人群感染率较低(35.42%),21~40岁人群感染率最高(45.18%),40岁以上人群随年龄增大Hp感染率有下降趋势,见表2。
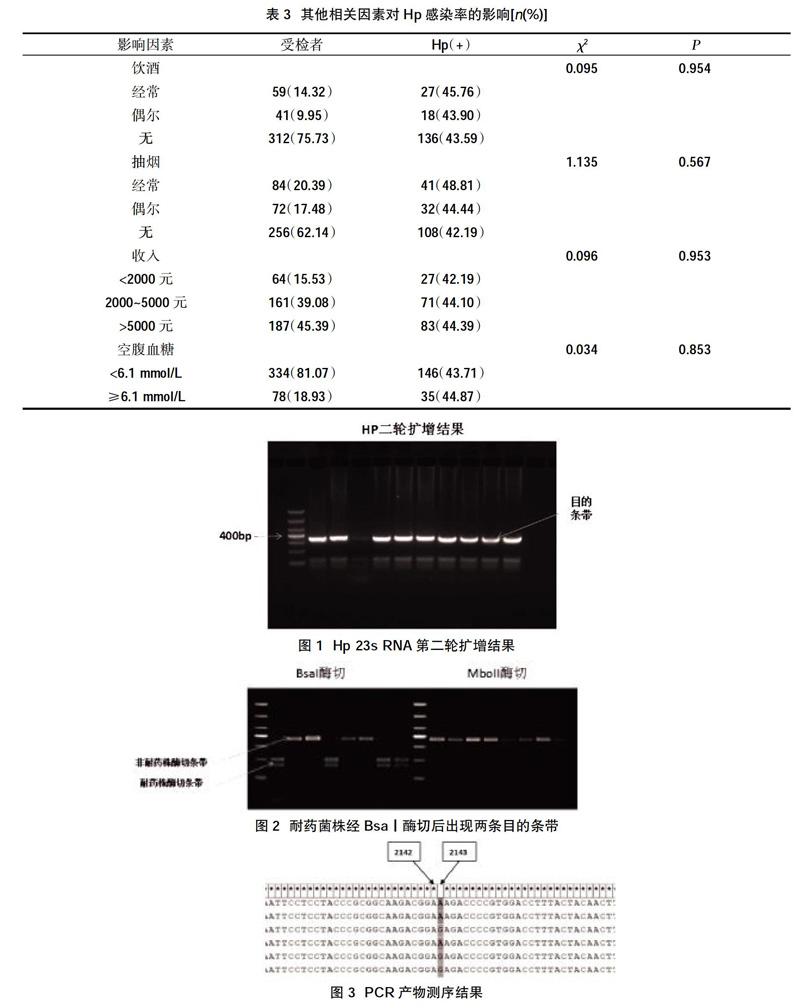
2.2 Hp感染的相关因素分析 将412例接受调查问卷的相关结果进行统计分析,发现Hp感染与抽烟、饮酒、个人收入及空腹血糖值之间均无明显关系(P>0.05),见表3。
2.3 Hp对克拉霉素耐药情况 146例粪便标本中有137例细菌基因组DNA提取正常,Hp 23s RNA第二轮扩增结果见图1,29例PCR产物经BsaⅠ酶切后出现两条目的条带,见图2。137例样本PCR产物经MboⅡ酶切后均未被切开。将137例成功提取DNA的标本随机抽取66例PCR产物送上海生工测序,测序结果与酶切结果一致,见图3。
3讨论
本研究显示,2016~2017年江苏宿迁地区Hp感染率为42.75%,2012~2013年江苏东台地区调查结果显示Hp感染率为44.3%[5],2013~2014年南京的一项健康人群Hp感染状况研究表明[6],南京地区Hp感染率为43.56%,本地区Hp感染率与江苏省其他地区大致相同。回顾2006年一项江苏苏中地区开展的Hp感染调查研究[7],结果显示Hp总感染率为62.07%,可见近年来江苏地区Hp感染率有大幅下降。结果显示男性人群Hp感染率高于女性,这与其他地区研究结果一致,2015年“京都全球共识”明确指出Hp感染为一种感染性疾病[8],通过口-口和粪-口途径在人与人之间传播,这可能是男性感染率较高的主要原因。
当年龄<20岁,Hp感染率较低,随着年龄增长,Hp感染率增加,本研究显示20~40岁人群Hp感染率最高,40岁以上随着年龄增长Hp感染率趋于稳定,并有所下降。李萌辉等统计了天津地区人群的Hp感染情况[9],发现其感染率随年龄增加呈增加趋势,50岁以上各年龄组间Hp感染分布无明显差异,趋于稳定。李华等分析了浙江杭州地区Hp感染情况[10],不同年龄段感染率统计中,50~59岁及60~69岁年龄组Hp感染率高于其他年龄段,<20岁人群Hp感染率较低。本研究中<20岁及60岁以上年龄组人群较少,无法更深层次体现20岁以下及60岁以上人群的Hp感染趋势。众多研究表明,Hp感染与家庭收入、饮食卫生、教育程度、家庭聚集、BMI、糖尿病等有关[11,12]。本研究中,我们分析了Hp感染与收入、抽烟、饮酒及空腹血糖值之间关系,差异均无统计学意义(P>0.05),考虑可能与本研究所纳入的样本量相对不足有关。因此,我们需要更大规模,年龄分布更平均的流行病学调查研究,从而更准确的反应各个年龄段之间Hp感染率的差异及Hp感染与其它因素之间的关系,给Hp防治提供更准确的指导。
目前抗菌药物的广泛耐药、Hp菌株毒力改变、CYP2C19基因多态性及患者依从性差等多种因素,是导致Hp根除治疗失败的主要原因[13],其中抗生素耐药是根除率下降的首要因素。现阶段虽然四环素、呋喃唑酮耐药率低,但临床难以获得,克拉霉素、阿莫西林、甲硝唑、左氧氟沙星仍然是根除Hp的主要抗生素。Hp 23s rRNA的V区基因的点突变(最常见的是A2143G,其次为A2142G及A2142C)可以降低克拉霉素的亲和力,导致抗生素耐药,临床上克拉霉素的耐药80%~90%是由基因的突变导致的[14]。本研究中我们仅分析了粪便基因組2143及2142位点的突变情况,共收集146例Hp感染者的粪便标本,其中137例标本粪便基因提取成功,具有较高的成功提取率,137例PCR产物中有29例可被BsaⅠ酶切,而无一例被MboⅡ酶,由此可推断宿迁地区粪便基因克拉霉素耐药率高于21.17%。Masstricht-4共识指出[4],在克拉霉素耐药率>15%的地区,根除Hp的一线方案首先推荐铋剂四联方案,本研究中宿迁地区克拉霉素耐药率>20%,因此,在宿迁地区我们应该摒弃标准三联疗法,而选择含铋剂的四联疗法作为首选根除方案。在进一步的研究中,我们也将根据粪便基因克拉霉素耐药结果指导临床Hp根除治疗。
参考文献:
[1]World Gastroenterology Organisation.World Gastroenterology Organisation GlobalGuideline: Helicobacter pylori in developing countries[J].J Clin Gastroenterol,2011(45):383-388.
[2]王雪,李异玲,吕晓辉.我国幽门螺杆菌感染的现状分析[J].胃肠病学和肝病学杂志,2017,26(6):640-643.
[3]中华医学会消化病学分会幽门螺杆菌科研协作组.第四次全国幽门螺杆菌感染若干问题共识报告(2012 江西)[J].中华消化杂志,2012,32(10):651-655.
[4]Malfertheiner Peter,Megraud Francis,O'Morain Colm A,et al.Management of Helicobacter pylori infection--the Maastricht IV/Florence Consensus Report[J].Gut,2012,61(5):646-664.
[5]孟亞平,何汝明.健康体检人群幽门螺杆菌感染状况分析[J].中国现代医生,2015,53(9):70-72.
[6]郑冬图,张荷,斯银平.2220例健康体检人群幽门螺杆菌感染状况分析[J].中国疗养医学,2015,24(2):180-181.
[7]徐顺福,施瑞华,张国新.江苏地区幽门螺杆菌感染及其危险因素调查[J].世界华人消化杂志,2006,14(35):3363-3370.
[8]Sugano K,Tack J,Kuipers EJ,et al.Kyoto global consensus report on Helicobacter pylori gastritis[J].Gut,2015,64(9):1353-1367.
[9]李萌辉,张弛,梁晓峰.11096例体检者幽门螺杆菌感染现状分析[J].天津医药,2016,44(1):110-113.
[10]李华,张忠夫,鲁任.杭州地区体检人群幽门螺杆菌感染的调查[J].中华医院感染学杂志,2016,26(9):2036-2037.
[11]Xu C,Yan M,Sun Y,et al.Prevalence of Helicobacter pylori infection and its relation with body mass index in a Chinese population[J].Helicobacter,2014,19(6):437-442.
[12]Zhou XY,Zhang CL,Wu JB,et al.Association between Helicobacter pylori infection and diabetes mellitus: a meta-analysis of observational studies[J].Diabetes Res Clin Pract,2013,99(2):200-208.
[13]Kim SY,Choi DJ,Chung JW.Antibiotic treatment for Helicobacter pylori: Is the end coming?[J].World J Gastrointest Pharmacol Ther,2015,6(4):183-198.
[14]Ghaith D,Elzahry M,Mostafa G,et al.Mutations affecting domain V of the 23S rRNA gene in Helicobacter pylori from Cairo, Egypt[J].J Chemother,2016(28):367-370.
收稿日期:2018-9-17;修回日期:2018-9-27
编辑/杨倩
