蒽环类抗生素致心脏毒性的研究进展
2019-03-13凌亚豪郑敏靳洪涛
凌亚豪,郑敏,靳洪涛
(1 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2 龙华区人民医院大浪社康中心,深圳 518109;3 中国医学科学院药物研究所新药安全评价研究中心,北京 100050;4 北京协和建昊医药技术开发有限责任公司,北京 100176)
1 前言
蒽环类抗生素(图1)是由链霉素菌属产生的具有抗肿瘤活性的化学物质。常见的蒽环类抗生素主要包括阿霉素(adriamycin,ADM)、表阿霉素(epirubicin,EPI)、柔红霉素(daunorubicin,DNR)、吡喃阿霉素(4'-0-tetrahydropyranyladriamycin,THP)、去甲氧柔红霉素(idarubicin,IDA)、阿克拉霉素(aclacinomycin,ACM)和米托蒽醌(mitoxantrone,MIT)等。蒽环类抗生素具有抗瘤谱广、抗瘤作用强、疗效高的特点,主要用于治疗血液系统恶性肿瘤和实体肿瘤,如急性白血病、淋巴瘤、乳腺癌等,但容易引起骨髓抑制和心脏毒性等不良反应。蒽环类抗生素的心脏毒性反应在早期表现不明显,一般呈进展性、不可逆性,严重时会导致病人死亡。因此早期监测和预防蒽环类抗生素所致心脏毒性具有重要意义[1]。近年来,国内外越来越多的学者与专家对蒽环类抗生素心脏毒性的特点、临床表现、机制和防治等问题进行研讨[2-3]。为了进一步规范蒽环类抗生素的合理应用,我国今年制定了最新的《中国蒽环类药物特性专家共识》[4]。目前关于蒽环类抗生素心脏毒性的机制尚未完全阐明。本文主要综述近年来蒽环类抗生素致心脏毒性机制的研究进展,为临床防治蒽环类抗生素致心脏毒性提供新的研究思路。
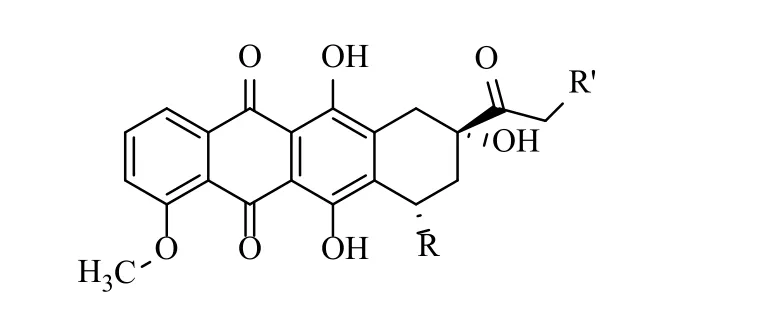
图1 蒽环类抗生素结构式
2 蒽环类抗生素心脏毒性的反应分类
蒽环类抗生素所致心脏毒性具有剂量依赖性。按照蒽环类抗生素导致的心脏毒性出现的时间不同,可以分为急性、慢性和迟发性3类[4]。
急性心脏毒性在给药后的几小时或几天内发生,常表现为心脏传导紊乱和心律失常,如心电图的改变等,极少数病例表现为心包炎和急性左心衰,一般是可逆的。慢性心脏毒性在用药后1年内发生,表现为左心室功能障碍,最终可导致心衰,病情呈进展性改变。迟发性心脏毒性在用药后数年发生,可表现为心衰、心肌病及心律失常等,病程不可逆。
3 蒽环类抗生素致心脏毒性的机制
3.1 氧化应激
氧化应激是蒽环类抗生素致心脏毒性的经典发病机制[5]。蒽环类抗生素具有亲心肌特性,其蒽醌基团在代谢过程中可循环生成大量活性氧类(reactive oxygen species,ROS)和活性氮类(reactive nitrogen species,RNS),而ROS或RNS可以在线粒体、肌浆网状细胞和细胞质中引起氧化还原反应,导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤等[6]。心肌细胞富含线粒体,是ROS或RNS产生的主要场所。蒽环类抗生素进入心肌组织后,降低了谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)等的含量,ROS或RNS由于不能被及时清除而导致过量累积,从而造成心脏内能量代谢障碍,损伤心肌细胞[7-8]。Pereira等[9]研究表明阿霉素以高亲和力结合线粒体磷脂心磷脂,抑制其功能并刺激ROS或RNS的生成,抑制氧化磷酸化从而导致线粒体DNA的损伤。Ca2+是维持心肌细胞兴奋—收缩偶联的重要物质,氧化应激也会导致心肌细胞内Ca2+浓度的升高,造成钙超载,进而导致细胞代谢功能障碍,加重损伤[10-11]。此外,蒽环类抗生素还会干扰线粒体内的铁代谢途径,导致心肌细胞内游离铁的积累,加重心肌细胞的损伤[12]。
3.2 线粒体损伤
心肌细胞的线粒体主要提供能量,维持着细胞内钙和氧化还原反应的稳态,因此线粒体损伤会影响心肌细胞的正常功能。Kavazis等[13]研究表明,在急性阿霉素治疗后,肌膜下线粒体会积累更多的阿霉素,而肌原纤维间线粒体更容易受到细胞凋亡和自噬反应的影响。Ferreira等[14]研究表明阿霉素破坏了心脏线粒体的生物合成过程,表现为线粒体DNA(mitochondrial DNA, mtDNA)水平下降,细胞核和线粒体基因组编码的多个线粒体基因转录水平改变。蛋白质印迹分析表明,与对照相比,在经阿霉素处理大鼠的心脏线粒体部分中出现差异蛋白质乙酰化作用,线粒体功能障碍和表观遗传改变之间存在相互作用。最近有研究表明[15],浓度依赖性的阿霉素可诱导细胞毒作用和线粒体毒性效应,包括线粒体超氧化物的积聚,线粒体膜电位的降低和线粒体DNA复制数量的减少以及线粒体超微结构的改变。
3.3 拓扑异构酶
蒽环类抗生素致心脏毒性机制与心肌细胞中的拓扑异构酶2(topoisomerase 2,Top2)存在密切关系[16]。Top2有Top2α和Top2β两个亚型。其中Top2α存在于快速分裂的细胞中,如肿瘤细胞。蒽环类抗生素与Top2α结合可诱导肿瘤细胞凋亡。而Top2β是存在于人的心肌细胞中,蒽环类抗生素与Top2β结合形成的复合物可以引起DNA双链断裂和转录组修饰,导致心肌细胞死亡[17-18]。除了细胞核的Top2以外,心肌细胞还表达3种线粒体拓扑异构酶,分别是Top2β、Top3α和Top1mt。其中Top1mt是唯一的可选择性地控制线粒体DNA(mtDNA)稳态的特定线粒体亚型,而蒽环类抗生素可以显著破坏Top1mt[19-20]。研究表明Top1mt对于耐受线粒体的DNA损伤非常重要,而缺乏这种酶的小鼠对阿霉素心脏毒性的易感性更高[20]。
3.4 MicroRNA(miRNA)
MicroRNA(miRNA) 是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,主要调控基因转录后水平。miRNA是心血管发育和疾病的关键调节分子,其中miRNA指导下游靶标的表达控制着再生、修复和病理性重塑的过程[21]。蒽环类抗生素诱导心脏损伤后,心肌细胞可表达不同水平的miRNA。例如,miR-140-5p在蒽环类抗生素致心脏毒性中起着重要的调节作用,通过靶向核红细胞因子2相关因子2(nuclear erythroid factor 2-related factor 2,Nrf2)和沉默信息调节因子2相关酶2(silent information regulator factor 2-related enzyme 2,Sirt2)调节心肌氧化应激,从而降低心脏毒性[22-23]。miR-499可能促使心律失常和心肌肥厚而对心脏产生不可逆转的损伤[24]。蒽环类抗生素可导致miR-523-3p的上调,损伤心肌细胞的线粒体,加快心肌细胞的凋亡[25]。miR-320a的过表达增加了体外细胞凋亡,并加重了小鼠心脏中的血管异常和心脏功能障碍[26]。另有研究表明,miR-30e、miR-208和miR-21改善蒽环类抗生素诱导的心肌细胞凋亡,而miR-140和miR-146a则进一步增强蒽环类抗生素诱导的心肌细胞凋亡[27-31]。
3.5 相关的信号通路
Zhu等[32]研究表明阿霉素在大鼠心肌细胞H9c2细胞中通过核转录因子kappa-B(nuclear transcription factor kappa-B,NF-κB)上调miR-34a-5p。MiR-34a-5p通过靶向沉默信息调节因子2相关酶1(silent mating type information regulation 2 homolog 1,Sirt1)增加p66shc基因的表达,导致B淋巴细胞瘤-2基因相关X蛋白(B-cell lymphoma-2 associated X protein, Bax)和活化的半胱氨酸天冬氨酸蛋白酶-3(caspase-3)增加,B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)减少(Bcl-2也是miR-34a-5p的直接靶标),并促进阿霉素诱导的心肌细胞凋亡。此外,Sirt1的强制表达减轻了阿霉素诱导的H9c2细胞凋亡,抑制了p66shc、Bax、活化的caspase-3和miR-34a-5p的水平,以及增强Bcl-2的表达。因此,miR-34a-5p通过靶向Sirt1促进心肌细胞的凋亡,而miR-34a-5p/Sirt1/p66shc通路的激活可促进阿霉素诱导的心脏毒性。
Huang等[33]研究表明阿霉素可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路诱导心肌细胞的凋亡,进而对心脏产生损伤作用。阿霉素在线粒体产生的活性氧类(reactive oxygen species,ROS)下激活了下游的细胞外信号调节激酶1/2(extracellular signal-regulated protein kinases 1 and 2,ERK1/2)并下调热休克因子2(heat shock factor 2,HSF2)的类泛素化,这增强了HSF2的核转位和在血管紧张素II-1型受体(angiotensin II receptor type 1,AT1R)启动子区域上对热休克元件(heat shock element,HSE)的DNA结合能力,导致AT1R上调。AT1R转移到了作用于下游信号转导的质膜,从而促进细胞凋亡的进展。
此外,蒽环类抗生素还可以通过其它一些信号通路对心脏产生毒性作用。例如,抑制心肌细胞的神经调节蛋白生长因子1(neuregulin-1,NRG-1)/ErbB信号通路(neuregulin/ErbB survival signaling)[34];心肌营养素-1/白血病抑制因子/gp130通路(the CT-1/LIF/gp130 survival pathway)[35]、β肾上腺素能受体/磷脂酰肌醇激酶/蛋白激酶通路(Gβγ-PI3K-Akt pathway)[36]、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路[37]等。
3.6 其它
除了上述机制外,还有Toll样受体学说(toll-like receptors,TLRs),Toll样受体是参与非特异性免疫的一类重要蛋白质分子,当细胞受到损伤时,它可以启动固有免疫反应[38]。研究表明Toll样受体参与了蒽环类抗生素介导的细胞应激与损伤,高迁移率族蛋白B1(high mobility group box1,HMGB1)或其受体TLR2的药理学抑制可以预防蒽环类抗生素诱导的心肌细胞凋亡、心脏纤维化和炎症[39-40]。细胞自噬失调、基因表达等研究表明与蒽环类抗生素致心脏毒性作用机制相关[41-42]。
4 小结和展望
蒽环类抗生素是临床上重要的抗肿瘤化疗药物,但会产生心脏毒性等不良反应,严重时甚至威胁患者的生命,导致其在临床上的使用受到了一定的限制。深入研究蒽环类抗生素致心脏毒性的临床表现、发病机制对于合理、安全使用蒽环类抗生素具有重要的科研价值和现实意义[43]。目前我国对于蒽环类抗生素的心脏毒性已经有了比较系统的认识。在使用蒽环类抗生素前,应全面充分评估心脏毒性的风险,制定相关的治疗策略,从而尽量获取最佳的治疗效果,提高患者的生存率[44]。
近年来,国内外的学者对于蒽环类抗生素所致心脏毒性机制的研究不断深入开展,但尚未完全阐明。本文主要从氧化应激、线粒体损伤、拓扑异构酶、MicroRNA、相关的信号通路和Toll样受体学说等方面,对蒽环类抗生素致心脏毒性机制进行综述。目前临床上预防和治疗蒽环类抗生素致心脏毒性的有效药物不多。未来仍需进一步的研究去阐明蒽环类抗生素致心脏毒性的发病机制,为有效的临床防治和药物研发提供参考。
