牛油果中植物甾醇的鉴定及抗氧化、抑菌活性
2019-03-08田丹丹梅晓宏
田丹丹,李 艳,梅晓宏,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业部农业转基因生物安全评价(食用)重点实验室,北京 100083)
牛油果(Persea americana Mill.)为常绿植物鳄梨果实的别称,也称为油梨、酪梨等[1-3]。牛油果是一种著名的热带水果,其果实营养成分丰富,含多种维生素、矿物质和极丰富的脂肪等[4-6]。此外,牛油果果肉中几乎不含糖,胆固醇含量极低,是糖尿病患者极好的食品和保健品[2]。另外,牛油果果肉中脂类物质含量丰富,其中不饱和脂肪酸含量最高达80%,有降低胆固醇、血脂,保护肝脏等重要功能,另有研究表明牛油果有预防癌症的功能[7];因此牛油果备受消费者青睐[8]。
植物甾醇是一种结构上与动物性胆固醇相似而功能完全不同的天然的植物活性成分,具有环戊烷全氢菲(甾核)结构,广泛存在于各种植物种子中,多以谷甾醇、菜油甾醇、豆甾醇和菜籽甾醇及其甾醇酯的形式存在。流行病学和实验室研究显示,植物甾醇及其甾醇酯可以降低冠状动脉硬化、心脏病、癌症和良性前列腺肥大等慢性病的发病率[9-11]。因此,近年来植物甾醇备受关注,美国食品药品管理局已将基于植物甾醇的人造奶油和色拉酱列入功能食品范畴,将其用于慢性病的预防。随着对植物甾醇功能活性研究的不断深入,对其抗氧化性活性和抑菌活性的研究也日益开展起来。
赵雁武等[12]研究了以β-谷甾醇为主要成分的苹果籽油植物甾醇与天然抗氧化剂VE和人工合成抗氧化剂2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)对各种自由基的清除能力,结果表明,植物甾醇清除自由基的能力较VE和BHT高。李万林等[13]采用微波辅助提取大豆油中的植物甾醇,其抗氧化实验结果显示大豆油粗甾醇具有较强的抗氧化性,可作为生产具有清除·OH作用药物的主要成分。徐雅琴等[14]在研究中发现,南瓜籽植物甾醇可有效清除自由基,并对猪油氧化具有一定抑制作用,而且与柠檬酸、VC和VE有协同抗氧化作用,其中与VE的协同增效效果最好。对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和沙门氏菌均有很好的抑制作用,当质量浓度达到3.0 mg/mL时可以完全抑制供试菌的生长。由于牛油果果实中脂类含量丰富,推测其可能富含植物甾醇,而到目前为止相关方面的报道较少。针对上述实际情况,本实验对牛油果中植物甾醇的种类、含量、抗氧化活性及抑菌活性等进行了初步研究和探索,以期为牛油果进一步开发利用提供理论及实验依据。
1 材料与方法
1.1 材料与试剂
牛油果购自当地超市。
大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella)均由中国农业大学食品科学与营养工程学院转基因生物安全评价(食用)重点实验室提供。
甾醇标准品(胆固醇、胆甾烷醇、菜籽甾醇、环木菠萝烯醇、麦角固醇、菜油甾醇、豆甾醇、β-谷甾醇)、衍生剂(N-甲基-N-三甲基硅烷基七氟丁酰胺、1-甲基咪唑(95∶5,V/V))、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;吩嗪硫酸甲酯(phenazine methosulfate,PMS)、还原性辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)、氯化氮蓝四唑(nitro-blue tetrazolium,NBT)、VE 西亚试剂公司;正己烷、二氯甲烷、丙酮均为国产色谱纯;盐酸、乙醚、石油醚、乙醇均为国产分析纯。
1.2 仪器与设备
LGJ-25C型冷冻干燥机 北京四环科学仪器厂有限公司;FW100型高速万能粉碎机 天津泰斯特仪器有限公司;SER148型全自动脂肪测定仪 北京盈盛恒泰科技有限公司;TSQ8000气相色谱串联三重四极杆质谱仪、全波长酶标仪 美国Thermo公司;高速冷冻离心机美国Beckman Coulter公司;牛津杯 北京先驱威锋技术开发公司;游标卡尺 上海精密仪器仪表有限公司。
1.3 方法
1.3.1 牛油果油的制备
将牛油果去皮、去核,取可食部分切成小块,用冷冻干燥机进行冷冻干燥(-70 ℃、74 h),高速万能粉碎机粉碎,密封置于4 ℃保存、备用。取约5 g冷冻干燥牛油果于恒质量烧杯(m1/g)中,总质量为m2/g,110 ℃加热干燥至恒质量(m3/g)。按照公式(1)计算出牛油果经冷冻干燥恒质量后干物质平均质量分数。取2 g冻存的样品放于滤纸筒,滤纸筒放入提取筒中,并加入30 mL石油醚。提取筒放入自动脂肪提取仪,65 ℃加热1 h,提起滤纸筒,65 ℃继续抽提1.5 h,差量法获得油脂质量分数,平行测定3 次。将油脂于-20 ℃黑暗中保存[15-16]。
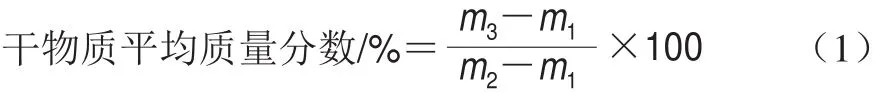
1.3.2 牛油果中植物甾醇的提取
取50 mg上述油脂样品,加入20 μg胆甾烷醇作为内标,加入2 mol/L氢氧化钾-乙醇溶液2 mL,漩涡振荡1 min混匀。70 ℃水浴振摇45 min,室温冷却。加入二氯甲烷5 mL、超纯水3 mL,混合均匀,6 000 r/min离心5 min弃上清液,再用5 mL超纯水洗3 次,弃上清液,氮气吹干有机相,4 ℃贮存备用[17-18]。
1.3.3 牛油果中植物甾醇的鉴定
牛油果中植物甾醇的鉴定参照文献[19-21]。
1.3.3.1 色谱条件
色谱柱:DB-5石英毛细管柱(30 mh0.25 mm,0.25 µm);升温程序:100 ℃保持1 min,以10 ℃/min升至290 ℃,保持10 min;载气(He)流速1.2 mL/min,压力2.4 kPa,进样量0.5 µL;不分流。
1.3.3.2 质谱条件
电子轰击离子源;电子能量70 eV;传输线温度290 ℃;离子源温度250 ℃;母离子m/z 285;激活电压1.5 V;质量扫描范围m/z 35~500;监测方式SRM模式。
1.3.3.3 GC-MS/MS检测
称取各甾醇标准品5 mg(β-谷甾醇10 mg),分别用丙酮配制质量浓度梯度为0.1、0.2、0.3、0.4、0.5 mg/mL的甾醇混合标准溶液,氮气吹干后,甾醇混合标准溶液与1.3.2节提取的甾醇样品中均加入100 μL衍生剂,于75 ℃衍生20 min,正己烷定容到1 mL,进样1 μL,用气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)检测。以甾醇混合标准溶液质量浓度为横坐标,以各甾醇峰面积(经内标校正)为纵坐标,绘制标准工作曲线,用标准工作曲线对试样进行定量,得到其检测浓度。
1.3.4 牛油果植物甾醇的抗氧化活性测定
1.3.4.1 牛油果植物甾醇初步纯化
采用1.3.2节方法提取牛油果中植物甾醇。采用硅胶柱色谱对植物甾醇进行初步纯化,具体步骤如下所述。量取约100 mL的层析硅胶,装柱,洗脱剂为石油醚-丙酮(体积比8∶1)。将甾醇粗提取样品用少量丙酮溶解后过硅胶柱。用洗脱剂洗脱,每10 mL收集一次,同1.3.3.3节中的甾醇混合标准溶液进行薄层色谱检验。展开剂为石油醚-乙醚混合液(体积比7∶3),合并相同比移值(Rf)的组分,氮吹浓缩结晶后,制备出甾醇纯化样品。
1.3.4.2 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考Larrauri等[22]的方法并适当改进。精确称取并配制浓度为1h10-4mol/L DPPH的无水乙醇溶液。吸取上述DPPH无水乙醇溶液和无水乙醇各2 mL,混匀后,在517 nm波长处测定吸光度(A0);分别吸取2 mL质量浓度分别为0、2、4、6、8、10、12 μg/mL的甾醇样品和VE的无水乙醇溶液,然后各加入上述DPPH无水乙醇溶液2 mL,于室温放置30 min后,在517 nm波长处测定吸光度(Ai);分别吸取2 mL各甾醇样品,加入无水乙醇2 mL,混匀,在517 nm波长处测定吸光度(Aj)。每个样品重复测定3 次,取平均值。DPPH自由基的清除率按式(2)计算。

1.3.4.3 gOH清除能力的测定
gOH清除能力的测定参照文献[23-24]。将1.0 mL 9 mmol/L FeSO4溶液、1.0 mL 8.8 mmol/L H2O2溶液于37 ℃恒温条件下反应15 min后,在536 nm波长处测其吸光度(A0),然后分别加入1 mL质量浓度分别为0、10、20、30、40、50、60 μg/mL的甾醇样品和VE的无水乙醇溶液,在536 nm波长处测其吸光度(AX)。每个样品重复测定3 次,取平均值。按式(3)计算·OH清除率。

1.3.4.4 O2-·清除能力的测定
O2-·清除能力的测定参照文献[25]。取含30 μmol/L PMS、338 mmol/L NADH、72 μmol/L NBT的Tris-HCl缓冲液(16 mmol/L、pH 8.0)各1 mL,分别加入1 mL质量浓度分别为0、5、10、15、20、25 μg/mL的甾醇样品和VE的无水乙醇溶液,静置5 min后,于560 nm波长处测定各样品吸光度,对照为不加样品的吸光度。每个样品重复测定3 次,取平均值。按式(4)计算O2-·清除率。
1.3.5 牛油果中植物甾醇抑菌活性的测定
1.3.5.1 样品前处理
按照1.3.1节和1.3.2节的工艺流程提取牛油果植物甾醇,得到植物甾醇提取物,与甾醇标准品相同,用丙酮配制成质量浓度为1 mg/mL的待测样品,4 ℃保存,备用。
1.3.5.2 菌种活化
将大肠杆菌、沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌以划线法分别接种到LB培养基上,并置于37 ℃培养箱培养18~24 h。将所有供试菌株活化两代后,分别挑取单菌落,接种于LB液体培养基中,37 ℃摇床振荡(200 r/min)培养至对数生长期,分别取1 mL于9 mL无菌生理盐水即得到待用菌悬液。
1.3.5.3 抑菌实验
采用抑菌圈法测定牛油果中植物甾醇的抑菌活性[26-27]。在无菌条件下取100 μL菌悬液在培养基上进行涂布均匀。用无菌镊子夹取灭菌的牛津杯与培养基上,取100 μL甾醇提取物丙酮溶液加入到牛津杯中,采用丙酮作为阴性对照,青-链霉素混合液(100×,双抗)作为阳性对照,37 ℃培养24 h后取出,用无菌镊子取出牛津杯,用游标卡尺测量抑菌圈直径(测量3 次,取其平均值),并记录数据。
1.4 数据统计分析
采用Xcalibur软件进行质谱图鉴定及分析,采用Excel 2003软件进行数据处理及分析。
2 结果与分析
2.1 牛油果植物甾醇种类及含量分析
2.1.1 牛油果干物质、脂肪质量分数
牛油果经冷冻干燥至恒质量后干物质平均质量分数为26.76%,经索氏抽提得到黄绿色油脂,得出脂肪平均质量分数为58.00%。根据牛油果干物质中脂肪含量计算出牛油果鲜脂肪质量分数为15.51%。
一般果蔬水分质量分数通常会达到90%左右,意味着其干物质含量比较低。同时,其脂肪含量一般也很低。除榴莲和牛油果,一般果蔬的脂肪质量分数通常在1%以下,有的低至0.2%左右[28]。由此可见,相比较其他果蔬,牛油果中脂肪含量明显较高。又因植物甾醇广泛存在于植物油中,因此可以推测牛油果中应该含有较多的植物甾醇。
2.1.2 牛油果植物甾醇种类及含量
按1.3.3.1节色谱条件进行分析,混合标准品中各植物甾醇化合物在上述条件下能到达很好的分析效果(图1)。
由表1可知,甾醇混合标准品中,β-谷甾醇在10~1 000 μg/mL范围内标准曲线的相关系数为0.999 9,其他7 种甾醇在10~500 μg/mL范围内标准曲线的相关系数均大于0.999,β-谷甾醇检出限为1.0 mg/kg,其他7 种甾醇检出限为0.5 mg/kg。
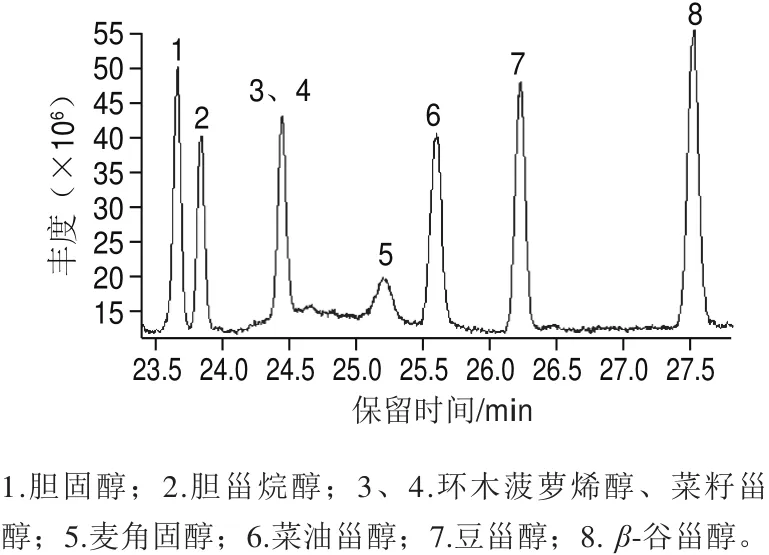
图1 植物甾醇混合标准品色谱图Fig.1 GC of mixed phytosterol standards

表1 植物甾醇混合标准品分析定量参数和检出限Table1 Standard curve equations and detection limits for eight phytosterol compounds
以标准样保留时间和GC-MS/MS中的离子碎片(表2)对牛油果中的主要甾醇进行定性、定量分析,其主要甾醇的总离子流色谱图结果如图2所示。经GC-MS/MS鉴定出牛油果果肉中所含的4 种甾醇:β-谷甾醇、菜油甾醇、胆固醇、豆甾醇,其含量分别为59.47、30.36、15.34、2.72 mg/100 g。此外,在保留时间为26.51 min和27.17 min的两种物质丰度较高,由于植物甾醇标准品有限而未能鉴定出,确定其主要的离子质荷比分别为372、463以及255、369。已鉴定出的4 种甾醇总含量为107.89 mg/100 g。而一般果蔬的甾醇含量均在50 mg/100 g以下,如苹果、草莓、猕猴桃等甾醇含量均低于20 mg/100 g[29]。显而易见,牛油果甾醇含量与其他果蔬相比较高。

表2 植物甾醇混合标准品质谱数据Table2 MS data for eight phytosterol compounds

图2 牛油果中植物甾醇GC-MS/MS总离子流色谱图Fig.2 GC-MS/MS total ion current chromatogram of phytosterols from avocado
植物甾醇是一种重要的植物功效成分,几乎存在于所有植物性食物中。大量流行病学资料和实验室研究证明:人群许多慢性病(如冠状动脉硬化性心脏病、癌症、良性前列腺肥大等)的发生率较低与摄入较多的植物甾醇有关。牛油果中植物甾醇含量最丰富的是β-谷甾醇,β-谷甾醇作为最主要的植物甾醇,其在降低胆固醇、消炎解热、抗氧化、抗肿瘤和抗癌等方面发挥着重要的作用[30]。因此,选取牛油果进行植物甾醇功能成分的检测是具有一定意义的。
2.2 牛油果植物甾醇抗氧化活性分析

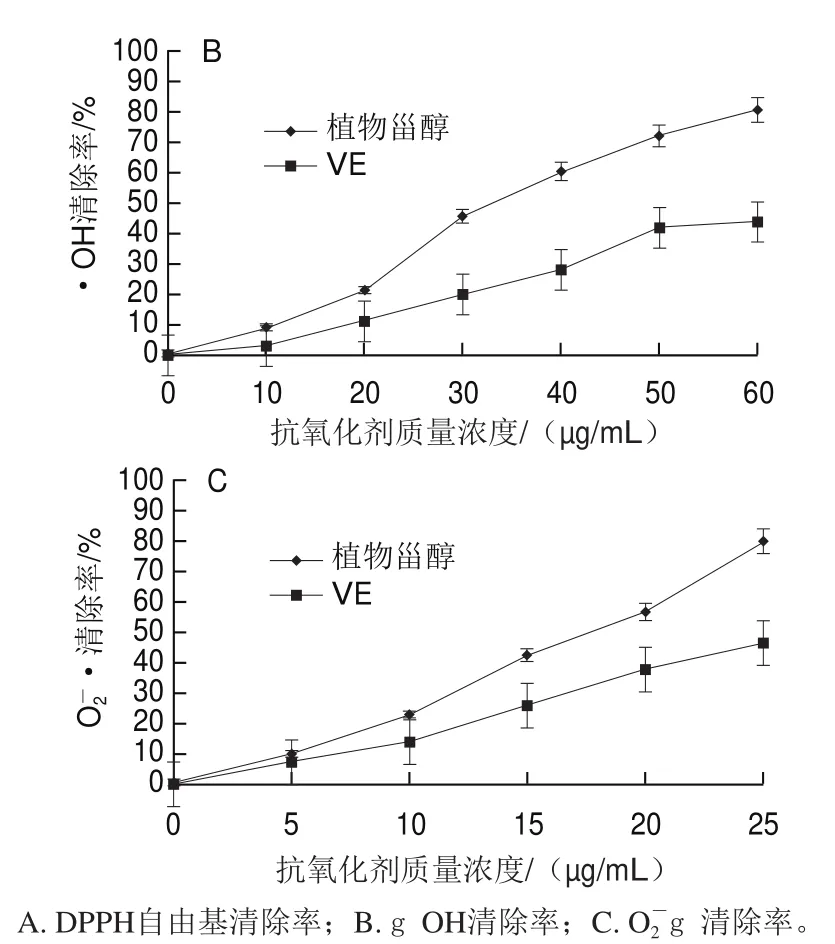
图3 牛油果植物甾醇对3 种自由基的清除能力Fig.3 Scavenging activity of avocado phytosterols against three free radicals
由图3可以看出,牛油果甾醇对D P P H自由基、gOH、O2-g均具有较强的清除作用,随着甾醇质量浓度的增加,3 种自由基清除率逐渐增大。达到半数抑制浓度(half maximal inhibitory concentration,IC50)时对应的甾醇样品质量浓度分别为6.82、35.92、17.08 μg/mL。
图3A中,当甾醇样品质量浓度为10 μg/mL时,DPPH自由基清除率达到80.03%,是对照VE的2.8 倍。表明牛油果甾醇样品对DPPH自由基的清除能力远高于VE。图3B中,当甾醇样品质量浓度为50 μg/mL时,其对gOH清除率为VE的1.72 倍。可以看出,牛油果甾醇样品对·OH的清除率优于VE。图3C中,当甾醇样品质量浓度为20 μg/mL时,其对O2-g 清除率为VE的1.52 倍。可见,牛油果甾醇样品对O2-g具有较强的清除能力,且清除能力始终高于VE。

图4 β-谷甾醇的化学结构Fig.4 Chemical structure of β-sitosterol

图5 VE的化学结构Fig.5 Chemical structure of VE
结果表明,牛油果中植物甾醇是一种良好的抗氧化剂,具有很好的清除自由基能力,并且效果明显优于VE。本研究结果与赵雁武等[12]关于苹果籽油中植物甾醇抗氧化活性的研究结果相一致。这可能与β-谷甾醇羟基的邻位没有官能团有关,而牛油果中含量最多的正是β-谷甾醇。由图4、5可知,这2 种抗氧化剂的共同特点是只有1 个酚羟基。植物甾醇的基本骨架是由3 个六元环和1 个五元环组成的环戊烷全氢菲的甾核,羟基位于六元环己烷的3位,羟基周围没有其他官能团。而VE的酚羟基位于苯并二氢吡喃结构的苯环6位上,其相邻的5位和7位的甲基因位阻作用限制了其与自由基的进一步反应。植物甾醇可以有效清除自由基,这可能是因为甾醇将3位酚羟基的氢提供给了自由基,清除了DPPH自由基、·OH和O2-·,其作用机理在于它阻断了自由基引发的连锁反应,从而抑制其进一步的氧化作用。由于自由基与衰老、炎症、休克、动脉粥样硬化、药物及酒精中毒等有关[31],植物甾醇可作为外源性氧自由基清除剂,其应用有待进一步研究。而植物甾醇的抗氧化性与其防治心血管疾病和抗癌等作用均密切相关,因此可针对牛油果的抗氧化功能作进一步应用研究。
2.3 牛油果植物甾醇抑菌活性分析
通过测定抑菌圈大小,得到甾醇提取物的抑菌结果如表3所示。

表3 牛油果植物甾醇提取物的抑菌圈直径(n=3)Table3 Inhibition zone diameters of avocado phytosterol (n = 3)mm
由表3可得出,阴性对照丙酮没有抑菌圈,说明其没有抑菌活性,从而排除溶剂影响。阳性对照青-链霉素双抗抑菌效果明显。质量浓度为1 mg/mL的甾醇标准品和牛油果甾醇提取物对于4 种菌株均有抑制作用,且甾醇标准品的抑菌能力强于牛油果甾醇提取物,二者抑菌效果由强至弱均依次为枯草芽孢杆菌>金黄色葡萄球菌>沙门氏菌>大肠杆菌。因此,植物甾醇对于枯草芽孢杆菌的抑菌效果较好,大肠杆菌的抑菌作用较差。
对于革兰氏阴性菌,甾醇标准品对大肠杆菌和沙门氏菌的抑制作用相当,而甾醇提取物对沙门氏菌的抑制效果比大肠杆菌好;对于革兰氏阳性菌,二者抑制作用均是枯草芽孢杆菌强于金黄色葡萄球菌。显而易见,植物甾醇对于革兰氏阳性菌的抑制效果要好于革兰氏阴性菌。这与有关文献报道的研究结果[32]相符,主要原因是革兰氏阳性菌细胞壁的主要成分是肽聚糖,并且肽聚糖位于表层,抑菌成分如青霉素和溶菌酶能够直接效用于肽聚糖,抑制肽聚糖的合成。从而对革兰氏阳性菌起抑制作用。而革兰氏阴性菌肽聚糖含量少,且肽聚糖位于较内层,其外有外膜保护,抑菌成分不能直接作用于肽聚糖,因此溶菌酶对革兰氏阴性菌无较强效用。
植物甾醇的种类繁多,结构相异的甾醇类物质会表现出不同的抑菌效果,而影响抑菌效果的因素众多,抑菌成分的处理方式、抑菌成分的浓度与溶解度均能影响其抑制效果,对此还需进一步探究。现已有相关文献表明植物甾醇具有抑菌作用,彭昕等[32]研究雷竹笋的抑菌实验中发现,总甾醇表现出良好的抑菌作用,并且对大肠杆菌与金黄色葡萄球菌2 种细菌的抑制作用比其对黑曲霉等真菌的抑制效果要好。而天然防腐剂正以其抗菌性强、安全无毒、热稳定性好、作用范围广等优点在食品、医药等领域飞速发展[33],因此可以考虑牛油果中植物甾醇提取物作为食源性的抑菌成分而广泛用作植物源的天然防腐剂。
3 结 论
本研究采用GC-MS/MS法对牛油果植物甾醇进行提取鉴定,测定其种类及含量,并利用硅胶柱层析纯化提取的植物甾醇进行体外抗氧化实验,最后采用平板涂布法研究了牛油果植物甾醇提取物的抑菌效果。实验结果表明牛油果相对于其他果蔬含有较多的植物甾醇,具有比VE更高的抗氧化活性,同时牛油果植物甾醇提取物对于常见的4 种致病菌株均有抑制效果。牛油果可以作为良好的天然抗氧化食物和抑菌防腐剂来源,为进一步深入开展对其活性及消化特性的研究提供理论依据,并有望应用于抗氧化功能性食品或食品添加剂,有利于提高牛油果的综合利用价值。
