临泽小枣粗多糖提取动力学模型建立及结构特征分析
2019-03-08刘晓风王永刚任海伟刘继超范文广杨明俊
徐 也,刘晓风*,王永刚,任海伟,刘继超,张 璇,范文广,杨明俊
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
红枣(Ziziphus jujuba Mill.),又名华枣、刺枣、良枣,主要分布于我国黄河流域,具有悠久的栽培历史。是鼠李科(Rhamnaceae)植物枣属(Zizyphus Mill.)的成熟果实,含有丰富的营养物质[1-2]。《诗经》中将枣列为“五果”之一[3],其含有低聚糖、多糖、生物碱、皂苷、黄酮等多种活性物质[4]。近年来,关于红枣多糖的提取、分离纯化、结构特性和药理活性的报道越来越多。陈国梁等[5]采用Sevag法、三氯乙酸法和鞣酸法对醇沉所得粗多糖进行脱蛋白,结果显示,Sevag法脱蛋白效果明显,但多糖损失较多,三氯乙酸法多糖损失率小但脱蛋白效果稍次。李进伟等[6]将金丝小枣粗多糖经DEAE-Sepharose-6B柱纯化后得到4 个组分,多糖回收率达83.1%。斯琴格日乐等[7]采用正交试验法优化了郑新红枣多糖超声波提取工艺。Wang Cuntang等[8]研究发现冬枣多糖可以促进淋巴细胞体积变大、数量增多,具有较强的免疫学活性。而且冯艳风[9]发现大枣粗多糖能通过内源性凝血系统发挥作用,显著延长人体血浆的活化部分凝血活酶时间,而对凝血酶时间、凝血酶原时间均无明显影响,且该过程与浓度呈量效关系。红枣多糖作为中药制剂的有效成分之一,其提取工艺以及动力学研究在中药制剂生产中尤为重要。目前已经有很多关于中药活性物质动力学模型的研究,如膜理论、非稳态理论和Ponomaryov经验式等[10-11],为阐述中药活性成分提取过程的微观机理以及工业生产提供了理论依据。
临泽小枣主产于甘肃省张掖市临泽县,受气候干燥和昼夜温差等气候条件的影响,具有枣果枣核小、肉质致密、多糖质量分数高(72%~80%)等特点。因此具有工业可加工性强、适宜规模化提取等优点。本实验以临泽小枣为研究对象,基于Fick第一定律建立了临泽红枣多糖(Lingze jujube polysacchride,LZJP)传质动力学模型,并通过傅里叶变换红外光谱、原子力显微镜和扫描电子显微镜对LZJP官能团和表面结构进行了分析,以期进一步完善LZJP提取动力学的基础研究,并为其粗多糖的规模化提取、精深加工和高附加值产品的开发提供一定理论依据。
1 材料与方法
1.1 材料与试剂
临泽小枣由甘肃泽园农业科技有限公司提供。
苯酚、无水乙醇和葡萄糖等(均为分析纯) 莱阳市双双化工有限公司。
1.2 仪器与设备
HPX-9162MB数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;UV-VIS Carry50紫外-可见分光光度计美国Varian公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;AB104-N分析天平 梅特勒-托利多仪器(上海)有限公司;HH-S4电热恒温水浴锅北京科伟永兴仪器有限公司;Nexus 670傅里叶变换红外光谱仪 美国Nicolet公司;JSM-5600LV扫描电子显微镜 日本电子光学公司。
1.3 方法
1.3.1 红枣多糖提取及质量分数的测定
准确称量5.00 g枣粉于100 mL的磨口三角瓶中,加一定比例的水,水浴回流浸提一定时间,过滤残渣,加入终体积分数为80%的无水乙醇,4 ℃过夜,5 000 r/min离心获得沉淀。分别经蒸馏水溶解、Sevag法除去蛋白[12]、水相部分冷冻干燥,最终得到LZJP。
采用苯酚-硫酸法[13-14],以葡萄糖为标准品,多糖质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。得到y=1.379x-0.048,线性范围为0.15~0.8 mg/mL,相关系数R2为0.998 6。吸取2 mL粗多糖溶液,根据标准曲线计算多糖质量浓度,按照式(1)计算多糖质量分数。
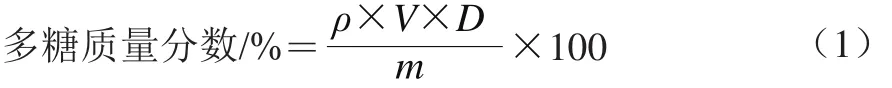
式中:ρ为样液中多糖质量浓度/(mg/mL);V为样液体积/mL;D为稀释倍数;m为样品质量/g。
1.3.2 多糖提取动力学分析
本实验以红枣为提取对象,以水为溶剂,分析红枣多糖提取的动力学过程。提取过程主要包括溶剂浸润、内扩散和外扩散3 个过程[15-17]。其中,内扩散为限速关键步骤[18]。假定颗粒内多糖分布均匀,扩散系数恒定且均相温度不变[19]。根据Fick第一定律,在某一时刻通过界面的多糖传质通量按式(2)表示。

式中:ρ0为红枣颗粒中心部位多糖质量浓度/(mg/mL);ρ1为颗粒表面多糖质量浓度/(mg/mL);ρ为溶剂中多糖质量浓度/(mg/mL);δ为扩散边界层厚度/m;J为多糖传质通量/(mg/min);D为红枣颗粒半径/m;DS为颗粒内多糖的扩散系数/(m2/s);DL为溶剂中多糖的扩散系数/(m2/s);V为溶剂体积/mL;A为两相界面积/m2,负号表示多糖传质方向与质量浓度梯度方向相反。整理得公式(3)。

由式(3)可看出多糖扩散速率d(Vρ)/dt与其质量浓度梯度dρ/dδ和两相界面积A成正比。
假定某一时刻dρ/dδ随时间的递减速率与质量浓度梯度成正比[20],则可得式(4)。

式中:k为比例常数,表示多糖的表观扩散速率常数,受多糖物性、提取条件和颗粒大小等因素决定。记初始多糖质量浓度为ρ0,积分得式(5)和(6)。
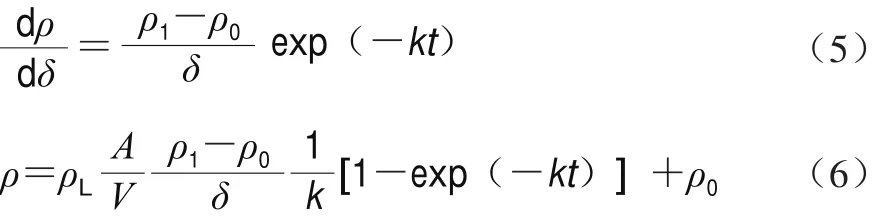
假定红枣质量为m/g;溶剂体积与红枣的质量比为M/(mL/g);饱和吸溶剂率为P/(mL/g)。故提取液体积可按式(7)计算。

设红枣颗粒密度为ρ;A0为单个颗粒扩散面积/m2。则m/g红枣样品所含颗粒数n与颗粒总扩散面积A可按为式(8)和式(9)表示。
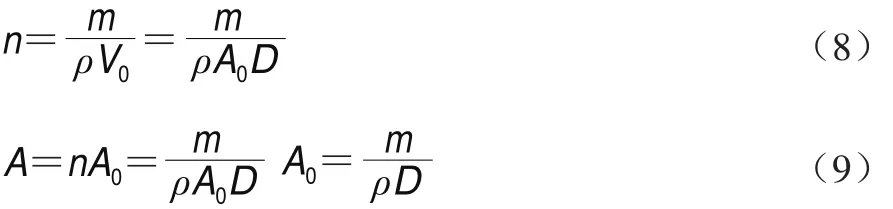
由式(6)、(7)、(9)得式(10)。

当多糖提取达到平衡时,t→∞、ρ=ρ∞,则得到式(11)。

合并整理取对数得式(12)和式(13)。
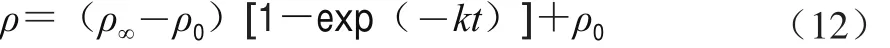

式(10)与式(13)即为红枣多糖的提取动力学模型,该模型表征了红枣颗粒大小、料液比、提取时间及温度等因素与多糖质量浓度之间的关系。
1.3.3 多糖理化性质检测
分别将粗多糖溶解在不同的溶剂(热水、冷水、无水乙醇、甲醇、丙酮)中,观察其溶解性;并将临泽小枣粗多糖溶液分别进行苯酚-硫酸反应、碘-碘化钾反应、茚三酮反应、双缩脲反应和Fehling试剂反应[20],观察反应前后的溶液的颜色变化。采用考马斯亮蓝法[21]、硫酸-咔唑法[22]及硫酸钡比浊[23]分别测定多糖溶液中蛋白质、糖醛酸和硫酸基的含量。
1.3.4 多糖分离纯化
1.3.4.1 离子交换柱纯化
将多糖样品配制成10 mg/mL的溶液。将溶液缓慢加到已平衡好的DEAE-52纤维素柱中。依次用蒸馏水及0.1、0.3、0.5、0.7 mol/L NaCl溶液进行梯度洗脱,流速为1 mL/min,自动部分收集器收集洗脱液,每管收集5 mL;用苯酚-硫酸法于484 nm波长处跟踪测定每管中多糖含量,绘制多糖洗脱分布图,选取最佳洗脱峰段收集、合并相同梯度样品溶液,经过减压旋蒸浓缩、透析脱盐、冷冻干燥得到纯化多糖粉末。
1.3.4.2 凝胶柱纯化
将纤维素柱纯化后的多糖组分,溶解后加入平衡过的Sephadex G-100色谱柱中,超纯水洗脱,自动部分收集器收集,流速0.8 mL/min,每个组分收集60 管,每管收集5 mL。并绘制多糖的洗脱分布图,分别收集不同的洗脱峰,经合并、浓缩和冷冻干燥,得到纯多糖粉末。
1.3.5 多糖结构分析
1.3.5.1 傅里叶变换红外光谱分析
称取1 mg干燥的LZJP与KBr粉末于研钵中研磨混合均匀,压成薄片,在波数4 000~400 cm-1范围内利用傅里叶变换红外光谱仪进行光谱扫描[24],分辨率为0.09 cm-1。
1.3.5.2 原子力显微镜观察
采用盖玻片作为原子力显微镜测试的基底,分别用丙酮、无水乙醇将盖玻片在超声波清洗仪中超声洗涤10 min,用氮气将盖玻片吹干,待用。将1.0 mg/L多糖溶液均匀涂布于盖玻片表面,自然晾干,室温干燥,放置于原子力显微镜上对其分子形态进行扫描观测。图像均在contact模式下获得,探针为Si3N4(微悬臂长200 μm、弹性系数0.12 N/m),原子力显微镜图像的形态学特征(如高度、宽度等)均采用原子力显微镜附带的软件进行分析[25]。
1.3.5.3 扫描电子显微镜观察
多糖粉末经镀膜,以10 Pa的真空度,15 mA的离子电流镀金160 s并拍照,观察多糖表面的显微形态结构[26]。
1.4 数据统计与分析
所有实验均重复3 次,结果以平均值±标准差表示,且标准偏差不超过5%;采用Origin 8.0对实验数据进行绘图。
2 结果与分析
2.1 动力学模型的建立
2.1.1 速率常数求解
不同提取温度和料液比下,提取液中多糖质量浓度随时间变化分别如表1、2所示。由表1可得出,多糖溶出速率随提取温度的升高和时间的增加而逐渐加快。当提取温度达到353 K(80 ℃)时,多糖溶出速率逐渐减小,提取温度达到358 K(85 ℃)时,多糖溶出速率基本保持不变。在相同提取温度下,提取时间达到90 min后,多糖溶出速率逐渐减慢,当提取时间达到105 min后,多糖质量浓度趋于平衡。同理,由表2可得,在同一温度下,多糖溶出速率随料液比增加而增大;在不同的料液比下,提取一定的时间,料液比达到1∶20时,多糖溶出速率逐渐减小;当料液比为1∶22.5时,多糖溶出速率基本保持不变。在对应的料液比下,提取时间达到90 min后,多糖溶出速率逐渐减慢,在105 min时提取液多糖质量浓度趋于平衡。因此,取120 min 时的多糖质量浓度作为平衡浓度。
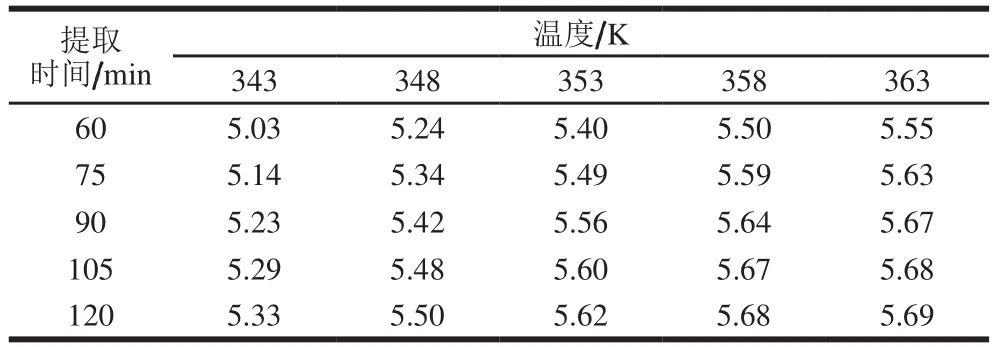
表1 不同温度下提取液中多糖质量浓度Table1 Concentrations of polysaccharides extracted at different temperatures mg/mL

表2 不同料液比下提取液中多糖质量浓度Table2 Concentrations of polysaccharides extracted at different solid to solvent ratios mg/mL

图1 ln(ρ∞/(ρ∞-ρ))与时间的关系图Fig.1 Relationship between ln(ρ∞/(ρ∞−ρ)) and time
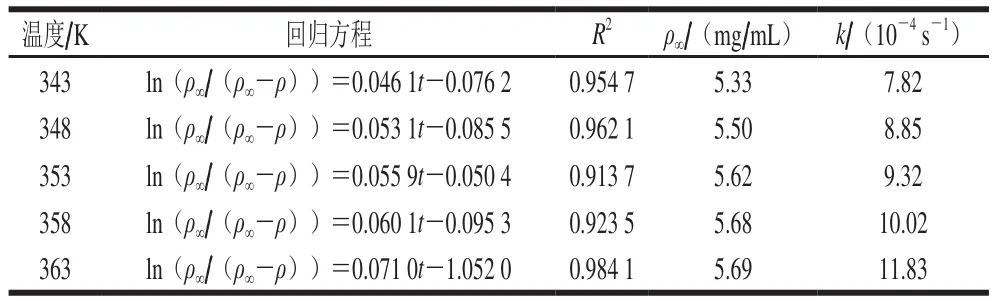
表3 不同温度下ln(ρ∞/(ρ∞-ρ))与时间的回归方差Table3 Regression equations between ln(ρ∞/(ρ∞−ρ)) and time at different temperatures
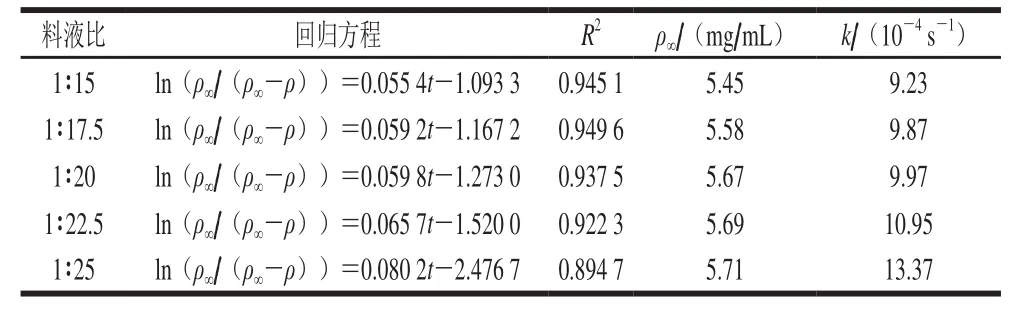
表4 不同料液比下ln(ρ∞/(ρ∞-ρ))与时间的回归方程Table4 Regression equations between ln(ρ∞/(ρ∞−ρ)) and time at different solid to solvent ratios
由图1和表3、4可知,在不同料液比和提取温度下,拟合方程的线性相关系数R2均大于0.89,则表明ln(ρ∞/(ρ∞-ρ))与t之间线性关系性良好。表观速率常数随温度升高而增大,表明高温能够加速红枣多糖的溶出;同样,随着料液比的增加,表观速率常数增大。当料液比低于1∶25时,表观速率常数增加不显著,可能由于溶剂用量太少,不足以将溶质中多糖完全溶出。
2.1.2 相对萃余率求解
假定ρ0为红枣颗粒未经水浸泡提取时质量浓度,则ρ0=0,可设相对萃余率y=(ρ∞-ρ)/ρ∞,于是式(12)变为y=exp(-kt)。利用表1和表2的数据,以y为纵坐标,提取时间t为横坐标作图(图2A、B)。图中各曲线拟合回归方程和对应的速率常数分别见表5、6,可以看出,在不同温度及料液比下,提取的拟合方程相关系数均在0.92以上,曲线有一定的拟合度良好,所以红枣多糖的热水提取过程比较符合指数模型。
由图2A、B可知,随着提取时间的延长,多糖相对萃余率呈指数趋势下降,则适当延长提取时间有利于多糖完全浸出。在不同温度下提取一定时间,随着温度升高,相对萃余率逐渐减小,当提取温度达358 K时,曲线斜率达到最大值,即提取速率达到最大。同理,在不同料液比下提取一定时间,随着料液比的增加,多糖相对萃余率不断下降,而料液比为1∶25时,萃余率出现回升,可能是由于料液比太大,导致后续的浓缩和沉淀工艺难度加大,说明多糖溶出量已达到饱和,这可能是溶剂用量增加导致原料的物质分子间相互作用[27],不利于红枣多糖溶出。

图2 相对萃余率与时间的关系Fig.2 Relationship between relative extraction rate and time

表5 不同温度下多糖相对萃余率对时间的回归方程Table5 Linear regression of relative extraction rate of LZJP against time at different temperatures
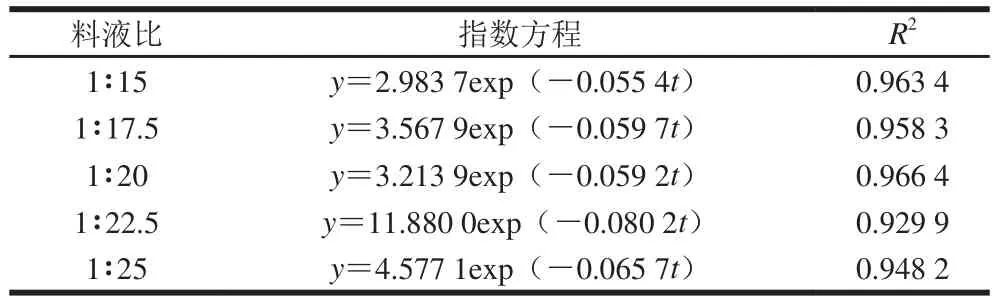
表6 不同料液比下多糖相对萃余率对时间的回归方程Table6 Linear regression of relative extraction rate of LZJP against time at different solid to solvent ratios
2.1.3 活化能
由化学反应动力学可知,多糖提取的表观速率常数与温度遵循Arrhenius公式。利用表1、3中的数据对ln k和1/T作图,结果见图3。ln k与1/T线性关系较好(R2=0.945 6)。根据回归方程计算得到红枣粗多糖热水法提取过程中的活化能为19.266 kJ/mol。说明红枣多糖分子浸出需要能量较低,整个提取过程反应速率较快。由此表明采用热水提取法可以有效提取红枣粗多糖。
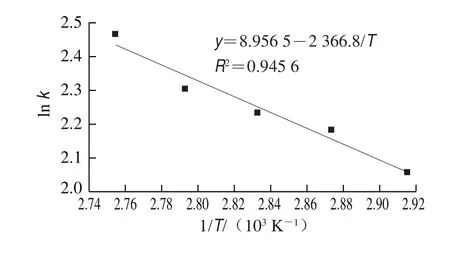
图3 ln k与1/T关系图Fig.3 Relationship between ln k and 1/T
2.1.4 半衰期
由t1/2=ln(2/k)对温度T作图,得到图4。由此可以计算出在最适提取温度下,提取出一半红枣多糖所需的时间。半衰期反应了提取的效率,半衰期越小提取速率越快。由图4可看出,随着温度的升高,其半衰期不断减小,且与之成反比,故升高温度有利于红枣多糖提取。
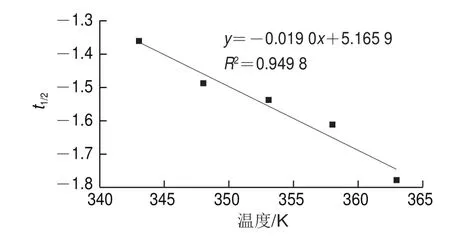
图4 t1/2与温度的关系Fig.4 Relationship between t1/2 and temperature
2.2 多糖理化性质
粗多糖干品呈现棕黄色、无味、易溶于热水,可溶于冷水,但不溶于无水乙醇、甲醇、丙酮等有机溶剂。多糖溶液的苯酚-硫酸反应呈棕红色,表明样品具有糖类化合物的特征;茚三酮反应呈阳性,证明样品中含有游离氨基酸;Fehling试剂反应结果呈阴性,说明不含游离还原糖;碘-碘化钾反应呈阴性,表明该样品为非淀粉类糖。提取物中的粗多糖、糖醛酸、蛋白质和硫酸根质量分数分别为65.53%、27.47%、0.13%和2.68%。
2.3 多糖分离纯化
将10 mg/mL的临泽小枣粗多糖溶液分别用蒸馏水和NaCl洗脱,苯酚-硫酸法示踪,绘制洗脱曲线,如图5所示,共得到4 个峰,第1峰为水洗脱峰(水相),合并试管中的溶液,命名为LZJP1,回收率为6.4%;第2个峰为0.1 mol/L NaCl洗脱峰(盐相),回收率为4.4%,记为LZJP2;第3个峰为0.3 mol/L NaCl洗脱峰(盐相),回收率为51%,记为LZJP3;第4个峰为0.5 mol/L NaCl洗脱峰(盐相),回收率为3.8%,记为LZJP4。其中第3、4个峰峰形挺拔,且第3个组分回收率较高。将酸性多糖LZJP3和LZJP4经透析、减压浓缩、乙醇沉淀、冷冻干燥后进行凝胶柱纯化。LZJP3和LZJP4的Sephadex-100凝胶柱层析均有一个峰(图6),则说明LZJP3、LZJP4都为单一的多糖组分,其回收率分别为81.7%和89.2%。

图5 DEAE-52洗脱曲线Fig.5 Elution prof i le of LZJP on DEAE-52 cellulose column
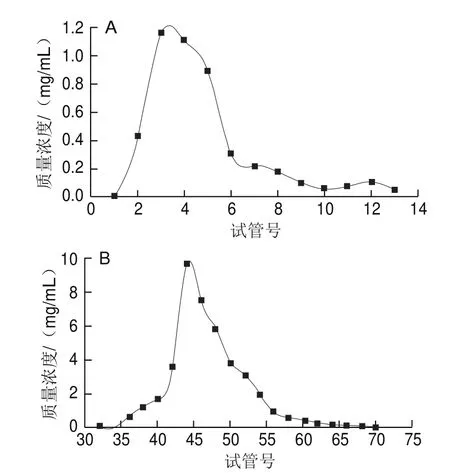
图6 LZJP3(A)与LZJP4(B)Sephadex G-100凝胶柱层析Fig.6 Elution prof i les of LZJP3 (A) and LZJP4 (B) on Sephadex G-100 column
2.4 多糖组分及结构分析
2.4.1 傅里叶变换红外光谱分析
傅里叶变换红外光谱显示4 000~600 cm-1呈多糖类物质的特征吸收峰。3 500~3 000 cm-1的特征峰是由分子间或分子内的OüH的伸缩振动引起的;如图7A所示,在3 438 cm-1处有强吸收峰,则LZJP3中存在分子间或分子内氢键;2 931 cm-1是糖类CüH(—CH2)的伸缩振动峰;1 743 cm-1处有一明显吸收峰,是醛基吸收峰,初步判断该糖上含有乙酰基;1 623 cm-1是-COOH的C=O吸收峰;1 400~1 200 cm-1处存在3 个吸收峰,这些吸收峰是CüH的变角振动;1 103 cm-1处有一明显吸收峰,该吸收峰为C-O键伸缩振动吸收峰;1 103、1 049 cm-1和1 016 cm-1处有3 个吸收峰,为吡喃糖苷的特征吸收峰;914 cm-1处为D-吡喃型葡萄糖的特征峰[28]。因此可推断该多糖为一种吡喃多糖。同样,图7B中,在3 425 cm-1处有强烈的吸收峰,则说明LZJP4中也存在分子间或分子内氢键;1 637 cm-1为C=O的吸收峰,1 342 cm-1为糖类CüH振角变动,885 cm-1是β-吡喃环CüH的弯曲振动特征峰[29],上述结果表明,LZJP3与LZJP4均为酸性多糖,且都为β-吡喃型多糖。

图7 LZJP3(A)与LZJP4(B)的傅里叶变换红外光谱图Fig.7 Fourier transform infrared spectra of LZJP3 (A) and LZJP4 (B)
2.4.2 多糖表面结构的观察
当分辨率为50 μm时,LZJP3和LZJP4扫描电子显微镜结果如图8所示。LZJP3多糖呈片状,表面形貌光滑但有破损(图8A),LZJP4为分枝状,表面呈现出干燥的褶皱状(图8B)。LZJP3与LZJP4在相同的视场范围(5 μm×5 μm)内获得的原子力显微图像稍有差异(图9)。LZJP3分子排列疏松,且大小形状均一(图9A),而LZJP4有少量的分子球状聚集体和大量的分散体,大小不均匀(图9B)。由图9A2、B2可知,LZJP3多糖的高度为117.19 nm,宽度为7.753 nm,LZJP4多糖的高度为117.19 nm,长度为7.750 nm。一个多糖分子的高度为0.3 nm,因此,LZJP3与LZJP4多糖分子的大小远高于多糖单链直径的理论值(0.1~1.0 nm)[30],可能是由于多糖分子间范德瓦耳斯力相互作用以及糖链间氢键缔合所致。

图8 扫描电子显微镜下LZJP3(A)与LZJP4(B)微观结构形态Fig.8 Scanning electron microscopic photographs of LZJP3 (A)and LZJP4 (B)
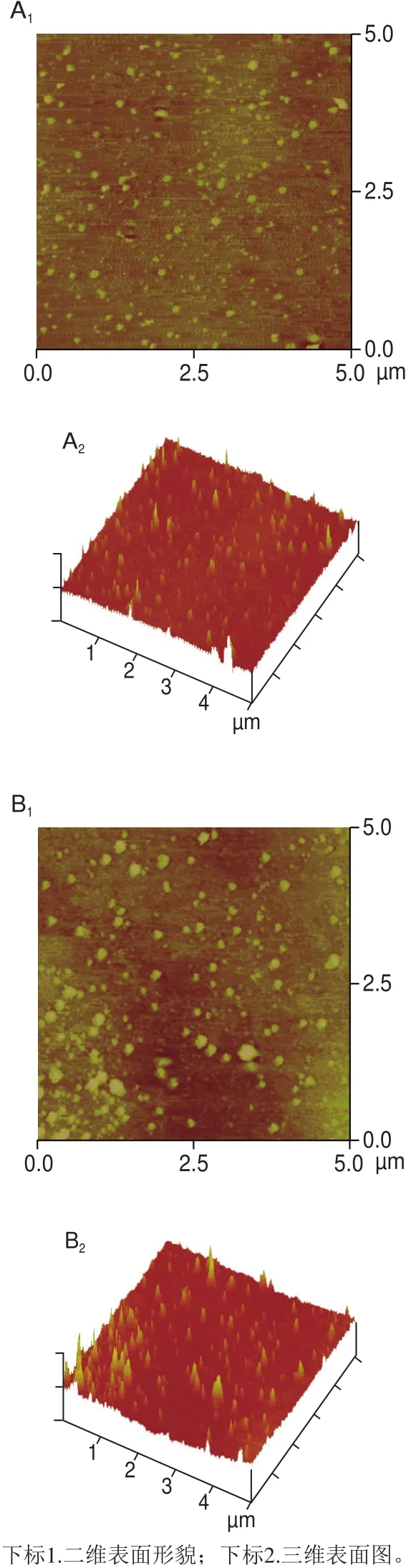
图9 LZJP3(A)与LZJP4(B)原子力显微镜扫描结果Fig.9 Atomic force microscopic photographs of LZJP3 (A) and LZJP4 (B)
3 结 论
以Fick第一定律为基础,建立了红枣多糖提取动力学模型,求得不同温度或料液比下的速率常数、相对萃余率、活化能和半衰期等关键动力学参数。结果显示实验数据与动力学模型计算值良好吻合,整个提取过程较为容易进行。
LZJP具有糖类化合物的特征,样品中仍有少量游离的氨基酸和蛋白质分子基团,且LZJP是一种多糖,不是淀粉类物质。LZJP经过离子交换柱DEAE-52分离纯化,得到4 个峰,其中LZJP3和LZJP4为主要单一多糖,回收率分别为81.7%和89.2%,均为浅黄色丝状物。
傅里叶变换红外光谱结果表明,LZJP3和LZJP4均为酸性多糖,且为β-吡喃型多糖。扫描电子显微镜结果表明,LZJP3多糖呈片状,表面形貌光滑但有破损,LZJP4为分枝状,表面呈现出干燥的褶皱状。原子力显微镜结果显示,LZJP3分子排列疏松,且大小形状均一,LZJP4有少量的分子球状聚集体和大量的分散体,大小不均匀。
