lncRNA NEAT1过表达促进破骨细胞分化并抑制成骨细胞分化诱发骨质疏松
2019-03-08洪宇桁
洪宇桁,雪 原
(1.天津医科大学医学影像学院,天津300203;2.天津医科大学总医院骨科,天津300052)
骨质疏松症(osteoporosis,OP)是好发于老年人的常见骨科疾病,其特征表现为骨量降低、骨组织显微结构发生改变[1]。据统计全球50岁以上发生骨折的女性中有1/3罹患骨质疏松,在男性中这一比例为1/5[1-2]。过去的30年间,我国骨质疏松症患者增加了3倍,达到了9千万人,数量已居世界首位[3]。目前OP的治疗药物分3类:基础药物(vitD、钙剂)、抗吸收药物和骨生成药物。这些药物虽然针对全身的骨质疏松,但前两类不具备诱导骨生成的能力且副作用较大。甲状旁腺激素 1-34(parathroid hormone 1-34,PTH1-34)虽然可以刺激骨生成,但却面临受体饱和及PTH分泌轴紊乱等问题[2]。因此,探究成骨机理,可为治疗或缓解OP提供新方法。
目前,越来越多的研究表明长链非编码RNA(long non-coding RNA,lncRNA)与很多疾病相关[4-11],但lncRNA在OP中的作用鲜见报道。NEAT1(nucle ar enriched abundant transcript 1)是定位在细胞核内的一个lncRNA,可以与一些核内蛋白结合形成亚核结构旁斑[12]。研究表明NEAT1在多种肿瘤中高表达,且参与肿瘤的进展[13-17]。然而,NEAT1在骨科疾病特别是在OP中的作用仍不清楚。本研究首次发现在OP患者的疏松骨组织中、小鼠的疏松股骨组织中以及RAW264.7细胞破骨分化过程中NEAT1过表达;而在MC3T3-E1和hMSC细胞成骨分化过程中NEAT1表达明显降低。碱性磷酸酶(alkaline phosphatase,ALP)染色显示敲低Neat1后成骨细胞活性显著增加,TRAP染色显示敲低Neat1后破骨细胞活性被明显抑制。本研究为NEAT1成为OP的潜在治疗靶点提供理论和实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验对象 MC3T3-E1细胞(小鼠前成骨细胞系)、RAW264.7细胞(小鼠单核巨噬细胞系)、hMSC(人间充质干细胞)均购自中国科学院细胞库。C57BL/6雌性小鼠购自北京维通利华实验动物技术有限公司。实验小鼠在天津医科大学实验动物中心繁育,所有的程序按照天津医科大学实验动物中心的操作规范流程进行。
1.1.2 主要试剂 DMEM高糖和MEMα培养基购自英潍捷基公司,逆转录试剂盒购自Thermo fisher公司,Trizol、SYBG 购自 Takara 公司,Recombinant Human sRANK Ligand购自派普泰克公司,抗坏血酸、β-磷酸甘油、地塞米松、茜素红染液和TRAP染液购自Sigma公司,ALP染色试剂盒购自碧云天公司。
1.2 研究方法
1.2.1 RNA的提取、逆转录和Real-time PCR用Trizol裂解细胞,震荡并室温静置3min后,12000 r/min离心30 min,吸取上层无色透明溶液并加入500 μL异丙醇混匀,-20℃静置过夜,次日12 000 r/min离心20 min后去掉上清,加入75%的乙醇洗涤沉淀,离心后弃上清,所得沉淀即为RNA,加入DEPC水溶解RNA。用DEPC水适当稀释RNA后,测定OD值,计算RNA纯度及产量。根据逆转录试剂盒说明逆转录合成cDNA,Real-time PCR采用 Roche的SYBR green染料说明指导,用LightCycler®仪器检测基因表达情况。homo NEAT1上游:CTTCCTCCC TTTAACTTATCCATTCAC;下游:CTCTTCCTCCACC ATTACC AACAATAC;musNEAT1上游:GGGAAGG GTGTGGTCAGAAG;下游:GGCAGGTTGGCTCCTAC AAT;homoALP上游:AACATCAGGGACATTGACGTG;下游:GTATCTCGGTTTGAAGCTCTTCC;mus ALP 上游:ACACCTTGACTGTGGTTACTGCTGA;下游:CCTT GTAGCCAGGCCCGTTA;mus Ctsk上游:GAAGAAG ACTCACCAGAAGCAG;下游:TCCAGGTTATGGGCA GAGATT;homoGAPDH 上游:ACCCAGAAGACTGTG GATGG;下游:TTCAGCTCAGGGATGACCTT;mus GAPDH上游:AGCAAGGACACTGAGCAAGA;下游:GGGTCTGGGATGGAAATTGT。
1.2.2 细胞培养与分化诱导 用含10%胎牛血清和1%双抗的MEMα培养基,在37℃和5%CO2条件下培养MC3T3-E1和hMSC细胞并传代。诱导成骨分化时在培养液中加入50 μg/mL抗坏血酸、10 mmol/L β-磷酸甘油和10-7mmol/L地塞米松,每两天换液一次。用含10%的胎牛血清和1%双抗的MEMα培养基,在37℃和5%CO2条件下培养RAW264.7细胞,诱导破骨细胞时在培养基中加入100 ng/mL的诱导因子RANKL,诱导时间为6 d,每2 d换液一次。
1.2.3 TRAP染色 将RAW264.7细胞铺于96孔板中,密度为每孔1.5×104个细胞。用含有100 ng/mL的RANKL的DMEM高糖培养基诱导培养6 d后进行抗酒石酸酸性磷酸酶(TRAP)染色。染色时移除细胞培养基后,用PBS洗3遍;4%多聚甲醛固定10 min,PBS洗 3遍;0.1%Triton X100 通透 10 min,PBS洗3遍;PBST孵育10 min;按照96孔板每孔100 μL的量加入新鲜的TRAP染色液,置于37℃烘箱反应1 h;向每孔加入100 μL PBS,显微镜下观察,含有3个及3个以上细胞核的细胞被视为破骨细胞并计数。
1.2.4 ALP染色 将诱导成骨分化7 d的细胞用4%多聚甲醛固定30 min,PBS洗3遍,按照试剂盒的说明配置成BCIP/NBT染色工作液,最后一次洗涤完成后,去除洗涤液,加入适量BCIP/NBT染色工作液,确保能覆盖住样品,室温避光孵育5~30 min至染色到预期深浅。去除染色工作液,用蒸馏水洗涤2次即可终止显色反应,显微镜下观察拍照。
1.2.5 慢病毒构建 设计并合成靶基因的siRNA序列,Mouse siNeat1-1:GGGUCAUCUUACUAGAUAATT;Mouse siNeat1-2 :GAUUGAAGCUUCUUAGAAATT。根据pSUPER的质粒图谱选择两个单一酶切位点(BglII和HindIII)。在20 μL体系中设置梯度退火程序,合成shRNA。退火产物取1 μL稀释150倍,充分混匀后取10 μL,用3%浓度琼脂糖凝胶电泳,鉴定其退火产物长度是否正确。用BglII和HindIII酶切pSUPER质粒,将pSUPER片段与退火shRNA连接,将pSUPER-shRNA转化DH5α感受态细胞,涂布有氨苄霉素的LB平板,37℃过夜培养;转天挑取单个菌落15~20个并留种,通过菌落PCR筛选阳性者摇菌过夜;使用康为公司的小抽质粒提取盒提取质粒,测浓度分装后-20℃保存;取提好的质粒用EcoRI和XhoI酶切2 h,在2%琼脂糖凝胶电泳后鉴定,酶切片段长度为300 bp即为构建好的阳性质粒(阴性为空白载体酶切片段长度是240 bp);挑3个阳性质粒送invitrogen公司测序。将277质粒分别用EcoRV和XhoI酶切1h,得到线性质粒277;同时用EcoRI酶切pSUPER-shRNA,并用T4 DNA聚合酶处理酶切产物,XhoI酶切90 min后,再进行3%浓度琼脂糖凝胶电泳,得到300 bp包含shRNA的条带,切胶回收;连接线性277和shRNA,将产物转化DH5α感受态细胞,菌落PCR鉴定,小抽质粒提取盒提取质粒,酶切鉴定(BamHI和Xhol酶切),阳性酶切片段长度为800 bp,空载体酶切片段长度是500 bp;挑选3个阳性质粒送金唯智公司进行测序,得到合适序列的277-shRNA。
1.2.6 卵巢去势致骨质疏松模型 选用3个月龄的健康雌性C57BL/6小鼠,实验室常规喂养1周。2%戊巴比妥钠(40mg/kg)腹腔麻醉,取俯卧位,术区剃毛,碘酒乙醇消毒。选背侧入路,在小鼠髂嵴顶部外上方1 cm左右,腰椎骶棘肌两侧做纵向切口长约0.8 cm,打开后腹膜,切除双侧卵巢,清理伤口后分两层缝合皮肤和基层。卵巢为深粉红色颗粒状组织,多被其周围脂肪组织所掩盖,术中需拨开这些组织,方能将其显露。对照组手术方法与实验组相同,但打开腹腔后不切除卵巢。术后正常饮食,6个月即可建立骨质疏松模型。
1.2.7 鼠尾悬挂致骨质疏松模型 选用6周龄的健康雌性C57BL/6小鼠,实验室常规喂养1周。采用小鼠尾部悬吊法,将小鼠单笼饲养,尾部悬吊,前肢着地,后肢悬空,身体长轴与水平面呈30°,使其在笼内能自由活动,进食进水,28 d即可建立骨质疏松模型。
1.3 统计学方法 运用统计软件SPSS17.0进行数据处理,计量资料均以±s表示,样本间均数的比较采用单因素方差分析(one-way,ANOVA)的方法进行比较。所有统计结果以P<0.05为差异有统计学意义。
2 结果
2.1 正常骨组织和骨质疏松症患者骨组织中NEAT1的转录本 从天津医科大学总医院收集了手术切除的正常骨组织和骨质疏松症患者的疏松骨组织各6例,提取总RNA后进行Real-time PCR,结果显示骨质疏松症患者骨组织中NEAT1的转录本高于正常骨组织,差异具有统计学意义(P<0.05)(图1)。
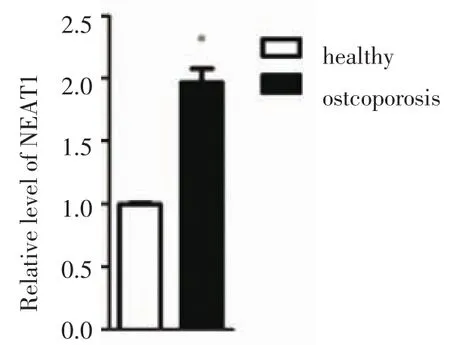
图1 正常骨组织和骨质疏松骨组织中NEAT1的转录本Fig1 ThetranscriptofNEAT1innormalandosteoporoticbonetissue
2.2 卵巢去势(OVX)和鼠尾悬吊(TS)诱导的骨质疏松小鼠模型的疏松股骨中Neat1的表达改变 将正常对照小鼠、卵巢去势(OVX)6个月后以及鼠尾悬吊(TS)21 d后的小鼠分别处死取股骨组织,提取总RNA后进行Real-time PCR。实验结果表明,与对照相比,OVX6个月以及TS 21 d后成骨相关基因Alp的表达量显著降低,而Neat1的表达水平升高(图2),差异具有统计学意义(P<0.05)。
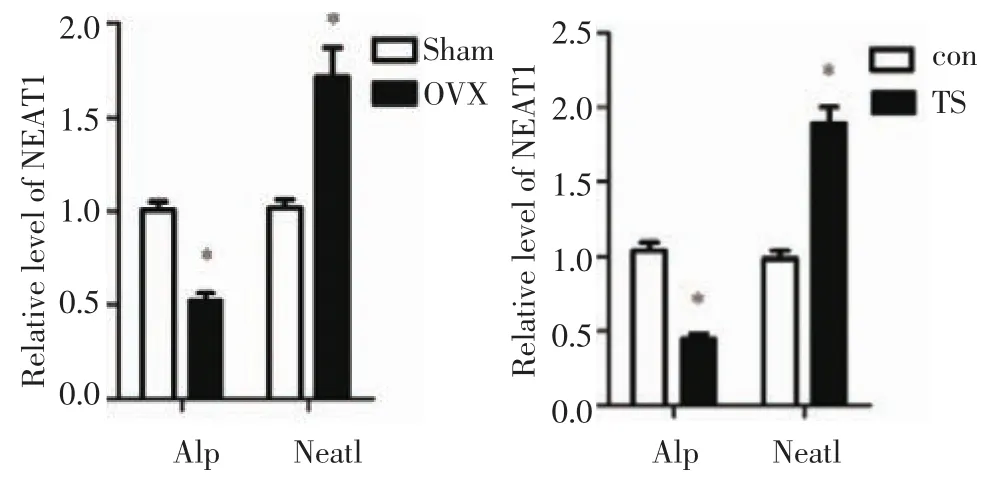
图2 卵巢去势和鼠尾悬吊诱导的小鼠疏松股骨中Neat1的表达Fig 2 The expression ofNeat1 and Alp in theosteoporotic femur of the model mouse
2.3 成骨细胞分化过程中NEAT1的表达变化 在hMSC以及MC3T3-E1细胞的培养液中添加成骨分化诱导因子10 nmol地塞米松、10 mmol β-甘油磷酸钠、50μg/mL抗坏血酸,每隔2d换液,诱导第18天后检测ALP和NEAT1的表达改变。实验结果表明,与对照组相比hMSC和MC3T3-E1成骨分化后ALP表达量显著增多,而NEAT1的表达量明显降低(图 3),差异具有统计学意义(P<0.05)。
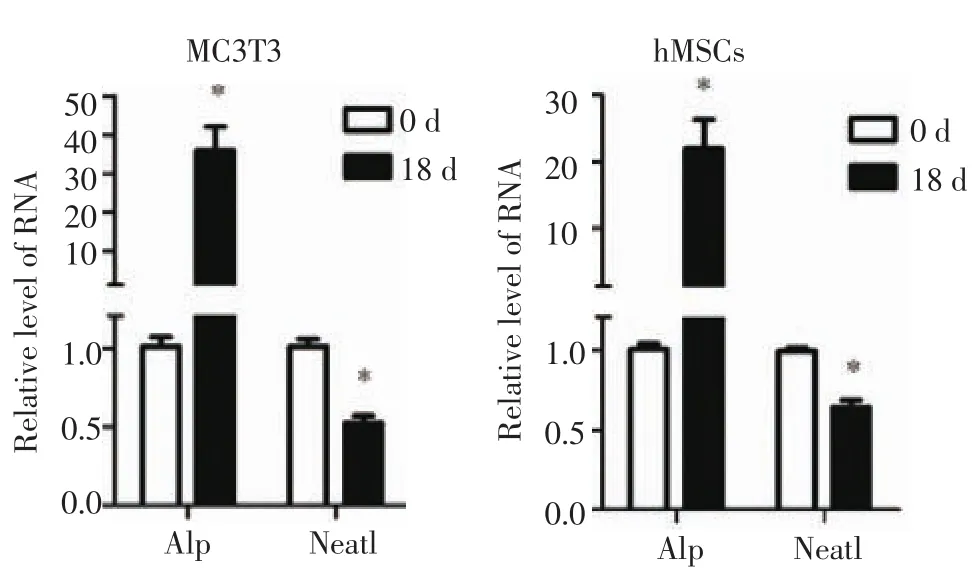
图3 成骨细胞分化过程中NEAT1的表达Fig 3 The expressions ofNEAT1 and ALPduring osteogenic differentiation
2.4 破骨细胞分化过程中Neat1的表达变化 在RAW264.7细胞的培养液中添加100 ng/mL的诱导因子RANKL,每两天换液。诱导6 d后检测破骨基因Ctsk和Neat1的表达改变。实验结果表明,与对照组相比,RAW264.7细胞在诱导破骨分化后Ctsk和Neat1的表达量均显著增多(图4),差异具有统计学意义(P<0.05)。

图4 破骨细胞分化过程中Ctsk与Neat1的表达Fig 4 The expressionsofCtskand Neat1 during osteoclast differentiation
2.5 下调Neat1对成骨细胞分化的影响 在成骨诱导第4天的MC3T3-E1细胞中感染敲低Neat1的慢病毒或对照慢病毒,72 h后Real-time PCR检测Neat1及Alp的表达改变。实验结果表明敲低Neat1后,与对照组相比细胞中Alp的表达水平增多,差异具有统计学意义(P<0.05)。ALP染色的结果进一步证实敲低Neat1后ALP的活性增高(图5),说明Neat1可抑制MC3T3-E1细胞向成骨方向分化。
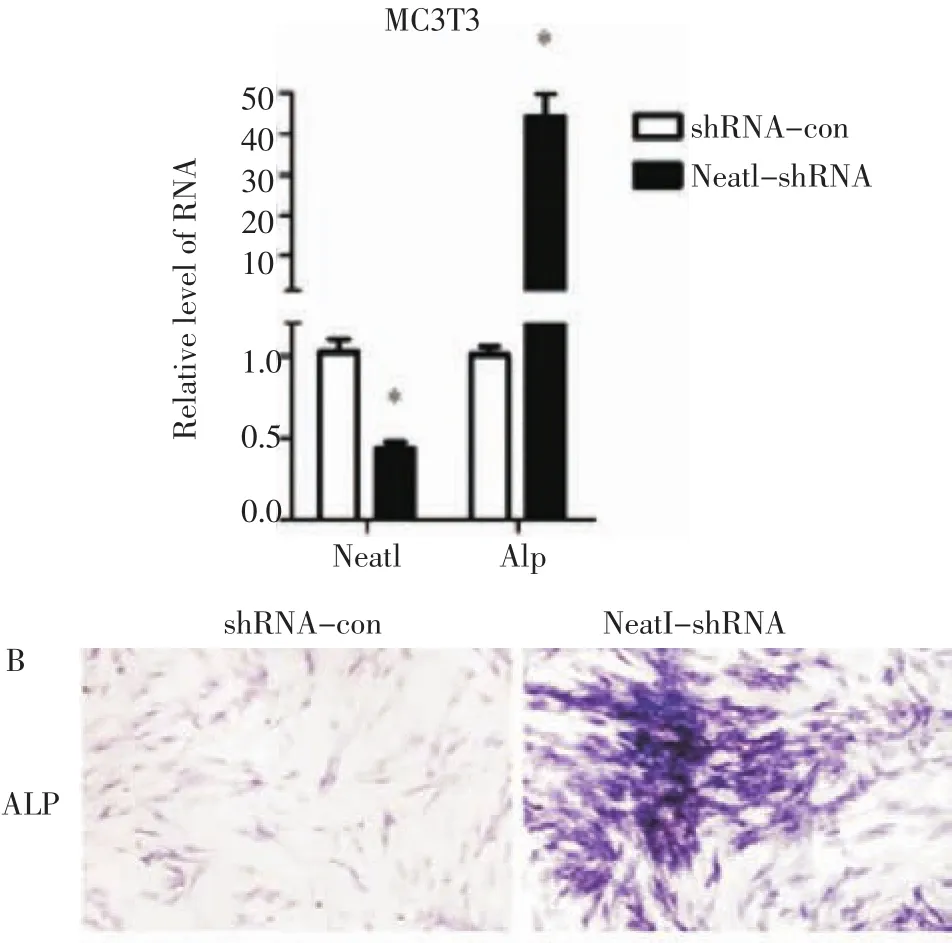
图5 沉默Neat1对成骨活性的影响Fig 5 The effect of silencing Neat1 on osteogenic differentiation.qPCR was performed to detect the Neat1 and Alp when Neat1 was silenced(A).ALP staining was performed after silencing Neat1(B).
2.6 下调Neat1对破骨细胞分化的影响 在诱导破骨第3天的RAW264.7细胞中感染敲低Neat1的慢病毒或对照慢病毒,72 h后Real-time PCR检测Neat1及Ctsk的表达改变。实验结果表明敲低NEAT1后,与对照组相比细胞中Ctsk的表达水平降低,差异具有统计学意义(P<0.05)。TRAP染色的结果进一步证实敲低Neat1后破骨细胞活性减低。表明Neat1可促进RAW264.7细胞向破骨方向分化(图 6)。

图6 沉默Neat1对破骨活性的影响Fig 6 Silencing Neat1 influences osteoporotic differentiation.qPCR was performed to detect the Neat1 and Ctsk when Neat1 was silenced (A).TRAP staining was performed after silencing Neat1(B)
3 讨论
骨的生长主要表现为成骨分化作用的增强及破骨分化作用的减弱。骨质疏松症主要是由于成骨分化作用的减弱,而破骨分化作用的增强所导致[1]。因此,针对能够靶向成骨和破骨分化活性的基因进行研究具有十分重要的意义。先前的研究主要集中在编码蛋白的基因上,研究表明成骨和破骨分化调节是一个有多种细胞因子和多条信号通路共同参与的复杂过程。TGF-β通路、BMP2通路、Wnt通路、Notch通路、Hedgehog通路、MAPK 通路、PTH通路等众多细胞信号通路交互影响,共同介导成骨和破骨分化过程,从而调节骨质疏松症的病理过程[18]。近年来,一些研究表明miRNAs在包括骨质疏松症在内的多种疾病中发挥重要的作用,与miRNA相比,在细胞内转录比例更高的lncRNAs更具有极其复杂而重要的生物学功能,从而不再认为它是“暗物质”,其功能和作用机制也越来越受关注[19]。
近年来大量的研究显示,lncRNAs可以从转录和转录后水平参与调控蛋白质编码基因,例如参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等多种重要的调控过程。此外lncRNAs的异常表达与人类疾病相关,例如肝纤维化、阿尔茨海默病(AD)、心血管疾病、糖尿病和癌症等[4-11]。然而,lncRNAs在骨科中的研究主要集中在骨肿瘤,有关lncRNA在成骨和破骨分化过程中的作用尚缺乏深入的研究。目前发现的在成骨分化过程中异常表达的lncRNAs有MIR31HG、H19、MEG3、MAIT 和 NONHSAT009968[20-24]。MIR31HG可直接与IκBα结合并激活NF-κB通路,形成一个正反馈环,从而抑制成骨分化[23]。而H19促进成骨分化主要是通过ceRNA的机制竞争结合miR-141和miR-22,从而激活Wnt/β-catenin通路并促进成骨分化[24]。目前尚未见lncRNA-NEAT1与OP及成骨和破骨分化相关的研究。本研究首次发现了NEAT1在OP患者的疏松骨组织中、小鼠的疏松股骨组织中以及MC3T3-E1和hMSC成骨分化过程中表达明显降低;而在RAW264.7破骨分化过程中表达明显增多,提示NEAT1参与调节成骨与破骨分化及骨质疏松症。NEAT1又称为MENε/β,它是从人类第11号染色体由RNA聚合酶Ⅱ转录而来,具有多聚腺苷酸尾。NEAT1主要定位在细胞核内的亚核结构旁斑上,其参与旁斑的形成[12]。研究发现NEAT1在神经胶质瘤中显著上调,其通过ceRNA的机制抑制miR-449-5p对致癌基因c-Met的作用,从而促进胶质瘤细胞的增殖、转移和侵袭[25]。此外,NEAT1在肝细胞癌、前列腺癌以及乳腺癌中表达同样显著增高,且与这些肿瘤的转移、预后密切相关[13-18]。在本研究中,我们通过构建敲低NEAT1慢病毒载体,随后用Real-time PCR结果证实了在小鼠前成骨细胞系MC3T3-E1和人间充质干细胞hMSC中敲低NEAT1后引起ALP mRNA水平明显升高。同时ALP染色也证实敲低NEAT1促进成骨活性。而在小鼠巨噬细胞系RAW264.7中敲低NEAT1可引起破骨细胞标志物基因Ctsk表达降低,TRAP染色结果证实敲低NEAT1抑制破骨活性。以上结果说明NEAT1促进破骨细胞分化并抑制成骨细胞分化,为NEAT1成为治疗骨质疏松症的潜在靶点提供了一定的理论基础和实验依据。
