系统性老年性淀粉样变患者血清转甲状腺素蛋白出现三种修饰基团减少
2019-03-08赵莉逦刘晓丹PUREVDORJNarangerel孙续国
赵莉逦,刘晓丹,PUREVDORJ Narangerel,王 然,李 蕾,孙续国
(天津医科大学医学检验学院临床检验和血液教研室,天津300203)
转甲状腺素蛋白(transthyretin,TTR),是肝脏分泌的一种具有转运甲状腺素、视黄醇的功能性蛋白,是在老年性系统性淀粉样变(senile systemic amyloidosis,SSA)[1]及家族型多发性神经性损害(familial amyloidotic polyneuropathy,FAP)[2-3]等疾病淀粉样变的前蛋白。通过分析SSA患者发生TTR相关淀粉样变沉积组织特点[4],发现淀粉样变主要沉积于心脏组织[5-6]、中枢神经[7]、血管壁等,但是这些组织细胞非均表达、分泌TTR蛋白[8-9]。大量研究表明SSA患者组织器官沉积的淀粉样变的前蛋白成分为TTR蛋白[10-12],由于TTR为机体内存在的一
种生理蛋白,形成淀粉样变后可以沉积于人体的组织器官导致器官损害及功能障碍。探究淀粉样变相关蛋白的代谢修饰可能有助于解析SSA淀粉样变形成的分子机制。前期本组利用基质飞行质谱技术(MALDI-TOF-MS)建立直接分析血液中TTR蛋白修饰的方法[13-14],并且最近有报道ProteomeLab PF-2D技术分析蛋白等电点的变化[15-16],利用两项结合可以分析SSA患者TTR蛋白的化学修饰类型,辅助解析SSA患者形成淀粉样变的分子机制。
1 材料与方法
1.1 患者标本收集 收集30位健康的志愿者以及经临床影像和病理诊断为SSA的患者的血清。
1.2 血清总蛋白、白蛋白、TRR定量 根据操作指导,应用TOSHBA-120RF全自动生化分析仪测定人血清总蛋白和白蛋白含量,用UniCelDxI 800来检测血清TTR。
1.3 蛋白分离 首先,根据操作说明将高效聚焦层析柱用于蛋白质分离。缓冲液以0.2 mL/min的流速平衡130 min,之后手动将样本用注射器推入层析柱内。在第一相中,蛋白与强阴离子交换剂交换,并从pH 8.5到4.0范围内进行连续洗脱。40~45 min后,pH开始下降。以间隔0.2个单位的pH值在48孔深孔板中收集蛋白。应用高效反相梯度分离蛋白,并在第二相将其分离。
1.4 免疫印迹法检测TRR 将从层析柱中收集得到的蛋白溶解在2.0 μL溶液中,然后转至硝酸纤维素薄膜上,并用兔抗人TTR抗体孵育1 h。应用抗兔第二抗体孵育结合后检测结果。
1.5 检测硫磺素(ThT)标记的淀粉样纤维荧光强度 取5 μL血清,向其中加入200 μL 50 mmolThT缓冲液(pH 8.5,sigma),37°C孵育1 h后检测。
1.6 利用 UPLC-Q-TOF/MS(Waters,America) 分析TTR蛋白的化学修饰[17]WatersACQUITYUPLC分系统,蛋白分离柱为BEH C18(2.1×100 mm,1.7 μm),利用 0.1%methanoic acid acetonitrile(solvent A)和0.1%methanoic acid(solvent B)试剂按照仪器操作说明仔细操作。质谱用仪器内标分子为:Leucineenk ephalin(LE),C28H37N5O7 TyrGlyGlyPheLeu(M+H)+M/Z 556.2771,(M-H)-M/Z 554.2615.[Glu1]-Fib rinopetideB(GluFib),C66H95N19O26GluGlyValAs nAspAs nGluGluGlyPhePheSerAlaArg,(M+H)+M/Z 1570.6774,(M+2H)2+M/Z 785.8426,(M-H)-M/Z 1568.6618ESI。
1.7 统计学方法 采用SPSS 13.0软件分析数据。数据用±s表示。两组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床收集SSA患者的基础资料 依据SSA临床诊治指南,收集SSA患者30例,同时收集年龄与性别相匹配的健康体检志愿者30名。发现SSA患者与健康志愿者在3项指标中无显著性差异(P>0.05)。结果见表1。

表1 患者的临床特征Tab 1 Clinical characteristics of patients
2.2 利用PF-2D系统分析SSA及志愿者人群血清各个pI区域的蛋白丰度 利用PF-2D分析系统,分选各个等电点的蛋白质,两项电解质的pH分别为pH4.0及pH8.0。利用波长208 nm直接检测蛋白的相对强度,以每0.2pH为一个样品采集点,采集各个pI点的蛋白质。SSA患者结果在pH8.1~pH8.0、pH 6.42范围、pH 5.69范围及pH 4.49范围内存在高蛋白丰度(图 1a,b,c,d)。同样分析方法分析健康志愿者,结果在 pH 8.1~pH 8.0,pH 6.51 范围、pH6.18 范围及 pH 4.49 范围发现高丰度蛋白(图 1a,b,c,d)。
2.3 进一步分析SSA及志愿者TTR蛋白的pI为分析各个pH值范围内可存在TTR蛋白,利用点免疫印迹的方法鉴定TTR的存在,结果在pH6.8-pH5.8范围及pH 4.0-pH 4.5范围发现高丰度TTR蛋白(图 1)。
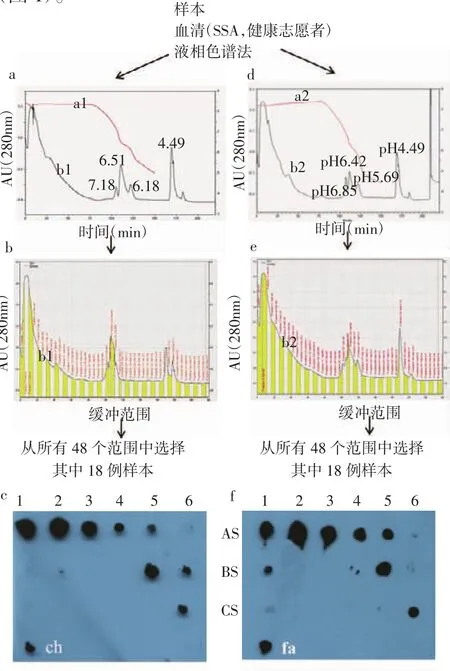
图1使用ProteomeLab PF-2D系统对SAA患者和健康志愿者血清蛋白进行色谱分析Fig 1 Chromatographic analysis of serum proteins of SAA patients and healthy volunteers using ProteomeLab PF-2D
2.4 利用ThT测定各个部分收集液中淀粉样变的强度 利用ThT荧光试剂为一种可以检测淀粉样变成分含量的一种特异性试剂,可以分析被检测部分淀粉样变成分的浓度,结果见表2,SSA患者pH6.40~pH6.60范围内,淀粉样变成分显著高于对照组。

表2 血清淀粉样蛋白在每段pH范围形成的荧光强度Tab 2 The fluorescence intensity of serum amyloid formation in each pH fraction
2.5 利用MALDI-TOT-MS分析TTR蛋白的化学修饰 对上述各个部分的TTR均进行质谱分析,TTR蛋白发生的修饰类型结果见表3及图2。对于利用质谱技术解析TTR蛋白发生化学修饰类型及发生位点,其标记结果见图3。

表3 血清TTR在每段pH范围中的修饰Tab 3 The serum TTR modification in each pH fraction

图2 SSA患者和健康志愿者的TTR修饰鉴定Fig 2 Identification of the TTR modification in those collected fraction in SSA patients and Healthy volunteers
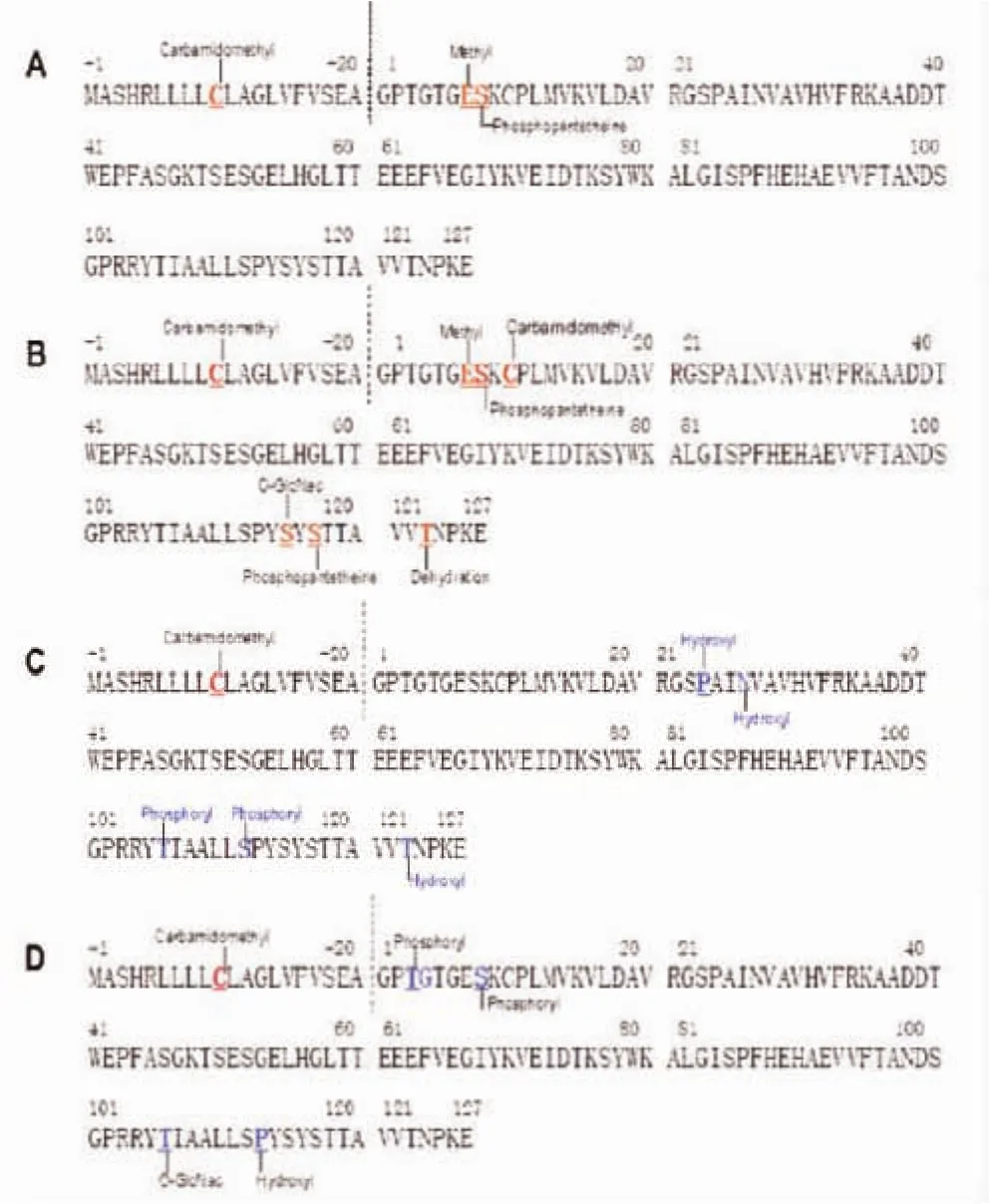
图3 TTR氨基酸位点修饰组化学结构总结Fig 3 Summarizing chemical structure of the modified group in TTR amino acid sites
3 讨论
TTR蛋白的野生型(w-TTR)及发生基因突变的突变型(m-TTR)均可发生淀粉样变沉积,突变型TTR形成淀粉样变沉积发生于FAP患者,并且在杂合子FAP患者中约50%沉积的淀粉样变为w-TTR,说明野生型TTR也能够形成淀粉样变沉积[10]。
最近有学者利用PF-2D系统分选蛋白,而淀粉样变蛋白研究的难点是在分析过程中不能改变相关蛋白分子结构,根据我们掌握的文献,利用PF-2D分析淀粉样变蛋白尚未见报道[18-19],本论文依据蛋白pI的分选系统收集SSA患者及健康志愿者血清,确实发现在 pH 8.1~pH 8.0范围、pH 6.8~pH 5.8范围以及pH 4.0~pH 4.6范围存在高丰度蛋白,这些蛋白是否存在TTR蛋白有待于进一步鉴定。
为进一步鉴定TTR蛋白存在的范围,采用抗人TTR抗体,点免疫印迹的方法鉴定TTR蛋白存在的部分,结果在pH8.0~pH8.1范围,SSA患者与志愿者人群均存在大量TTR蛋白。在pH 6.8~pH 5.8范围及pH 4.0~pH 4.6范围中,SSA患者与健康志愿者存在高丰度的pI发生改变,SSA患者在pH6.42范围明显增高,并且化学修饰类型发生改变,定量分析淀粉样变沉积成分定量也发现明显高于健康志愿者。SSA患者TTR与健康志愿者的TTR蛋白为w-TTR,即两组TTR蛋白质的氨基酸顺序、类型没有改变,两组TTR蛋白的pI应当相同,造成已经pI能够分选TTR蛋白的理论基础是TTR蛋白发生化学修饰,实验结果也显示TTR蛋白存在于不同的pH范围之内,说明TTR蛋白在人机体内能够发生化学修饰,以前也有报道TTR蛋白存在2个不同的pI,支持本实验结果。
总结上述实验发现SSA患者及健康志愿者血清TTR蛋白均存在化学修饰,但是SSA患者TTR蛋白在pI 6.42范围发生修饰的类型与健康志愿者不同,且淀粉样变成分含量显著高于对照组,提示机体代谢过程中TTR蛋白可发生化学修饰,其修饰类型与淀粉样变形成的相关性有待进一步研究。
(致谢感谢王卓伟在UPLC-MS/MS技术上的帮助)
