CCR7在肿瘤中的研究应用进展
2019-03-08郑炎焱林一均缪一艇杨晓国谢璟姚琼
郑炎焱 林一均 缪一艇 杨晓国 谢璟 姚琼
趋化因子及其受体在肿瘤侵袭和转移中扮演着重要的角色,且越来越多的研究者猜想趋化因子及其受体存在间接或直接地调控肿瘤细胞侵袭和转移。而目前研究比较多的趋化因子19(CCL19)与趋化因子21(CCL21)及其受体7(CCR7)已经被证实参与膀胱癌、乳腺癌等多种恶性肿瘤的侵袭与转移。并且CCR7被证实在多种恶性肿瘤细胞中呈高表达。本文旨在对CCR7结构、功能以及其在肿瘤发生、发展过程中的调控等方面的研究作一综述。
1 CCR7的概念
趋化因子是一类细胞因子或细胞分泌的信号蛋白家族,分子量约为8~12 kd的可溶性小分子蛋白质,作为化学诱导物可诱导细胞的迁移[1]。CCR7是一种G蛋白偶联受体,在多种淋巴组织中表达。趋化因子通过与CCR结合从而发挥趋化调节作用[2]。研究表明,肿瘤是由慢性炎症灶发展而来的,在异物和组织损伤的刺激下促进细胞增殖[3]。单纯的细胞增殖并不会引起肿瘤的发生,在大量的炎症细胞、丰富的生长因子及DNA损伤因子的作用下,向癌症转变的风险增加。肿瘤的炎症刺激、生长及迁移是一系列高度复杂的过程,需要多种受体参与其调节过程。在正常生理情况下,CCR7可激活T、B淋巴细胞,参与T淋巴细胞归巢,影响淋巴结和脾脏以及脾脏内T淋巴细胞的运输,刺激树突细胞的成熟[4]。在病理情况下,可出现CCR7的异常表达,在炎症过程中,趋化因子与其受体结合诱导白细胞向炎症部位移动;在肿瘤发生、发展过程中,CCR7可促进肿瘤细胞的侵袭及迁移,因而在肿瘤发生、发展过程中扮演重要角色[5]。
2 CCR7结构
CCR7由3个外显子序列组成,基因定位于17号染色体长臂第2区1带,如图1所示[6]。

图1 CCR7基因定位
CCR7是一个具有七次跨膜结构且与异源三聚体G蛋白偶联的受体蛋白,由378个氨基酸组成,主要定位于细胞膜,其蛋白结构如图2所示。位于跨膜域3尾端的蛋白二级结构单元DRY模体在受体的激活和G蛋白的偶联过程中起着重要作用。DRY模体的精氨酸与跨膜域6形成“离子锁”,与β肾上腺素受体相互作用偶联G蛋白。
3 CCR的功能
3.1 参与炎症反应 早在1863年已经有研究者猜测,肿瘤是由慢性炎症灶发展而来的,在异物和组织损伤的刺激下导致炎症的发生,继而促进了细胞的增殖。CCR7偶联的G蛋白有三个亚单位(α、β、γ),趋化因子与受体结合解离G蛋白,α、β、γ亚单位组装成二聚体负责钙的转运和激活Rho GTP酶及磷脂酰肌醇(-3)激酶(PI3K)信号通路。G蛋白根据α亚单位特性分为 4 类(αs、αi、αq 及 α12/13)[7],CCR 根据偶联的 G 蛋白不同实现对不同信号通路的激活及不同生物功能的调控[8]。趋化因子CCL19与CCL21诱导CCR7阳性细胞向细胞组织迁移,保持体内CCR7阳性细胞的稳态。趋化因子具有高度特异的趋化作用,主要通过招募特异的白细胞来参与炎症反应[5]。
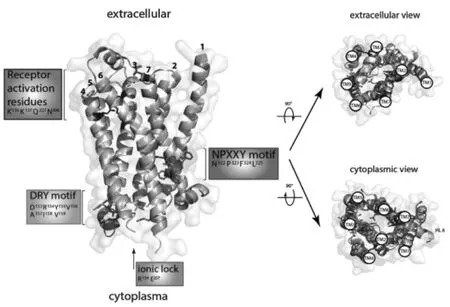
图2 CCR7蛋白三维结构
3.2 参与肿瘤的发生、发展过程 研究者最早在T淋巴细胞和自然杀伤性细胞功能缺陷的小鼠中发现,小鼠成瘤后出现局部的炎性浸润灶,暗示肿瘤细胞能释放趋化因子或可能诱导邻近细胞释放趋化因子[9]。现在普遍认为肿瘤组织中趋化因子与受体发生明显的改变,趋化因子能影响肿瘤细胞对白细胞的募集作用进而影响炎症的进展过程[10]。
肿瘤细胞能侵袭邻近组织、静脉系统或淋巴系统,并在其中增殖形成新的肿瘤灶[11]。已经有多个实验证实趋化因子及其受体(CCR7)在肿瘤细胞的侵袭过程中起作用[12]。
趋化因子及受体还参与血管生成和肿瘤转移[13]。血管生成受到机体严格控制,如伤口愈合时会启动。当肿瘤在机体内增殖时,需要生成血管为肿瘤内部提供血供和营养,肿瘤细胞可沿血流转移至其它组织或器官。如趋化因子CXC因修饰位点不同,发挥血管生长因子和血管生成抑制因子作用[14]。
4 CCR7与肿瘤
4.1 CCR7在乳腺癌中的表达 研究显示,多种乳腺癌细胞中CCR7呈阳性表达,免疫组化法分析发现CCR7在乳腺癌组织中相比癌旁组织表达显著上调[12],而在三阴性乳腺癌中CCR7可作为肿瘤转移的标志物,并且与淋巴结转移及预后密切相关。CCR7促进干细胞样肿瘤细胞的增殖从而参与了肿瘤的形成,通过抑制乳腺癌细胞的凋亡,降低肿瘤细胞对凋亡相关蛋白的敏感性[15]。
除此之外,CCR7协同或抑制其他蛋白从而发挥在乳腺癌中的作用,如CCL21通过激活CCR7阳性细胞中的胞内PI3K及丝裂原活化蛋白激酶(MAPK)通路从而促进其迁移[16-17];在淋巴结阳性转移患者中观察到NF-κB通路的激活,刺激细胞因子的分泌进而通过CCR7受体促进肿瘤的转移[18]。而有些MicroRNA如let-7a对CCR7有抑制作用,let-7a通过靶向作用于CCR7抑制其表达进而发挥抑制乳腺癌细胞的迁移与侵袭的功能[19]。由此可见,在组织中CCR7的表达对于乳腺癌的生长、转移及预后,指导其临床治疗具有重要的意义。
4.2 CCR7在肺癌中的表达 研究显示,肺腺癌细胞系中均检测到CCR7的表达,通过实验进一步发现CCR7通过影响细胞凋亡与细胞周期进而调节肺癌细胞的增殖能力。CCR7与肺癌的淋巴结转移高度相关,其配体CCL21能促进腺癌人类肺泡基底上皮细胞(A549)的迁移[20]。CCR7还通过促进蛋白激酶1/2(ERK1/2)信号通路,上调特异蛋白-1、基质金属蛋白酶9(MMP-9)及血管内皮生长因子-D的表达,增强肺癌细胞的迁移与侵袭能力[21]。由此,提示CCR7在肺癌侵袭、转移过程中的重要作用。有报道显示,利用siRNA沉默CCR7,抑制CCR7上游的蛋白如低氧诱导因子、血管内皮生长因子-C实现对CCR7表达的抑制,从而抑制肺癌细胞的增殖与迁移[22]。可见,检测CCR7的表达及其定向沉默对指导治疗肺癌具有重要价值。
4.3 CCR7在白血病中的表达 研究发现,经全基因组序列分析,成人T淋巴细胞白血病(ATL)患者尤其是高度恶性的患者中存在CCR7的变异,从而导致ATL患者治疗困难、预后差等问题[23]。而通过对比慢性淋巴细胞白血病(CLL)患者与正常组的单核苷酸多态性,发现6个与CLL高度相关且高风险的基因变异位点。急性淋巴细胞白血病(ALL)患者其CCR7表达水平高于急性髓细胞白血病患者。同时,CCR7的表达水平与非霍奇金淋巴瘤的恶性程度、分期、分级、淋巴结转移相关[24]。
在ALL患者体内,CCR7与Zeta链辅助蛋白70高度相关,能反映ALL的中枢转移风险[25]。CCR7受IFNα调控,Toll样受体2及B淋巴细胞受体能诱导肿瘤细胞向CCR7的配体CCL21处转移[26]。CCR7还受各种信号通路的调控,如PI3K、Rho鸟苷酸三磷酸化酶及MAPK,激活CCR7从而促进CLL的转移和发展。Cuesta-Mateos等[27]开发了针对CCR7的单克隆抗体,治疗高危且对氟达拉滨耐药的CLL患者,实验发现该抗体能有效特异杀伤CLL细胞,临床治疗优于阿伦单抗。
4.4 CCR7在胃癌中的表达 在胃癌中,CCR7影响胃癌细胞的上皮细胞-间充质转化(EMT)进程,促进肿瘤细胞的迁移与侵袭能力,上调转化生长因子β(TGF-β)和锌指转录因子Snail的表达,进而调控下游转录因子NF-κB及细胞外调节蛋白激酶ERK等信号通路,促进胃癌细胞的转移能力[28]。MiR-let-7a及合成过程中参与的基因Dicer 1负向调控CCR7的表达[29]。同时,研究显示CCR7与胃癌预后高度相关,高表达CCR7的患者预后不良[30]。
4.5 CCR7在结直肠癌中的表达 研究显示,高表达CCR7通过上调MMP-9的表达,促进结直肠癌细胞的迁移,且CCR7在结直肠癌中与转移、病理分级及预后相关[31]。利用siRNA沉默CCR7的表达,抑制结直肠癌增殖及侵袭能力,为结直肠癌的治疗提供新的思路[32]。
4.6 CCR7在黑色素瘤中的表达 在黑色素瘤中,CCR7与黑色素瘤的预后相关。研究者通过分析临床患者的基因表达谱、有丝分裂指数、定量肿瘤浸润的白细胞及肿瘤转移灶中的CD3阳性细胞,了解黑色素瘤的分子表型及其与预后的关系,为临床判断黑色素瘤患者的预后情况提供一定依据[33]。通过免疫疗法,利用树突细胞制作肿瘤相关疫苗,促进特异性的T淋巴细胞对黑色素瘤细胞的杀伤作用[34]。另外,利用CCR7配体CCL21的抑制剂(如Chemotrap-1)与CCL21竞争性结合抑制肿瘤的迁移,为治疗黑色素瘤的转移提供一定依据[35]。
5 小结
CCR7及其配体的研究是近年来被认为在调节肿瘤生长、转移过程中的重要分子,在临床治疗中的应用也受到越来越多的关注[36-39]。但目前还有许多问题尚未解决,首先,CCR7是影响肿瘤生长、转移的重要分子但不是唯一分子,临床也发现TGF、TNF等也与肿瘤的发生、发展密切相关,而CCR7与其他分子的关系有待进一步研究;其次,针对CCR7为靶点的特异性抗癌药物的研究目前还不十分清楚,有待进一步研究。在未来的一段时间,CCR7仍将是多个学科研究的热点问题之一。
