miR-21降解PTEN影响香烟提取物诱导的PASMCs的增殖与迁移
2019-03-05金光军周冰之张建成
金光军 周冰之 张建成
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发病过程中会伴随血管痉挛、肺血管重塑及肺血栓等症状,从而导致肺血管阻力加强产生肺动脉高压(pulmonary artery hypertension,PAH)[1]。研究表明,在PAH的发病过程中,肺血管内皮细胞、平滑肌细胞的过度增殖引起的血管重塑是肺动脉高压疾病发病的重要缘由[2]。
近年来研究表明吸烟可导致肺血管重构,其主要机制可能是吸烟产生的烟雾促使人的肺动脉平滑肌细胞(human pulmonary artery smooth muscle cells,HPASMCs)的状态发生改变后产生异样增殖并向内膜迁移[3~5]。微小RNA (microRNA,miRNA)是一种非编码RNA约为22~28个核苷酸长,在真核生物中广泛存在[6]。miRNA的异常表达与平滑肌的生理状态及PAH有着紧密的关联[7~9]。已有研究发现,miRNA-21可通过负调控PTEN(gene of phosphate and tension homology deleted on chromsome ten)的表达量,影响PASMCs的增殖和凋亡[10]。PTEN作为抑癌基因,可以使磷脂酰肌醇(3,4,5)-三磷酸[phosphatidylinositol(3,4,5)-t risphosphate, PIP3]去磷酸化来抑制PI3K/AKT 通路[11~14]。笔者初步研究发现,香烟提取物(cigarette smoke extract,CSE)诱导PASMCs的增殖和迁移增加,miR-21表达增加,抑制miR-21表达能抑制香烟提取物诱导的PASMCs增殖和迁移。本研究通过过表达和敲降miR-21看其在CSE诱导的PASMCs 是否通过影响PTEN/PI3K/AKT通路而影响了PASMCs 细胞的增殖,迁移的能力。
材料与方法
1.材料:健康SD大鼠,体质量200±20g;武汉卷烟厂生产红双喜牌过滤嘴香烟,每支含尼古丁 1.0mg、焦油15mg;DMEM美国购于Hyclone公司;胎牛血清(fetal bovine serum,FBS) Lipofectamine 2000转染试剂、Trizol、 Opti-MEM 培养基均来自美国 Invitrogen 公司;All-in-OneTMmiRNAQ- PCR Detection Kit购于上海伯易生物有限公司;miR-21引物和U6 siRNA 引物由上海生工公司合成;α-平滑肌肌动蛋白(α-SMA)单克隆抗体、PCNA、Bcl-2、AKT、P-AKT、PTEN、caspase-3以及β-actin单克隆抗体购自美国Santa Cruz 公司;四甲基偶氮唑盐(MTT)粉末来自美国Sigma公司;Transwell小室购于美国 Costar 公司。
2.分离原代鼠肺动脉平滑肌细胞培养及鉴定:参照文献[15]并稍做修改,超净台内用纤维器械在无菌PBS中将肺动脉3 级以下的分支取下,取下后刮除血管内外膜,放入含有胶原酶Ⅰ的离心管中进行消化,在CO2培养箱中消化2~4h,分离得到PASMCs。消化所得细胞用含10%FBS的DMEM培养液,置于37℃、CO2含量5%的培养箱中培养,并对所得细胞进行细胞形态学和α-SMA IF及免疫细胞化学(1∶1000)进行鉴定。原代培养到3~6代的PASMCs可用于实验。
3.CSE 制备及干预:CSE制备参照文献[16]并做适当修改。将去除过滤嘴的香烟点燃,负压将烟雾吸入到含有DMEM培养基的封闭的玻璃瓶,轻轻晃动它解散,用氢氧化钠将溶液pH值调至7.4,经 0.22μm微孔滤膜过滤得到 100%的 CSE原液。CSE原液用完全培养基稀释成10%用于后续实验。
4.miRNA转染PASMCs:将miR-NC、miR-21、anti-miR-NC、anti-miR-21干粉离心后用125μl RNase-free H2O 配制成20μmol/L的储存液。转染步骤如下:接种2×105细胞到24孔板中,用无双抗培养基培养过夜后,弃原培养液,PBS清洗两边后换成400μl在37℃ 温育的opti-MEM培养基。 准备A、B两个EP管,A管中加入47.5μl opti-MEM后加25μl浓度为20μmol/L的miR-21,B管中将2μl 转染试剂(Lipo2000)加入到48μl转染培养基optiMEM,A、B管轻轻混合后室温孵育5 min;将B管液体加入到A管中轻轻混匀室温放置20min后,将混合液加入24孔板,充分混合;37℃,培养6h;加入1ml正常生长液含双倍血清,不移除转染混合物孵育24h;换成正常培养基培养24h后分别提取RNA和蛋白进行检测。
5.Real-time PCR检测miRNA-21表达:Trizol提取4组实验细胞总RNA,加入等体积的异丙醇沉淀RNA,DEPC水溶解后,测定RNA 的纯度,测定后取部分RNA跑琼脂糖凝聚电泳进行质检。取2μl总RNA,应用All-in-OneTMmiRNAQ- PCR Detection Kit进行RT- PCR 检测,每样品测3 次,实时定量检测。miRNA-21引物序列为:5′-TAGCTTATCAGACTGATGTTGAAAA-3′。Real-time分析采用2-△△CT方法。
6.Western blot法检测相关蛋白的表达量变化:取对数生长期的PASMCs悬液接种在6孔板,进行实验干预后提取总蛋白。用BCA法进行蛋白定量,定量后跑胶,转膜。转完膜后室温用TBST配制5%BSA 封闭将膜放入其中摇床封闭1h,一抗4℃摇床孵育过夜。次日,回收一抗,TBST溶液洗涤3次,每次5min,室温二抗摇床孵育1h,二抗回收后再次用TBST溶液洗3次,洗完后膜用Odyssey扫膜仪扫膜,保存结果用软件进行灰度分析。
7.MTT检测细胞增殖:胰酶消化转染4组miRNA后的细胞,终止后离心收集,制成细胞悬液,调整细胞浓度为1×104/孔,轻轻混匀,加入到96孔板中,在相应刺激下培养48h后, 拿出96孔板,每孔加用无酚红培养基配制的MTT 10μl(5mg/ml,即0.5%MTT)。在37℃孵育4h,将150μl二甲基亚砜溶液加入到各孔。孵育15min。微孔板每孔吸光度在570nm,空白为0。
8.划痕实验检测PASMCs的迁移能力:先在6孔板背后划线,然后分别消化转染4种miRNA的细胞,并以5×105个细胞数量加入到6孔板中,当细胞融合到约90%时,单层培养细胞沿培养基的底部放置,并用滴管枪头作为0h的时间点,在显微镜下记录划痕区域的宽度。除去培养液,用含10%CSE的10%胎牛血清培养基在划痕后继续培养至24h。利用Image J 软件统计计算,并记录。
9.Transwell实验检测PASMCs的迁移能力:制备处于生长对数期的原代细胞悬液,24孔板中每孔加0.5ml,对细胞进行转染,转染后将4组细胞用胰酶消化后细胞计数板计数,用只含10%CSE的DMEM培养液重悬并将细胞浓度调整为2×108/L,上室每孔加0.1ml制备好的的细胞悬液,下室每孔中加0.5ml完全培养液。10%CSE刺激24h后,用甲醛固定30min后风干,将细胞用0.1%结晶紫染色20min,棉签轻轻擦去小室上层细胞后,400倍显微镜下随机挑选5个视野进行统计分析计算细胞数量。
结 果
1.RT-PCR 检测 miR-21 mRNA 表达:如图1所示,过表达miR-21组的miR-21含量明显高于转染miR-NC组(P=0.000)。而转染anti-miR-21组miR-21的表达量明显低于转染anti-miR-NC组(P=0.000)。

图1 RT-PCR检测miR-21 mRNA结果A.过表达miR-21;B.敲降miR-21
2.Western blot法检测miR-21对CSE诱导的PASMCs中PTEN/PI3K/AKT 信号转导通路的影响:如图2所示,10%CSE 处理后转染miR-21和转染miR-NC的PASMCs相比,PTEN蛋白表达量下降,从而P-AKT显著上升,同时与增殖相关的PCNA及Bcl-2的表达量增加,而凋亡相关蛋白caspase-3的表达量下降。而转染anti-miR-21组与转染anti-miR-NC组相比,PTEN表达量上升,P-AKT显著下降,从而使PCNA和Bcl-2的表达量下降而caspase-3表达量上升。

图2 miR-21对CSE 诱导的PASMCs 中PTEN/PI3K/AKT信号转导通路中蛋白表达量的影响
3.miR-21对 CSE 诱导的细胞增殖的影响:如图3所示,与对照组比较,转染miR-21后MTT检测A值升高(P<0.01),而转染anti-miR-21组与对照组比较,MTT检测A值降低(P<0.01)。
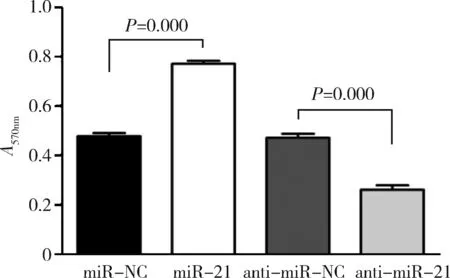
图3 miR-21对 CSE 诱导的细胞增殖的影响
4.miR-21对 CSE 诱导的细胞迁移的影响:如图4所示,转染了miR-21的细胞经24h培养后其划痕愈合速度较快,划痕愈合情况明显优于miR-NC组(P<0.01), 而转染了anti-miR-21组的细胞划痕愈合速度较转染anti-miR-NC 组相比较慢(P<0.01)。图5可见miR-21 转染组的细胞穿膜数量明显多于 miR-NC组(P<0.05),而转染anti-miR-21组的细胞穿膜数量明显少于anti-miR-NC组(P<0.05)。
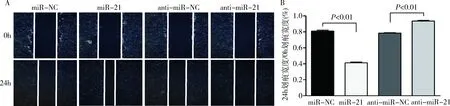
图4 细胞划痕实验结果A.细胞划痕实验照片(×200);B.细胞划痕实验量化图
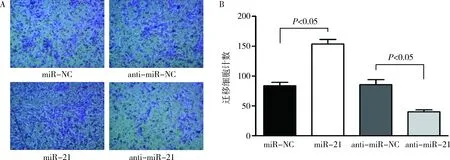
图5 transwell实验结果A.转染miR-21/miR-NC和转染anti-miR-21/anti-miR-NC 细胞培养36h后transwell小室下层细胞结晶紫染色观察(×200);B.Transwell 实验量化图
讨 论
COPD在发病的过程中,往往伴随着并发症PAH,而PAH形成的病理学基础是血管重构。PASMCs的异常增殖、分化和迁移在肺血管重构中发挥着重要作用[17]。各种相关因子的平衡失调导致PASMCs的异常增殖或迁移,最终导致肺血管中层增厚,管腔狭窄或闭塞,形成PAH[18,19]。Wright 等报道,长期暴露于香烟烟雾的豚鼠出现肺动脉管壁增厚现象,PASMCs增殖并向内膜迁移,肺小动脉的肌化是造成肺血管结构改变的重要机制[20]。microRNA作为一种非编码RNA,其作用是通过碱基互补配对的原则和mRNA的3′UTR区域发生不同程度的互补结合,从而使目标mRNA翻译受抑制或降解,进而影响细胞的生物学功能。研究发现,miRNA在受伤的血管平滑肌中上调,参与了血管重构的过程。而在目前miRNA的研究过程中,关于miR-21的研究较多,大量实验证实miR-21是唯一一个几乎在所有实体癌(甲状腺乳头状癌、结肠癌细胞、肝癌细胞等)中过表达的miRNA[21~23]。
实验表明,在血管损伤导致的再狭窄中miRNA-21异常高表达,同时,有研究发现miRNA-21可通过对PTEN的负调控来提高PASMCs的增殖能力并抑制其凋亡。同时在颈动脉损伤中miR-21上调,导致PETN表达下降,促进了PASMCs的增殖[12]。2011年,美国学者认为miR-21与PTEN的mRNA的3′-UTR存在的结合位点[22]。在结肠癌患者中,miR-21与PTEN结合后使PTEN的表达量改变而影响细胞的增殖迁移。PTEN作为一种抑癌基因参与并影响了PI3K磷脂酰肌醇-3激酶(phosphatidylinositol-3′kinase,PI3K)/AKT(又称protein kinase B,PKB)信号通路的活化。PTEN与PI3K的产物PIP3结合从而去磷酸化PIP3,使PIP3处于低活化状态从而抑制AKT的活化,来降低PI3K/AKT信路通路活化水平。该通路被称为PTEN/PI3K/AKT 信号转导通路[24,25]。该通路不只和肿瘤的发生、发展有着紧密的联系,同时很大程度的影响了PASMCs的增殖迁移。在PASMCs中,香烟提取物致使PTEN 失活从而活化PI3K/AKT通路,活化的AKT可以促使众多蛋白发生磷酸化修饰,从而促进细胞的增殖,迁移侵袭,抑制凋亡。因此笔者推测miR-21能通过负调控PTEN而活化PI3K/AKT通路促进PASMCs的增殖迁移从而参与PAH的形成。
本研究用通过在PASMCs中成功过表达和敲降miR-21并用10%CSE处理后通过WB检验发现在过表达miR-21后,PTEN蛋白含量减少,使AKT的磷酸化水平提高,而提高了增殖相关蛋白PCNA的表达量和Bcl-2的蛋白含量,而凋亡相关蛋白caspase-3的表达量明显下降。而在转染anti-miR-21后,与转染anti-miR-NC比较,PTEN蛋白表达量上升从抑制了AKT的磷酸化导致了PCNA和Bcl-2的表达量下降,而使caspase-3的表达量有所提升。同时,过表达miR-21组细胞的MMT值明显上升,细胞的增殖速度加快,迁移能力增强。而敲降miR-21后MMT值比对照组下降,细胞的增殖速度变慢,迁移能力减弱。
综上所述,在CSE刺激的PASMCs中,miR-21可以通过负向调控PTEN的表达量从而使PI3K/AKT通路活化,正向调控了香烟烟雾诱导的PASMCs的增殖和迁移。本研究为阐明吸烟致肺动脉高压的机制, 寻找新的治疗手段提供了实验依据。
