顺铂对耳蜗血管纹毒性作用的研究
2019-03-04李轶刘会占何志洲
李轶 刘会占 何志洲*
1首都医科大学附属北京同仁医院院耳鼻咽喉头颈外科,耳鼻咽喉头颈科学教育部重点实验室首都医科大学(北京100730)
2 Department of Biomedical Sciences,Creighton University School of Medicine,Omaha,Nebraska 68178,USA
听觉的产生依赖耳蜗毛细胞和血管纹的正常功能。毛细胞将机械刺激转化为电活动,而血管纹负责维持中阶(蜗管)内的内淋巴的离子成分并产生内淋巴电位(endocochlear potential)。内淋巴电位对机电转换和耳蜗放大器具有关键作用。由于老化、基因缺陷和暴露于噪声和耳毒性药物而导致的毛细胞和血管纹的损伤是造成人类听力损失的常见原因。
顺铂是治疗实体瘤的一种广泛有效的药物[1,2],但是其副作用(耳毒性、神经毒性及肾毒性)可以发生于使用顺铂治疗的50%以上的成人及儿童[3]。由于顺铂可以导致外毛细胞的死亡,因此以往大部分研究主要集中在顺铂对毛细胞损伤的机制上[1,2,4,5]。然而,最近的实验证明,顺铂在血管纹中可以长时间的滞留。由于顺铂的毒性作用,内淋巴电位幅度降低[6]。顺铂对血管纹的毒性作用的机制目前尚不清楚。血管纹中具有边缘细胞、中间细胞、基底细胞,在这三种细胞上的离子通道(K+、Na+、Cl-channels)、离子泵(Na+/K+-ATPase)和离子转运体(Na+/K+/2Cl−cotransporter)对维持内淋巴电位都起到重要作用[7-9]。以往的研究显示,不少耳毒性、肾毒性、神经毒性药物(如氨基糖甙类和顺铂)可以阻断离子通道、离子泵及神经递质的受体[10-14]。我们通过记录成年小鼠内淋巴电位的方式来确定顺铂能否对血管纹造成急性损伤。血管纹的中间细胞是产生和维持内淋巴电位最为重要的一群细胞[9,15]。因此,我们也使用离体培养的小鼠的血管纹中间细胞,用记录离体的中间细胞的膜电位的方法,观察顺铂是否能够影响中间细胞上的离子通道和离子泵。
1 材料与方法
生后5天的C57BL/6J小鼠共6只,用于中间细胞培养。1月龄C57BL/6J小鼠共12只,用于电生理实验。实验动物均购买自美国Jackson Laboratory(Bar Harbor,ME,USA),性别不限。
1.2 实验方法
1.2.1 内淋巴电位及胞外电位的测量
动物腹腔注射麻醉剂(氯胺酮90 mg/kg+甲苯噻嗪4.5 mg/kg),麻醉满意后,在隔音屏蔽室内,将动物腹侧向上放置于保温垫上,使其体温维持于37°C。固定头部及四肢。颈部正中皮毛备皮。颈部正中切口,手术显微镜下分离皮下组织及肌肉,做气管切开。进一步分离颈部肌肉组织,并分离听泡表面附着软组织,暴露听泡。充分止血后开放听泡,充分暴露镫骨动脉,耳蜗底转。
内淋巴电位的记录方法在以前发表的文章里已有详细介绍[16-21]。我们选择耳蜗底转来进行内淋巴电位测量。玻璃微电极(直径为1µm,输入阻抗10-20 MΩ)固定于微操纵器上,电极内充满150 mM KCl溶液。参考银球电极埋入同侧颈部肌肉内。使用微操纵器将玻璃微电极由圆窗插入,缓缓推进,电极与耳蜗表面接触时调整记录信号的基线为零。经鼓阶通过穿透基底膜进入中阶(图1A)后,观察到一个稳定的直流电位。使用Axopatch 200B放大器(Molecular Probe,Sunnyvale,CA)来放大电信号(滤过频率为1 kHz)。使用16位A/D转换器进行模数转换。使用pClamp10.0的软件进行信号采集。采样频率设定在10 kHz。
通常采用圆窗电极的方法记录微音电位[18-21]。我们采用插入鼓阶中记录内淋巴电位的微电极记录胞外电位(即微音电位)。记录胞外电位时,我们采用4kHz的短纯音,升降时间为0.1ms,时程1秒,强度为85dBSPL。声音由信号发生器产生,经放大后由扬声器(MF1-S,TDT)给出。在记录胞外电位时,用Axopatch 200B放大器放大信号,滤过频率为10kHz,采样频率为50kHz。
1.2.2 中间细胞培养
将生后5天C57BL/6J小鼠的内耳组织取出,分离出耳蜗中转、顶转的血管纹。将分离获得的血管纹组织放入预先准备好的装有DMEM的培养皿中,然后铺平将其放入到培养箱中。两个小时后加入少量胎牛血清使其浓度达到5-10%之间。次日早晨将培养皿中的培养基更换成PVM细胞专用培养基。在培养过程中,中间细胞会从血管纹中迁移出来,培养5-7天后,大部分中间细胞已经迁移出血管纹。由于其含有色素,中间细胞非常易于辨认。
1.2.3 使用全细胞膜片钳记录细胞静息电位
使用Olympus BX51WI正置显微镜和Axo⁃patch 200B放大器,来进行全细胞电压/电流钳记录。微电极使用3D的微操纵器来控制(MHW-3,Narishige,日本)。微电极是使用显微拉制仪从直径1.5 mm玻璃管(A-M Systems,Carlsborg公司)拉制而成。记录电极的电阻为3-4 MΩ,内充的溶液的成分(mM)为 150 KCl,2 MgCl2,1 EGTA,10 HEPES,使用KOH将pH调节到7.3。全细胞膜片钳建立好后,整个通路的串联电阻为8-12 MΩ。
2 实验结果
图1A显示的是使用微电极记录成年小鼠的内淋巴电位,正常情况下,当微电极插入耳蜗中阶时,可以记录到一个约为90-95 mV左右的直流电位,即内淋巴电位,电极退出后电位再次恢复到0电位。我们记录了6只正常成年小鼠耳蜗底转的内淋巴电位,平均约为94.3±3.8 mV(如图1B)。为了进一步证明我们所记录到的电位的确为内淋巴电位,我们在记录内淋巴电位的同时给小鼠一个4K短纯音的刺激声。图1C所显示的是给4K纯音的情况下所同时记录的内淋巴电位及毛细胞胞外电位,可以看出胞外电位是在内淋巴电位基础以上的电位,胞外电位的峰-峰值约为2.2 mV(图1C插入的反应曲线),并且也具有直流成分即合电位[22],此胞外电位的反应特性和波幅都与以往用微电极记录胞外电位的特性以及幅度一致[23,24]。由此证明我们记录到的约90 mV波幅的直流电位确为内淋巴电位。

图1 记录成年小鼠耳蜗EPFig.1 Recording EP from adult mouse cochleaeA:使用微电极通过耳蜗基底膜记录内淋巴电位(EP)的示意图。IHC:内毛细胞;OHCs:外毛细胞。B:从小鼠耳蜗底转记录到的内淋巴电位,红色箭头所指为电极插入、退出中阶的时间点。C:从小鼠耳蜗底转记录到的内淋巴电位和胞外电位。在记录内淋巴电位过程中,用4kHz的短纯音诱发胞外电位(即耳蜗微音电位)。放大的胞外电位显示在图C的插图中。A:Schematic drawing of using sharp electrode technique to record EP via basilar membrane approach.IHC:Inner hair cell;OHCs:Outer hair cells.B:An example of EP recorded from the basal turn of a mouse cochlea.Red arrows mark the insertion and withdrawal of the sharp electrode into the scala media.C:An example of EP and extracellular potential recorded from the basal turn of a mouse cochlea.A 4 kHz tone burst was used to evoke extracellular potential(i.e.,cochlear microphonic)during EP recording.The extracellular potential is plotted in the expanded magnitude and time scales in the insert.
由于内淋巴液存在可能的外漏,所测量到的内淋巴电位的幅度会随着时间的推移而出现缓慢的下降。因此实验中,我们观察了将微电极插入中阶后内淋巴电位变化情况。图2上图所显示的是对照组小鼠的内淋巴电位值在34分钟时间内变化的情况。我们在电极记录到内淋巴电位后,通过鼠尾静脉注射大约0.2 ml的生理盐水作为对照,来观察内淋巴电位在注射后的30分钟后的变化情况。可以看到内淋巴电位值在30分钟的时间内出现缓慢下降,最后下降到60 mV左右(变化了近30 mV)。在实验组的6只小鼠中,通过鼠尾静脉注射0.2 ml的顺铂(35 mg/kg),观察在注射顺铂后内淋巴电位的变化情况。从图2(中图红线)可以看到在注射顺铂后内淋巴电位并没有出现快速的变化。为了证明阻断血管纹细胞中的离子泵可以快速影响内淋巴电位的幅度,我们用吸入CO2的方式在另外6只小鼠中做阳性对照,吸入CO2可以造成缺氧,缺氧可以影响Na+/K+-ATP的功能而快速影响内淋巴电位的幅度,这在以前的许多实验中早有证实[7,10,15,17,19,25,26]。图2下图显示的是给小鼠吸入CO2后内淋巴电位幅值的变化,可以看到小鼠吸入CO2后的数秒钟内,内淋巴电位迅速下降,下降幅度高达70 mV,停止CO2吸入后,内淋巴电位则快速回升。阳性对照实验证明影响离子泵可以快速改变内淋巴电位幅度。
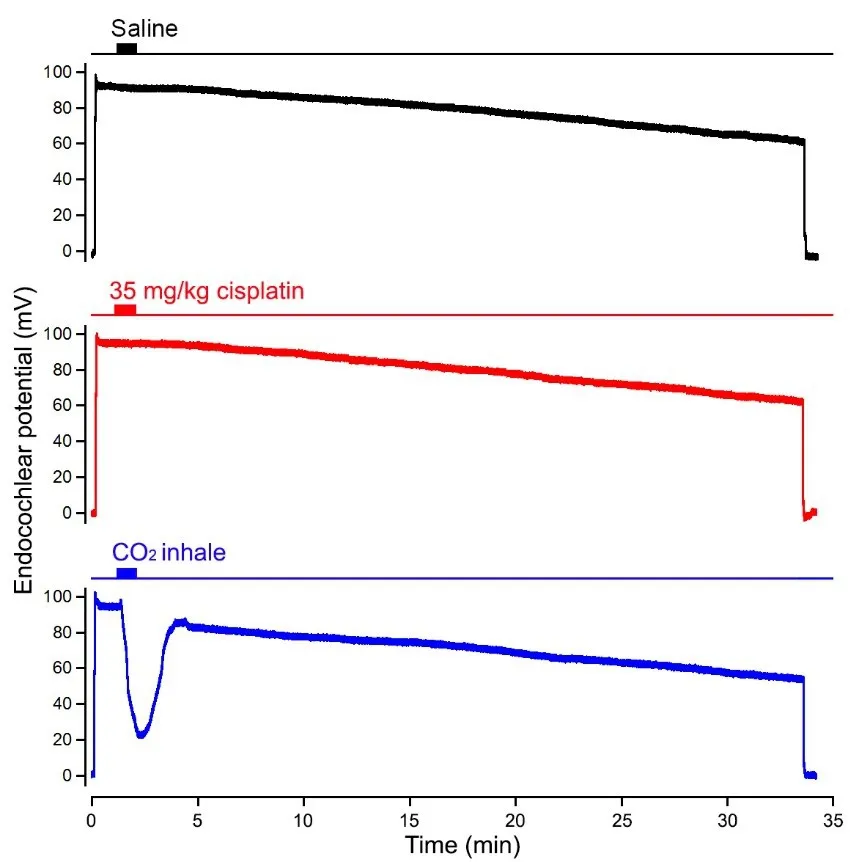
图2 观察34分钟内EP值的变化Fig.2 Monitoring the change in EP magnitude over the period of 34 minutes最上曲线显示对照组内淋巴电位值的变化。中间曲线显示当35mg/kg顺铂经静脉注射到血液循环系统时内淋巴电位值的变化。没有观察到内淋巴电位幅度的快速和急剧下降。最下曲线显示短暂吸入CO2时内淋巴电位值的变化。可以观察到内淋巴电位值迅速降低。当二氧化碳吸入停止时,内淋巴电位恢复正常。顶端相应的时间标尺显示了CO2施加的持续时间。The top panel shows the change in EP magnitude in control group.The middle panel exhibits the change in EP magnitude when 35 mg/kg cisplatin was injected to the circulation system via the tale vein.No rapid and dramatic drop in EP magnitude was observed.The bottom panel displays the change in EP magnitude when CO2 was briefly inhaled.A rapid reduction in EP magnitude was observed.The EP recovered when CO2 inhale was stopped.The time scale bar on top of the response shows the duration in which cisplatin or CO2 was applied to the mouse.
我们对生理盐水注射组和顺铂注射组的各6只小鼠在注射后1、4、8、12、16、20、14、18、32分钟的内淋巴电位值进行分别测量,其平均值和标准差的统计结果如图3柱状图所示,使用t检验显示,在以上任何一个时间点,此两组动物的内淋巴电位值都不存在显著性差异。因此,顺铂对血管纹的功能并没有急性的阻断作用。
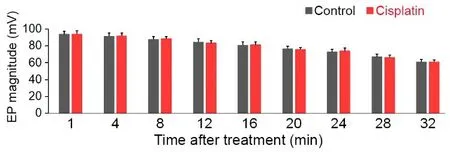
图3 对照组和顺铂治疗组小鼠内淋巴电位值的比较Fig.3 Comparison of EP magnitude in control and cisplatin treated mice经静脉注射35 mg/kg顺铂和生盐水后1、5、10、15、20、25、30分钟内淋巴电位的均值和标准差,每组6只小鼠(对照组和顺铂治疗组)进行分析。两组间在测定的任何时间点均无统计学差异。Mean and SD of EP magnitude at 1,5,10,15,20,25 and 30 minutes after cisplatin was 35 mg/kg cisplatin was injected to the circulation system via the tale vein.Five mice in each group(control and cisplatin-treated)were used for analysis.No statistical significance(P<0.01,n=6)was found between the two groups at any time point measured.
血管纹中间细胞在产生和维持内淋巴电位中起到重要作用,因此我们使用膜片钳技术,记录了培养的小鼠血管纹中间细胞在加入顺铂后膜静息电位的变化。如果顺铂可以通过影响离子通道或离子泵的功能产生作用,细胞膜的静息电位在使用顺铂后应该发生快速变化。因此通过直接观察顺铂作用后的膜电位的变化,就可以确定顺铂可否通过影响离子通道及离子泵的作用来影响血管纹的功能。图4A所显示的是培养的小鼠血管纹中间细胞,可以看到这些细胞的直径大约在20 μm左右,并具有明显的色素颗粒,所以这些细胞非常易于辨认。我们用全细胞膜片钳技术观察了中间细胞的静息电位。细胞在破膜后静息电位约为-10~-15 mV,当微电极内的高钾溶液与胞内液进行充分交换后,膜静息电位会降至-40 mV左右(图4B)。为了证明静息电位会受到胞外离子浓度的影响,我们使用一个加入40 mM的KCl溶液的灌流电极,在距细胞10 μm左右进行灌流,从图4B上可以看到在灌流时,细胞膜静息电位立刻发生除极化,在灌流停止后,静息电位又缓慢恢复到-40 mV左右。这是由于40 mM的氯化钾通过离子泵及离子通道,影响了细胞的静息膜电位。使用同样的方法,我们观察了向胞外灌流顺铂(100µM)后的静息膜电位的变化情况(图4B红色曲线)。可以看到,灌流顺铂对细胞静息膜电位没有影响。我们所记录了5个中间细胞,灌流前后静息膜电位的均值和标准差分别为-37.7±2.7(前)、-38.1±2.9 mV(2分钟)、-38.3±2.7 mV(5分钟)及-37.9±2.8 mV(10分钟)。显然,顺铂灌流前后静息膜电位没有发生明显的升高或降低。
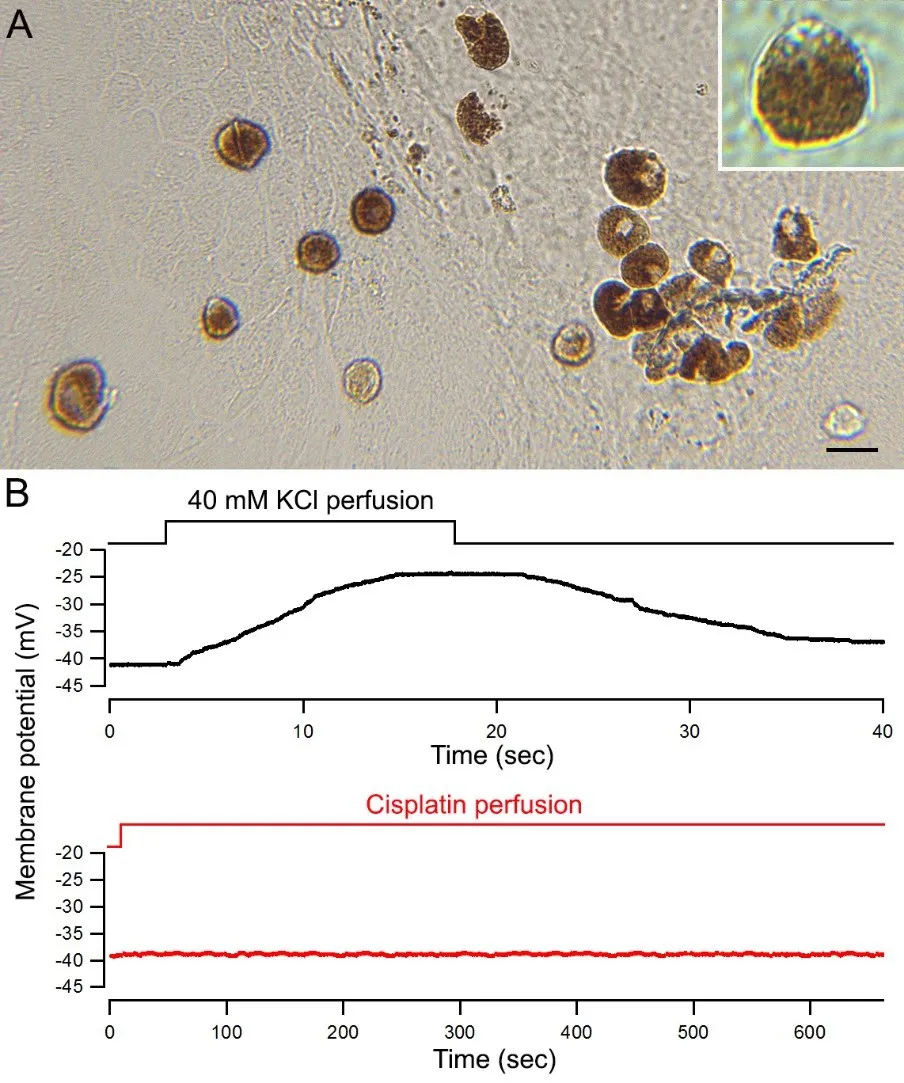
图4 用全细胞电压钳记录法测量顺铂对培养中间色素细胞膜电位的影响Fig.4 Measurementofmembranepotentialfromculturedmelanocytes in response to cisplatin treatment using whole-cell voltage-clamprecordingA:出生后第5天(P5)小鼠血管纹中间细胞的显微照片。右上显示单个中间细胞的放大图像。B:顺铂灌注时的细胞膜电位。40 mM氯化钾作为阳性对照。顺铂或40 mM氯化钾通过灌流玻璃小管(直径为5-8µm)至细胞,灌流玻璃小管位于离细胞15 μm处。顺铂灌流前后静息膜电位没有发生明显的升高或降低。A:Micrograph of melanocytes prepared from postnatal day 5(P5)mice.Insert shows a magnified image of a melanocyte.B:Membrane potential during cisplatin perfusion.40 mM KCl was used as a positive control.Cisplatin or 40 mM KCl was perfused to the cell through a pipette placed 10 μm away from the cell.The recording chamber was continuously perfused with fresh extracellular solution.No change in membrane potential was observed after cisplatin treatment.
3 讨论
发现顺铂具有耳毒性作用以后,许多实验室对其毒性机制进行了大量研究。早期的研究证实顺铂的耳毒性不仅限于毛细胞,对耳蜗螺旋神经节细胞及血管纹也具有毒性作用[27]。虽然许多实验显示顺铂是通过损伤线粒体和/或氧化应激反应,或对DNA的直接损伤导致毛细胞的凋亡[1-6,27-30],但对血管纹及螺旋神经节细胞的作用机理研究的很少,因此作用机理依然未知。在肿瘤上的研究证明,顺铂可以增强对容量敏感(Volume-Sensitive)的氯离子通道的活性[31]。因为影响血管纹细胞上的离子泵或离子通道(Na+、K+、Cl-)的活性,都会对内淋巴电位产生影响[7-9],我们试图确定顺铂是否可以通过影响离子泵或离子通道的功能影响血管纹的功能。因为任何影响血管纹上离子泵、载体及离子通道的功能都是快速的,可以通过记录内淋巴电位的变化立即观察到。我们通过记录小鼠的内淋巴电位和培养的血管纹中间细胞的静息膜电位证明,顺铂并不能影响血管纹细胞的离子泵及离子通道,因此,在用高剂量顺铂[32-38]或用普通剂量一个周期(4天)后所观察到的血管纹病变和内淋巴电位降低[6],并不是通过对离子通道或离子泵的影响引起的。由此推测,顺铂对于血管纹的毒性作用,很可能也是通过外源凋亡途径、损伤线粒体、氧化应激反应或对DNA的直接损伤引起的[1,2,5,6]。曾经有实验表明,顺铂可以通过损伤营养血管纹的微血管从而影响到血管纹的形态和功能[37]。也有实验证明,顺铂可以影响血管纹中的边缘细胞[38]。虽然顺铂对血管纹的毒性机理依然还不清楚,但是本实验证明了顺铂不能像利尿酸,速尿和G毒毛旋花甙那样能直接抑制损伤血管纹的功能[7,8,39-41]。
我们观察了顺铂注入血液30分钟内淋巴电位的变化。30分钟的观察时间是否足以观察顺铂的急性作用?许多实验证明,当血管纹的离子泵或离子载体的功能被缺氧[16,17,25,26]、静脉注入某些药物后[8,15],内淋巴电位的降低在很短的时间内(几秒到几分钟)就能观察到。Konishi和Mendelsohn等人观察到G毒毛旋花甙(钠钾泵抑制剂)可以迅速降低内淋巴电位[7]。Kusakari等人在静脉注入利尿酸,速尿或G毒毛旋花甙后,内淋巴电位在2分钟或迅速降低[8]。用离子通道阻断剂经静脉注入阻断钾或钙离子通道后,内淋巴电位也在几分钟内快速下降[15]。吸入CO2,内淋巴电位的降低更为迅速,我们的实验(图2)和以前的实验都显示内淋巴电位的降低可在几秒钟内发生[16,17]。因此,我们观察用药后30分钟的时间里内淋巴电位的变化足以证明顺铂是否对血管纹具有急性损伤作用。需要强调的是,有研究明确显示应用顺铂后血管纹中会有大量顺铂沉积[6]。由于顺铂可以在小鼠内淋巴和毛细胞检测到,说明顺铂是可以通过血迷路屏障进入到血管纹和内淋巴中。袢利尿剂暂时阻断蜗管外壁的血流却可使血管纹上皮因缺血缺氧,构成血迷路屏障的暂时性破坏,使血液中的顺铂穿越血迷路屏障的破损处进入到耳蜗内环境[28,39-41]。
我们用培养的血管纹中间细胞记录了加入顺铂后膜电位的变化。这是首次使用离体的中间细胞,直接记录其对顺铂的反应。到目前为止,还从未有过培养、分离、记录血管纹中间细胞的报道。我们的这部分研究对今后利用培养的中间细胞研究其离子通道、转录组以及用药前后的变化具有重要意义和广泛应用的潜力。
由于我们在用顺铂注入静脉和离体培养的细胞上均没有观察到内淋巴电位和静息膜电位的变化,因此,顺铂不可能通过影响离子泵及离子通道的活性,影响血管纹功能。我们正在通过分析顺铂使用前后转录组[42-44]的变化来研究顺铂对血管纹的毒性机理的分子基础。
