Janus激酶及其抑制剂的研究进展
2019-03-01黄昊哲张吉星刘佳徐云根孙丽萍
黄昊哲,张吉星,刘佳,徐云根,孙丽萍
(中国药科大学药学院药物化学教研室 江苏省药物分子设计与成药性优化重点实验室,江苏 南京210009)
Janus激酶(Janus kinases,JAKs)是一种细胞内的非受体酪氨酸激酶,在许多细胞因子受体介导的信号传导中起到枢纽作用[1]。JAKs参与的信号通路可由多种细胞因子、生长因子以及受体激活,在生物体中参与多种类型细胞的增殖、分化、凋亡,血管生成以及免疫调节等重要的生理过程。同时JAKs的失调通常伴随着各种疾病,故其成为具有吸引力的靶标[2]。截至目前,已经有3个JAKs抑制剂被批准上市,并有多个JAK抑制剂被批准进行临床试验,表现出良好的开发前景[2-3]。本文将对JAKs家族及其抑制剂研究状况,以及针对的适应证进行概述。
1 Janus激酶家族的生物学研究
1.1 Janus激酶家族及其结构
JAKs家族在哺乳动物体内有4个不同的亚型,分别为:JAK1、JAK2、JAK3和酪氨酸激酶2(tyrosine kinase 2,TYK2)。JAKs存在于细胞质中,常分布在核内体和质膜上。除JAK3主要表达于造血细胞外,其他3种亚型均在成年小鼠组织中普遍表达[4]。
JAKs家族的结构具有高度的同源性,由7个同源结构域(JAK homology domain,JH)组成4个保守结构域:C端的假激酶区(pseudo-kinase domain,JH2)和激酶区(kinase domain,JH1),以及N端FERM(Four.1 protein,Ezrin,Radixin,Moesin) 区 和 SH2结 构 域(srchomology 2 domain)(见图 1)[5]。其中 JH1区是能够活化激酶的催化区域,该区域在JAKs家族中高度保守,一旦JAKs与细胞因子结合,JH1中活化环(activation loop)上的酪氨酸残基发生磷酸化,伴随着蛋白构象发生变化,随之激活蛋白及其下游信号通路[6];研究表明JH2在JH1功能的调控上发挥着重要作用,该结构域内的突变常导致JAKs活性异常,进而导致某些疾病的发生[5];JH3和JH4组成了SH2结构域,被认为能够起到稳定JAKs构象的作用;JH5~JH7(FERM区)能与细胞因子受体胞内区域发生相互作用,调节 JAKs与受体的结合[7]。
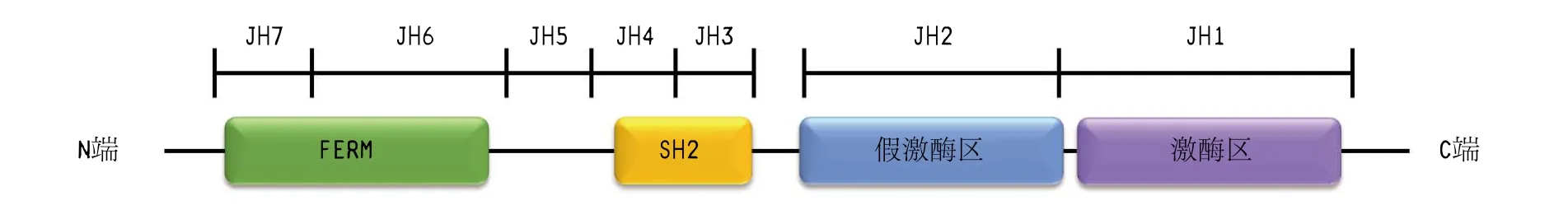
图 1 Janus激酶结构域Figure 1 Domains structure of Janus kinase
1.2 Janus激酶参与的信号通路
JAKs/信号传导及转录激活因子(signal transducers and activators of transcription,STATs) 信 号 通 路 是JAKs在生物体内介导的最主要的通路,当胞外配体结合在膜表面的细胞因子受体上时,该通路启动。此时2个JAKs分子靠近细胞因子受体,导致受体胞质内区域构象发生改变,启动并激活JAKs蛋白,同时JAKs使得受体胞质内区域发生磷酸化,在该区域内给STATs提供停泊位点(docking sites)。激活的STATs蛋白从受体上脱离并形成磷酸化二聚体,转移至细胞核内,结合在特定的DNA序列上发挥生理功能,调控目标基因的转录[8-9]。该通路的激活调控了一系列的生理过程,如造血和细胞代谢等[10]。同时有文献报道,激活的JAKs也能够介导其他下游级联信号,包括磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,也称 Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和Ras/Raf/有丝分裂原活化蛋白激酶(mitogenactivated protein kinase kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)下游信号通路(见图2)[11]。
1.3 Janus激酶与细胞因子
JAKs介导的信号通路能够被多种细胞因子、生长因子和激素激活。然而特定的细胞因子只能与特定的受体结合,激活并启动下游特定的JAKs亚型复合物,在相关的生理活动中发挥重要作用(见图3)。如JAK1/3复合物是唯一能够被含有γ链的细胞因子受体激活的JAKs家族复合物[4],包括白细胞介素(interleukin,IL)-2、4、7、9、15和21等细胞因子,该复合物对淋巴细胞的增殖和体内稳态起到关键作用[10]。含有β亚基的Ⅰ型细胞因子和激素类细胞因子能够刺激JAK2同源二聚化,JAK2是骨髓、红细胞和血小板生成必不可少的因素[3-4]。干扰素(interferon,IFN)家族可激活JAK1/TYK2复合物[3]。IL-10家族细胞因子和含有糖蛋白130(glycoprotein130,gp130)的细胞因子,介导JAK1/2和TYK2的下游信号通路[4],如IL-6首先激活JAK1/TYK2复合物,再启动JAK2/TYK2复合物[10]。
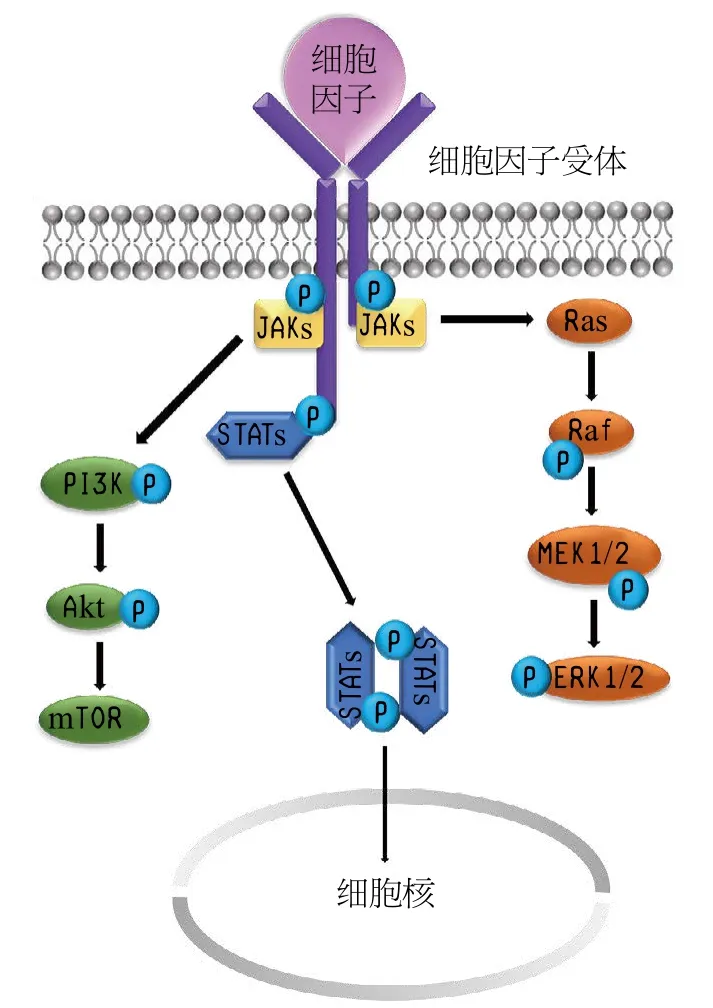
图 2 Janus激酶参与的信号通路Figure 2 Involvement of Janus kinase in signaling pathway
2 Janus激酶通路与疾病的关系
近年来,JAKs通路与疾病的关系越来越受到关注。过度活跃的JAKs在人类炎症、自身免疫性疾病和骨髓增殖性疾病中有明确的作用[2,4,12-16]。因此,JAKs抑制剂的开发日益引起重视。
2.1 类风湿性关节炎
据报道,多种细胞因子在类风湿性关节炎(rheumatoid arthritis,RA)的病理过程中具有关键作用,这些细胞因子通过不同途径激活JAKs/STATs信号通路[13]。因此,JAKs蛋白在RA的病理过程中起到关键作用,而靶向抑制JAKs已是目前临床上用于治疗RA的有效手段[14]。
2.2 骨髓增殖性肿瘤
骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)是以骨髓中异常造血干细胞增殖为特征的一组慢性病症,包括骨髓纤维化(myelo fi brosis,MF)、真性红细胞增多症(polycythemia vera,PV)、原发性血小板增多症(essential thrombocytosis,ET)和慢性粒细胞白血病(chronic myeloid leukemia,CML)[15]。异常的JAK2信号在MPN的发病机制中起关键作用。95%的PV患者,以及约50% ~ 60%的MF和ET患者具有JAK2的V617F突变[2,4-5,16]。该突变导致JAK2不依赖细胞因子连续激活,并活化下游信号通路[2]。
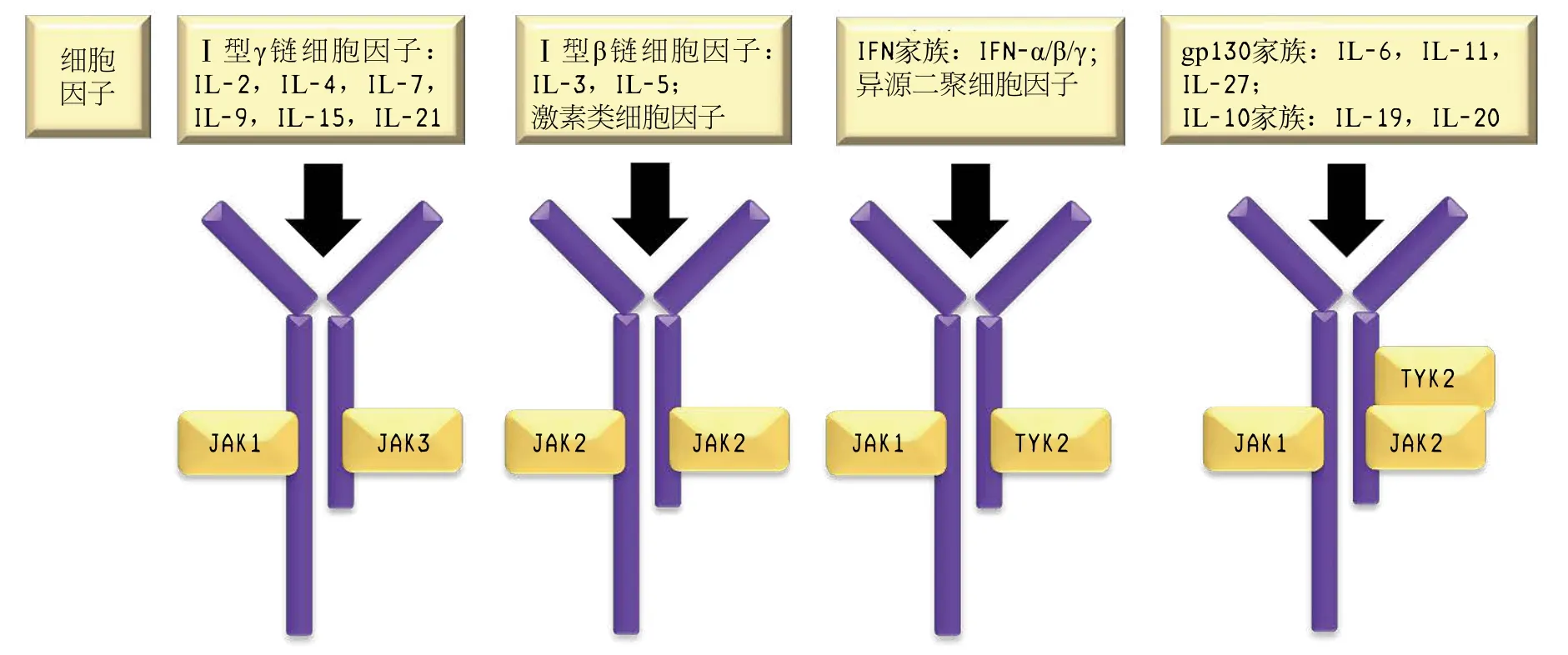
图 3 细胞因子和生长因子刺激的Janus激酶通路[1]Figure 3 Janus kinase signaling pathway stimulated by cytokine and growth factor
2.3 白血病
据报道,在急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)患者中发现了JAK1/3和TYK2的突变[4];有9%的儿童急性T淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)患者出现了IL-7Rα的插入序列,这导致分子间2个半胱氨酸残基二硫键发生二聚化,允许JAK1在缺乏JAK3和γ链的情况下活化[2]。在187例急性B淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)患者中,有20例发生JAK1、JAK2或JAK3突变[2]。
此外,急性髓性白血病(acute myeloid leukemia,AML)患者中也检测到JAK1的突变[5];同时在临床试验中发现了多名患者被检测到JAK2-V617F突变[2]。这些发现意味着特异性靶向JAKs的抑制剂在治疗这些疾病中将起到有益作用[5,16]。
2.4 淋巴瘤
淋巴瘤(lymphoma)是由成熟的免疫细胞产生的恶性肿瘤。据报道,32%的自然杀伤细胞/T细胞淋巴瘤患者存在JAK3点突变[4]。55%的原发性纵隔B细胞淋巴瘤(primary mediastinal B-cell lymphoma,PMBL) 患 者和35%的霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)患者都含有9p24染色体的扩增,涉及的基因包括JAK2[2]。
2.5 银屑病
银屑病(psoriasis)是一种自身免疫性皮肤病,响应于多种细胞因子,包括肿瘤坏死因子(tumor necrosis factor,TNF)、IL-17、IL-12和IL-23[17]。其中,IL-23通过JAK信号通路刺激TH17细胞产生细胞因子IL-17,其是银屑病发生中另一个重要的致病因子[18]。鉴于银屑病进程依赖于细胞因子介导的JAKs通路,使用JAKs抑制剂阻断上游IL-23信号能够间接导致IL-17减少,从而抑制银屑病的发生[18]。
2.6 特应性皮炎
在特应性皮炎(atopic dermatitis)中,一些与变应性疾病相关的细胞因子(如IL-4、IL-5和IL-13)过度表达[17-18]。过度表达的细胞因子激活下游的JAKs蛋白,促进疾病的发展,因此抑制这些下游的JAKs蛋白能够起到很好的疗效[17]。
3 Janus激酶抑制剂
截至2018年3月,已经有很多JAKs抑制剂用于临床或处于临床前研究阶段。从临床试验药物以及上市药物来看,目前针对JAK1/3的抑制剂的主要适应证为RA,而针对JAK2靶点开发的抑制剂的适应证主要为MF、PV等疾病。以下主要按照化学结构对JAKs抑制剂进行分类。
3.1 吡咯并嘧啶类
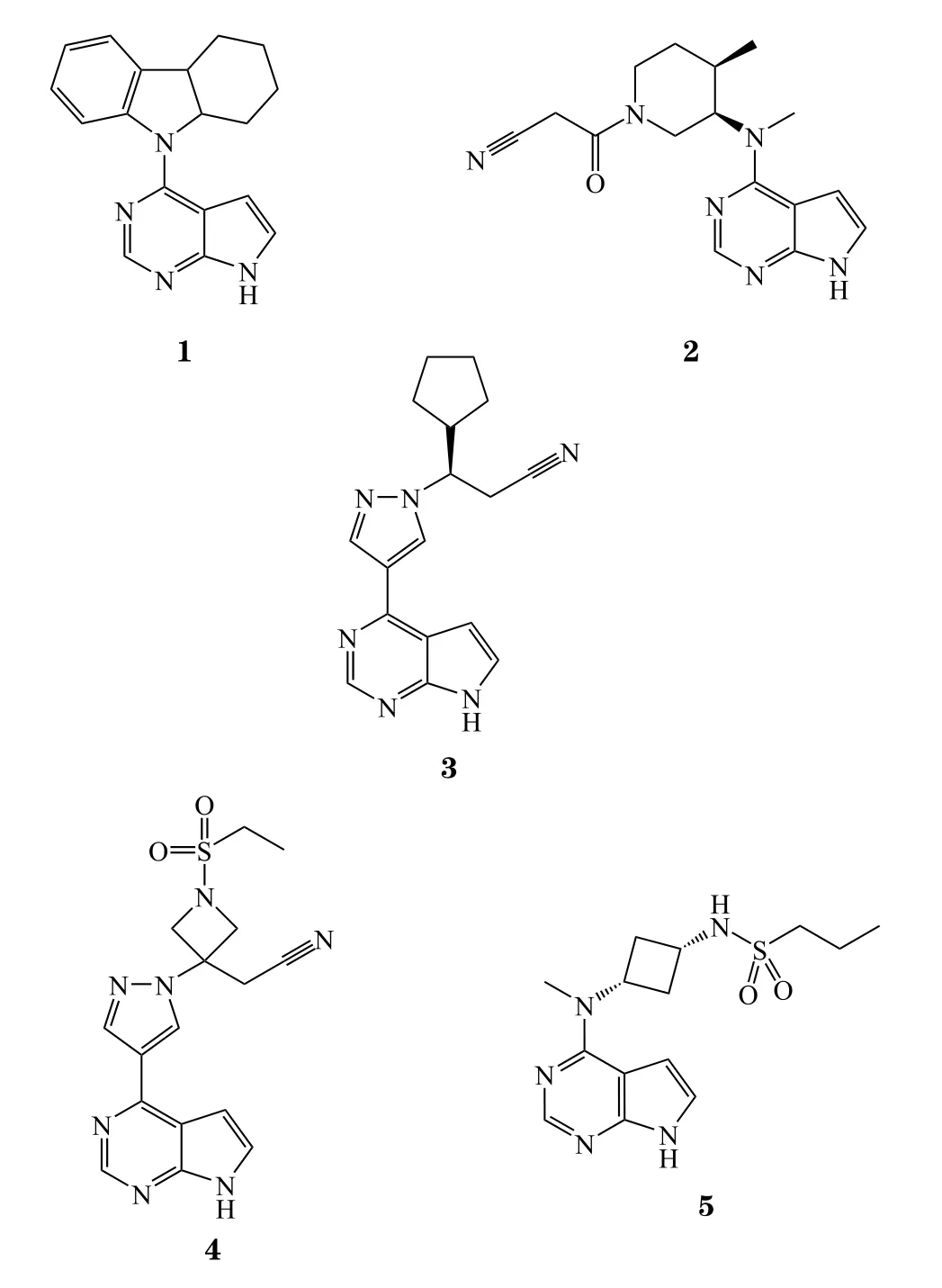
吡咯并嘧啶是JAKs抑制剂中最常见的一种结构,母核中吡咯上的-NH-和嘧啶N1能与激酶铰链区形成关键氢键。辉瑞公司采用高通量筛选得到先导化合物CP-352,664(1),并通过结构改造得到托法替尼(tofacitinib,2),是首个上市用于治疗自身免疫性疾病的JAKs抑制剂[19]。多项临床研究表明,托法替尼对于不同严重程度的RA患者都有效,且与阿达木单抗疗效相当,疗效优于甲氨蝶呤[19]。基于这些发现,美国FDA批准将托法替尼用于治疗对甲氨蝶呤应答欠佳的RA患者[19]。在开发初期,托法替尼旨在靶向抑制JAK3的活性(IC50=1 nmol · L-1),但后期研究发现其几乎对整个JAKs家族都有活性(对JAK2和JAK1的IC50分别为 20 和 112 nmol · L-1)[20]。同时有临床试验报道患者使用托法替尼后出现贫血、血小板减少等症状,很可能与JAK2抑制有关。
鲁索利替尼(ruxolitinib,3)是由Incyte公司开发的JAK1/2选择性口服抑制剂,用于治疗MF和PV。鲁索利替尼在体外对JAK1和JAK2的IC50分别为(3.3±1.2)和(2.8±1.2) nmol · L-1,对 JAK1/2 的 IC50分别是对TYK2和JAK3的6倍和100倍[21],并能够显著延长JAK2-V617F阳性MPN模型小鼠的存活期[21]。临床试验表明:在减少高危MF患者的脾肿大和其他相关症状方面,鲁索利替尼具有显著且持久的疗效[22],并且在那些未携带JAK2-V617F突变的患者中也表现出良好的疗效[23]。
巴瑞克替尼(baricitinib,4)是一种强效的JAK1/2选择性抑制剂(对JAK1和JAK2的IC50分别为5.9和5.7 nmol · L-1),对JAK3和TYK2有优异的选择性(JAK3:IC50> 400 nmol · L-1;TYK2:IC50=53 nmol · L-1)[24]。2017年,该产品在日本被批准用于治疗中度至重度RA。巴瑞克替尼对RA的疗效在Ⅲ期临床试验中得到证实[24-25],对难治性侵袭性RA患者的关节损伤有显著改善,且未出现严重副作用[26]。
化合物PF-04965842(5)是JAK1选择性抑制剂(IC50=29 nmol · L-1)。开发者以托法替尼为先导化合物,修饰托法替尼尾部3-氨基哌啶为磺酰胺结构。化合物5与JAK1和JAK2的X射线共晶的结果证实了该化合物对JAK1的活性优于JAK2[27]。该化合物在生化实验中对JAK2亚型选择性良好,在动物实验中对抗原诱导关节炎(adjuvant-induced arthritis,AIA)大鼠模型有显著疗效[27];目前其治疗特应性皮炎的Ⅲ期临床试验正在进行中。
3.2 氨基嘧啶类
Pacritinib(SB1518,6)对Fms样酪氨酸激酶3(Fms-like tyrosine kinase,FLT3) 和 JAK2的野生型和突变型都有抑制作用(FLT3wt/FLT3D835Y:IC50分别为22 和 6 nmol · L-1;JAK2wt/JAK2V617F:IC50分 别 为 23 和19 nmol · L-1[28])。化合物6与JAK2的对接显示:氨基嘧啶与JAK2的ATP结合区中Leu932作用,连接链中氧原子与Ser936形成氢键,吡咯烷的碱性氮与Asp939形成盐桥(见图4)[29]。Pacritinib显示了良好的安全性,在原发性和继发性MF患者的临床研究中具有良好的疗效,为MF患者提供了潜在的治疗选择[30-31]。
Momelotinib(CYT387,7)是一种口服的JAK1/2选择性抑制剂(对JAK1和JAK2的IC50分别为11和18 nmol · L-1),吉利德(Gilead)公司正在对其进行Ⅲ期临床试验,用于治疗PV、MF和ET。细胞实验表明:momelotinib能抑制由细胞因子介导的增殖,并阻止JAK2-V617F阳性PV患者的红细胞集落生长[32]。在小鼠MPN模型中,momelotinib使白细胞计数、血细胞比容和脾脏大小正常化,并恢复炎性细胞因子至正常生理水平[33]。此外,临床试验在评估momelotinib的有效性和安全性上,与上市药物鲁索利替尼相比并不逊色[34-35]。

图 4 化合物6与Janus激酶2对接模式图Figure 4 Docking mode of compound 6 and Janus kinase 2

体外试验表明,JAK2抑制剂NS-018(8)有效地抑制了骨髓增生异常综合征(myelodysplastic syndrome,MDS)患者骨髓单个核细胞(bone marrow mononuclear cells,BMMNCs) 的 形 成, 其 对 正 常BMMNCs的毒性相对较低[36]。NS-018治疗MF的Ⅰ/Ⅱ期临床试验正在进行中。临床研究表明:其最常见的药物相关不良事件是血小板减少症、贫血、头晕和恶心;56%的患者的脾脏大小减少了约50%,且MF相关症状得到了改善[37]。

3.3 三元稠杂环类
Kulagowski等[38]在分子模拟研究中发现托法替尼处于顺势构象时能量最低,同时托法替尼与JAK1的X射线共晶结构图也显示其处于顺势构象。基于以上结论,作者对托法替尼母核进行环化,将咪唑引入吡咯并吡啶母核。模拟托法替尼与JAK1结合模式,得到新型咪唑并吡啶并吡咯骨架化合物9。此外,还有文献报道了化合物10 ~ 12在咪唑C2引入取代基能够与JAK1的Glu966作用,提升化合物对JAK1的活性和选择性[39-41]。

Hurley等[42]通过骨架跃迁由咪唑并吡啶并吡咯得到新型母核(化合物13)。共晶结构显示原母核与新型母核以相同模式结合在JAK1上。母核中吡咯并吡啶能与铰链区Leu959和Glu957形成氢键;腈基伸出铰链区与氨基酸残基作用。
Upadacitinib(ABT494,14)是由艾伯维(AbbVie)公司开发的,以吡咯并吡嗪并吡唑为母核的一种非竞争性JAK3三环抑制剂,其通过与ATP结合位点外的其他区域相互作用提高了对JAK1的选择性,对JAK1、JAK2、JAK3和 TYK2的 IC50分 别 为 43、200、2 300、4 700 nmol · L-1[43]。在细胞特异性评价中,该化合物对JAK1的选择性分别为对JAK2和JAK3的74和58倍[43-44]。目前正在进行一项Ⅲ期临床试验,考察upadacitinib对传统或生物抗风湿药物治疗无效的中度至重度RA的疗效。在其治疗RA的Ⅱb期临床试验中,对于美国风湿病协会(ACR)规定的指标达20%、50%和70%的缓解(即ACR20、 ACR50和ACR70应答)的患者比例而言,治疗组高于安慰剂组,并存在显著的剂量-效应关系(P<0.001)[45-46]。

3.4 共价抑制剂
PF-06651600(15)是JAKs抑制剂中首个共价抑制剂,其结构中的丙烯酰胺基团能够特异性与JAK3亚型上的Cys909发生加成反应形成共价结合,目前正处于Ⅱ期临床,体内疗效良好且清除率低。PF-06651600以托法替尼为先导化合物,移除嘧啶氨基上的甲基,使得N-C键旋转180°促进尾部片段靠近Cys909,并引入迈克尔受体与Cys形成共价作用而得,实现了JAK3亚型特异性,IC50为 33 nmol · L-1[47-48]。
Tan等[49]报道了具有高选择性JAK3抑制活性的2,4-二取代嘧啶类化合物16和17,其中化合物17对 JAK3 的 IC50低于 0.5 nmol · L-1,在转染的 Ba/F3 细胞试验中,化合物对JAK3的选择性分别为对JAK1、JAK2、TYK2的110、210、110倍。X射线共晶结构图显示,化合物16母核氨基嘧啶部分与JAK3铰链区Leu905形成双齿氢键,丙烯酰胺部分与Cys909形成共价键,氯原子与Met902形成氢键,右侧苯环与Leu956形成范德华力,另外酰胺能与Arg953羰基形成氢键(见图5)。
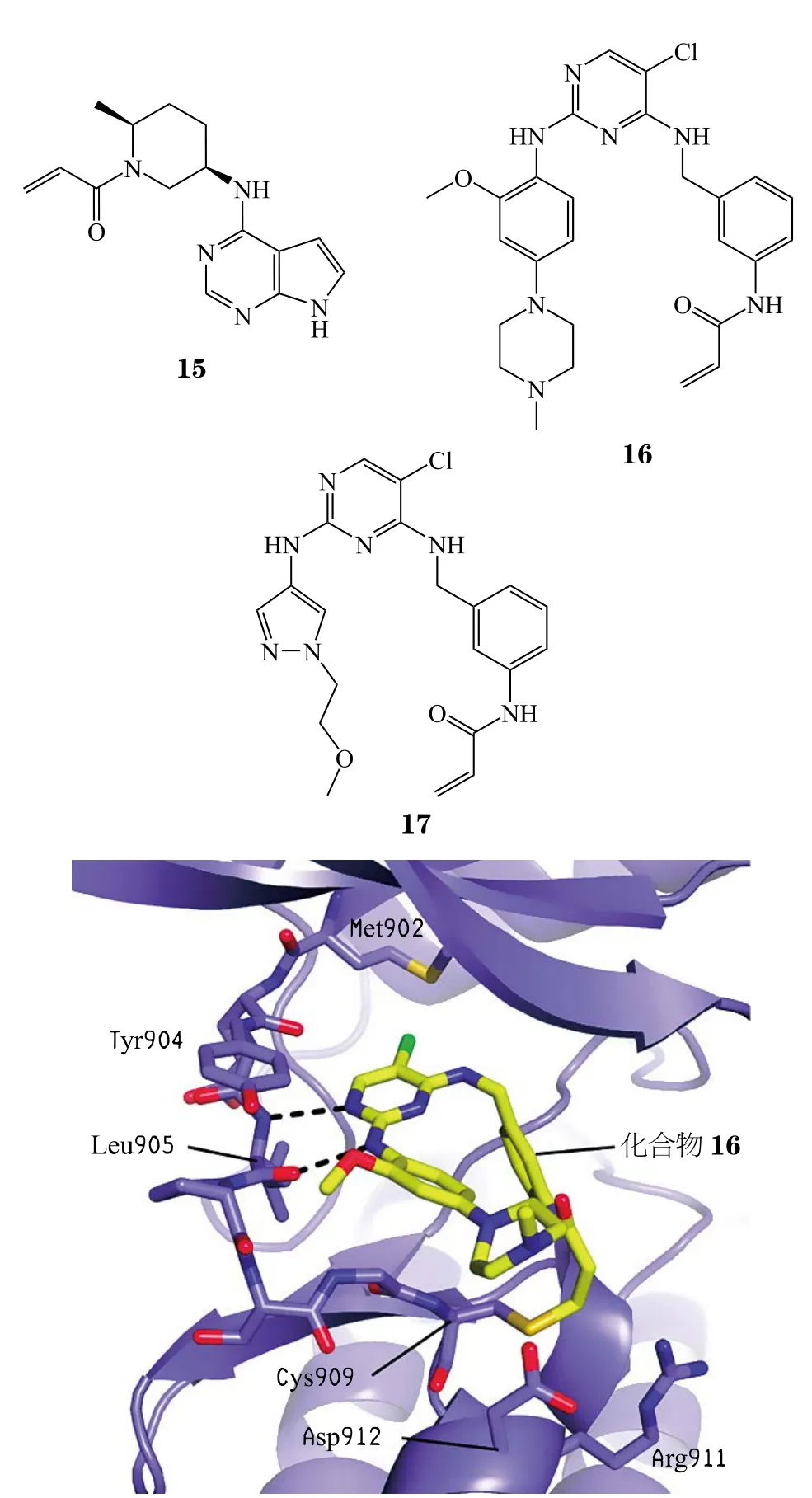
图 5 化合物16与Janus激酶3的X射线共晶结构[49]Figure 5 X-ray cocrystal structure of Janus kinase 3 in complex with compound 16
Kempson等[50]于2017年报道了新型的JAK3共价抑制剂18,作者以可逆的JAK3抑制剂(19)作为先导化合物,化合物19与JAK3对接显示吡啶和酰胺N能与铰链区形成2个关键氢键,尾部苯环片段伸向特异性Cys909(见图6)。作者在先导化合物尾部引入丙烯酰胺基团,其能够与Cys909加成形成共价键,得到了最优化合物18,酶活性和药动学参数优异(对JAK3的 IC50为 1.3 nmol · L-1)。
3.5 其他
Filgotinib(GLPG0634,20)是 JAK1选择性抑制剂,在动物关节炎模型中能够延缓疾病的进展,与依那西普效果相当,并呈现显著的剂量依赖[51]。在治疗RA的Ⅱb期临床试验中,与安慰剂组相比, fi lgotinib作为单一疗法在治疗活动性RA的体征和症状方面表现出显著性差异,且耐受良好[52]。
Pe fi citinib(21)是Astellas Pharma制药公司开发的JAKs抑制剂,其用于治疗RA的Ⅲ期临床试验正在进行中。与安慰剂相比,ACR20应答率显示出显著的统计学差异,且未见有严重感染病例的报道[53]。
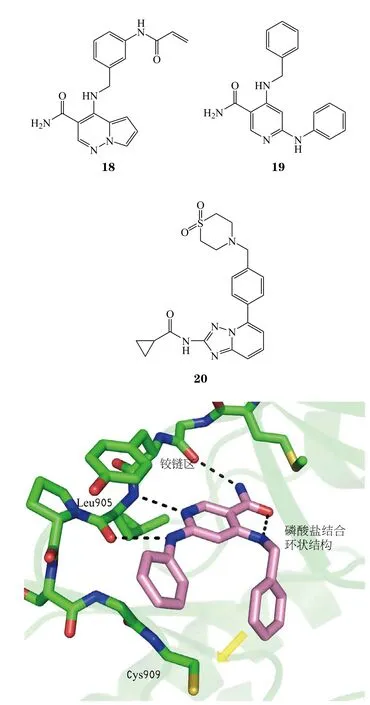
图 6 化合物19与Janus 激酶3对接模式图Figure 6 Docking model of compound 19 and Janus kinase 3
4 总结与展望
目前已证实JAKs在细胞增殖和分化过程中起到了重要的作用,JAKs通路中蛋白活性的改变将导致通路信号传递的改变,进而影响细胞功能。已有众多文献报道JAKs与人类疾病的关系,包括自身免疫性疾病、恶性肿瘤和血液疾病。基于JAKs家族在人体生理和病理过程中的关键作用,选择性抑制JAKs的某些亚型可以有效治疗相关疾病,而抑制其他亚型可能会导致不必要的副作用。例如,在对上市药物托法替尼的临床研究中发现,使用该药物后会导致某些不良反应,包括感染、结核、肿瘤和肝损伤等,研究表明其对几乎所有JAKs亚型都有活性,而上述不良反应被认为可能与之相关。与此同时,已有文献阐明不同的JAKs亚型介导不同的生理活动,而其突变也会导致不同的疾病[5,16]。例如,与其他亚型不同,JAK2作为促红细胞生成素下游的信号蛋白,其失调会导致严重的造血功能紊乱和肿瘤;而消除JAK3的功能将导致严重的联合免疫缺陷[5,16]。TYK2参与干扰素受体的信号,其缺陷导致各种复杂的临床表现,其中包括特应性皮炎和对各种病原体的易感性[5, 16, 43]。
因此,药物开发人员需要明确JAKs亚型所对应的适应证,在药物研发过程中避免不必要的不良反应。同时,相信随着分子生物学对JAKs通路研究的不断深入,开发JAKs选择性抑制剂将取得重大进展,为自身免疫性疾病和肿瘤等疾病的治疗提供新的思路。
