托法替尼治疗溃疡性结肠炎的研究进展Δ
2022-09-30吴澎泞熊帅杨婉卿陈敏成都中医药大学附属医院临床医学院成都60075成都中医药大学附属医院肛肠科成都60075
吴澎泞,熊帅,杨婉卿,陈敏(.成都中医药大学附属医院临床医学院,成都 60075;2.成都中医药大学附属医院肛肠科,成都 60075)
溃疡性结肠炎(ulcerative colitis,UC)属于炎症性肠病(inflammatory bowel disease,IBD),其具体发病机制尚不清楚。虽然目前针对细胞因子的药物治疗已经彻底改变了UC的治疗方法,但此类药物通常只针对单个细胞因子,仍有部分治疗无反应的患者的医疗需求未被满足。Janus激酶(JAK)-信号转导及转录激活因子(signaling transducers and activators of transcription,STAT)通路已被证实是UC发病的关键通路之一[1]。JAK抑制剂可通过影响多种促炎细胞因子依赖的途径治疗UC,其中托法替尼(tofacitinib)(亦称“枸橼酸托法替尼”“托伐菌素”“托法替布”)应用最为广泛。托法替尼是JAK抑制剂中第一个被美国FDA及欧洲药品管理局(European Medicines Agency,EMA)批准用于治疗中重度UC的药物[2]。美国胃肠病协会(American Gastroenterological Association,AGA)也建议,可将托法替尼用于UC的诱导治疗和维持治疗[3-4]。
目前,托法替尼在中国主要用于不能耐受甲氨蝶呤或应用甲氨蝶呤疗效差的中重度活动性类风湿关节炎(rheumatoid arthritis,RA)(5 mg,bid,口服)的治疗,暂未见其用于UC。本文通过综述托法替尼治疗UC的作用机制、临床应用和安全性研究进展等,以期为托法替尼在我国用于UC的相关研究和应用提供参考。
1 托法替尼治疗UC的作用机制
现有研究表明,各种免疫炎症细胞浸润是UC患者肠道炎症的重要特征,炎症细胞产生的细胞因子的生物学效应受JAK-STAT通路调控[5]。JAK-STAT通路在细胞生长、分化、增殖和调节免疫中均发挥了重要作用[6],各种细胞因子和蛋白酪氨酸激酶亦通过JAK-STAT通路产生效应,故通过JAK-STAT通路可调控众多基因的转录[7-9]。JAK-STAT级联信号转导的稳定性改变或基因突变会导致JAK-STAT通路过度激活,从而影响正常的基因转录和细胞过程,甚至引起免疫紊乱,进而导致免疫性疾病的发生[10-11]。不少研究表明,STAT3在黏膜T细胞的激活过程中发挥了关键作用,与IBD发病风险增加相关[12-14]。
研究表明,托法替尼可通过抑制JAK1、JAK2(抑制作用较小)和JAK3阻止STAT蛋白磷酸化,抑制相关基因表达,降低UC的免疫原性,减少炎症反应的发生[15-16]。细胞因子与特定受体结合可诱导受体二聚化,JAK与二聚化受体预结合并发生磷酸化,可使细胞因子受体链细胞质域中的特异性残基磷酸化形成STAT蛋白的“停靠位点”,进而招募STAT;一旦STAT与“停靠位点”对接,STAT就会被磷酸化;磷酸化的STAT二聚化后会迁移到细胞核中,在细胞核通过与DNA中特定的序列结合调节基因转录[15]。而托法替尼可通过抑制JAK磷酸化直接阻止STAT蛋白的磷酸化,进而抑制相关基因的表达,具体过程详见图1。此外,有研究发现,T细胞中过表达的STAT3会导致严重的结肠炎,而托法替尼可调节过度表达的STAT3信号;同时,托法替尼可通过调节紧密连接蛋白表达、过度表达的STAT3信号以及白细胞介素6(interleukin 6,IL-6)和IL-22的分泌,以纠正蛋白酪氨酸磷酸酶非受体2型(protein tyrosine phosphatase non-receptor 2,PTPN2)丢失时受损的屏障功能,而PTPN2的功能缺失可能导致肠道通透性增加和IBD的易感性升高[17]。Sayoc-Becerra等[18]的研究亦表明,托法替尼可通过修复肠道孔隙和渗漏-紧密连接屏障缺陷改善肠道上皮屏障功能。除以上机制外,适当剂量的托法替尼可能选择性地阻断JAK-STAT通路,使单核细胞向更具调节性的细胞表型转变,进而抑制促炎反应[19]。
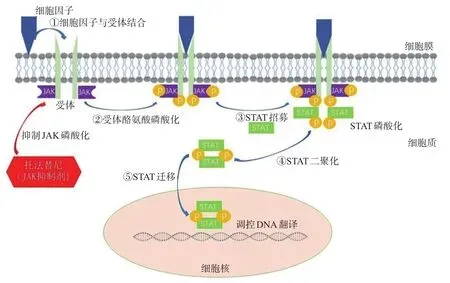
图1 托法替尼对JAK-STAT信号通路的作用过程
总之,托法替尼主要通过抑制JAK和促炎因子的表达、调节过表达的STAT3信号、修复肠黏膜屏障、使单核细胞向更具调节性的细胞表型转变等作用治疗UC。
2 托法替尼治疗UC的药动学特征
在药物代谢特征方面,托法替尼片吸收迅速,在0.5~1 h内即可达到血浆峰浓度,消除半衰期约3 h[20]。其绝对口服生物利用度为74%,进食与否不影响药物总的血药浓度。托法替尼在血浆中主要与白蛋白结合,蛋白结合率约40%,在红细胞和血浆之间均匀分布;托法替尼主要通过肝酶代谢,如细胞色素P450 3A4(CYP3A4)和CYP2D6[21]。治疗UC的生物制剂通常因抗药抗体的形成而导致药物清除率发生改变,故常需通过监测血药浓度以优化给药剂量;而给予托法替尼10或15 mg(每日2次)用于UC的诱导治疗时,则无须监测血药浓度[22],减少了临床应用的难度。
3 托法替尼治疗UC的临床应用研究进展
随着托法替尼被美国FDA及EMA批准用于治疗中重度UC,近几年针对托法替尼治疗中重度UC疗效及安全性的随机对照试验(randomized controlled trial,RCT)和真实世界研究不断增加,但其联合其他药物治疗UC的研究较少。
3.1 托法替尼治疗UC的RCT
早在2012年,为评估托法替尼在中重度活动性UC患者中的疗效,Sandborn等[23]开展了一项纳入了194名患者的随机、双盲、安慰剂对照的Ⅱ期临床试验。结果表明,与安慰剂相比,接受托法替尼治疗的中重度活动性UC患者更可能出现临床反应和缓解,且临床反应程度与剂量相关。但该试验规模小、时间短,无法全面评估该药在UC患者中的疗效和安全性。
为进一步证明在诱导和维持治疗UC中的疗效,Sandborn等[24]在诱导试验1和诱导试验2中分别纳入598和541名患者,并将托法替尼的使用分为诱导治疗期(10 mg,每日2次)和维持治疗期(5或10 mg,每日2次)。在诱导治疗期,托法替尼组有18.5%的患者在8周时出现缓解,安慰剂组有8.2%出现缓解;在维持治疗期,5、10 mg托法替尼组分别有34.3%、40.6%的患者在治疗52周时出现缓解,安慰剂组仅有11.1%出现缓解。该研究进一步证实了UC患者使用托法替尼用于诱导和维持治疗的疗效,且与之前的试验结果一致[23]。
在前人基础上,为进一步评估托法替尼在维持治疗期间是否可以减少剂量,Vermeire等[25]将140名患者随机1∶1分配至接受托法替尼5或10 mg组(均为每日2次给药),比较了托法替尼剂量减少至5 mg与维持在10 mg时的疗效和安全性。结果,5 mg组和10 mg组分别有77.1%和90.0%的患者在治疗第6个月时显示出Mayo评分下降;且接受5 mg维持治疗的患者治疗失败并升级到10 mg后,仍在治疗的第2个月和12个月时分别有57.9%和64.9%的患者病情重新获得缓解[26]。说明大多数使用托法替尼的患者在剂量降低后仍能维持缓解,且即使部分患者降低剂量后出现治疗失败,仍可能通过再次增加剂量而获得缓解。
为评估停药导致的维持治疗失败并重新使用该药的疗效,Panés等[27]评估了174名UC患者中断托法替尼治疗后再治疗的有效性和安全性。该研究随机选择了部分对托法替尼10 mg(每日2次)诱导治疗有反应的患者给予安慰剂治疗8周,之后,对出现治疗失败的患者重新给予托法替尼10 mg(每日2次)进行治疗。结果显示,再次使用托法替尼后,有临床反应、治疗缓解和内镜检查结果改善的患者在治疗后的第2个月分别占74.0%、39.0%和55.0%,在治疗后的第36个月分别占48.5%、37.4%和42.4%,表明托法替尼治疗中断后,仍有一部分患者通过再次给药使病情得到缓解。托法替尼除了可显著改善患者的临床症状和内镜检查结果之外,还可显著改善患者的生活质量。一项纳入了593名中重度活动性UC患者的研究发现,用药52周后,托法替尼10 mg(每日2次)组患者躯体健康评分和心理健康评分分别为0.3和0.1分,而安慰剂组分别为-5.2和-6.7分,差异有统计学意义(P<0.000 1)[28]。
3.2 托法替尼治疗UC的真实世界研究
3.2.1 托法替尼治疗UC的前瞻性研究 Jameshorani等[29]在伊朗进行了一项为期52周的前瞻性临床试验,研究共纳入了53名患者。结果显示,所有患者基于Mayo总评分和部分Mayo评分的临床缓解率在治疗52周时分别为61.1%和72.2%,且未见严重不良事件发生。Lair-Mehiri等[30]开展的一项前瞻性研究纳入了曾使用过肿瘤坏死因子α拮抗剂和维多珠单抗的难治性活动期UC患者。结果显示,接受托法替尼治疗的患者有1/3在第14周达到临床缓解(不再使用皮质类固醇治疗);70%的患者在1年内避免了结肠切除术,且安全性可接受。一项在荷兰15家医院进行的前瞻性临床试验中也得出了相似的结论,表明托法替尼是肿瘤坏死因子α拮抗剂和维多珠单抗失败后治疗UC的有效方法。然而,该研究观察到的托法替尼的不良事件发生率较高,最终导致6%的患者停药[31]。此外,Uzzan等[32]纳入了既往经英夫利昔单抗、环孢素治疗失败的55名难治性重度UC患者开展试验,结果证明因难治性重度UC发作而住院的患者在使用托法替尼后6个月内未行结肠切除术的生存率为73.6%,第6周临床缓解率和不再使用激素治疗的患者比例分别为60.0%和37.5%。但以上研究样本量较小,上述结论仍需多中心、大样本研究进一步证实。
3.2.2 托法替尼治疗UC的回顾性研究 Berinstein等[33]开展了一项回顾性病例对照研究,评估了托法替尼诱导治疗生物制剂和糖皮质激素依赖性急性严重UC患者的疗效。结果表明,托法替尼可降低患者90 d内的结肠切除率,且托法替尼10 mg(每日3次)具有保护作用,而10 mg(每日2次)则无显著保护作用。但该研究队列规模相对较小,研究结果可能无法直接推广至其他中心,且由于该研究为非随机分组,不能直接将结肠切除率的降低归因于托法替尼。尽管如此,该研究提出了一种可能性,即除了静脉内应用皮质类固醇外,口服托法替尼10 mg(每日3次)可能是使用过生物制剂的急性严重UC患者诱导治疗的有效策略。
雪莲原产于喜马拉雅山脉,扎根于高山草甸土之中。雪莲不喜欢生长在平缓地区,只有在海拔三四千米左右的高原山坡和冰碛岩缝之中才能看到它的身影。高山地带的气候十分寒冷,可以低至零下几十摄氏度,并且常年风雪交加,再加上空气稀薄缺氧,一般的植物在这样恶劣的环境中根本无法存活,但是雪莲这种菊科草本植物却可以在如此严峻的气候条件下顽强地活下来。
3.3 托法替尼联合其他药物治疗UC的研究
在托法替尼诱导治疗时,允许患者使用稳定剂量的口服5-氨基水杨酸(5-aminosalicylic acid,5-ASA)和皮质类固醇;维持治疗时,允许患者口服5-ASA,但需要逐渐减少皮质类固醇的剂量[21]。一项对需要生物制剂或托法替尼治疗的UC患者的分析表明,继续使用5-ASA治疗不具有经济性[34]。美国FDA不建议将托法替尼与UC的生物疗法或强效免疫抑制剂(如硫唑嘌呤和环孢素)联合使用[5],目前也未见关于JAK抑制剂与生物制剂(如肿瘤坏死因子拮抗剂)联合治疗UC的数据,也未见托法替尼与强效免疫抑制剂联合给药治疗UC的相关研究。
4 托法替尼的安全性
4.1 托法替尼在特殊人群中的应用
托法替尼在妊娠期患者中的安全性有待进一步研究。一项纳入301名育龄妇女的研究显示,在妊娠前或妊娠期间,有11名母亲和14名父亲使用了托法替尼(5或10 mg,每日2次),结果除2例自然流产和2例患者使用药物终止妊娠外,无胎儿及新生儿死亡,无先天性畸形[35]。然而因该研究纳入病例数较少,且目前缺乏其针对孕妇或哺乳妇女的临床对照研究,因此在妊娠期UC患者中仍应谨慎使用该药。
目前,托法替尼在UC儿童和青少年中的疗效和安全性尚不确切。Alajmi等[36]报道了1名13岁难治性UC患儿经托法替尼治疗后病情缓解,避免了手术治疗。但一项纳入21名年龄小于21岁的难治性UC患者的单中心回顾性研究显示,在12周的诱导期结束时,21名受试者中仅有9名出现临床缓解;在第52周接受评估的受试者中,17人中有7人出现临床缓解[37]。上述结果表明,托法替尼在治疗儿童和青少年UC患者中的经验有限,仍需进行大样本、多中心的临床试验予以确认。
一项纳入938名患者的安全性研究发现,托法替尼治疗UC发生严重感染、带状疱疹、机会性感染、恶性肿瘤、重大不良心血管事件(major adverse cardiovascular events,MACE)和胃肠道穿孔的发生率并未随着治疗时间的延长而提高[38]。但该研究仅纳入了62名65岁及以上的患者,样本量少,研究结果不足以确定他们的不良事件发生率与年轻患者是否不同。但由于一般老年人群感染发生率较高,托法替尼用于老年人时应更为谨慎。有学者在对应用托法替尼5或10 mg(每日2次)治疗的UC患者的长期扩展研究中观察到了恶性肿瘤的发生,故建议对于已确诊患有恶性肿瘤,或在治疗期间发生恶性肿瘤的患者,不推荐使用托法替尼[21]。
4.2 托法替尼导致的不良事件
研究表明,药物在体内抑制1个或多个JAK或STAT靶点可同时导致多种细胞因子通路受到抑制,并可能产生一些不可预测的影响,特别是在长期用药时[5]。虽然托法替尼指向特定的JAK受体,但是更高剂量的托法替尼可影响多个JAK受体,可能导致血液学、代谢或免疫方面的不良反应[39]。美国FDA指出,使用托法替尼可能增加严重感染、死亡、恶性肿瘤、MACE和血栓形成风险[21]。EMA建议,高剂量托法替尼不得应用于肺栓塞风险增加的患者[40]。一项纳入了260名UC患者的真实世界研究显示,患者不良反应发生率为15.7%,严重不良反应发生率为10.0%[41]。目前,托法替尼治疗UC最常见的严重不良反应是严重感染,尤其是带状疱疹感染;除此之外,关于托法替尼治疗UC时血栓形成的研究也较多。
4.2.2 血栓 深静脉血栓(deep venous thrombosis,DVT)和动脉血栓形成往往导致不良后果,甚至导致死亡。Sandborn等[43]对1 157例UC患者进行的回顾性分析结果显示,在诱导治疗期及维持治疗期,接受托法替尼治疗的患者均未发生DVT或肺动脉血栓的不良事件,但所有患者均伴有血栓形成的危险因素。由于该研究药物暴露量有限,具体的血栓形成风险仍需进一步研究证实。Lightner等[44]对53名结肠切除术后的难治性UC患者进行的回顾性研究结果显示,术后4周内接受托法替尼治疗的患者DVT发病率为13.2%(7名),血栓形成部位包括门静脉(4名)、髂内静脉(2名)和肺动脉(1名)。这表明,难治性UC患者术后使用托法替尼发生血栓栓塞的风险较高,故美国FDA提醒难治性UC患者术后使用托法替尼应该注意血栓栓塞事件的发生,在出院时应考虑延长预防血栓形成的治疗时间。
4.2.3 其他 其他常见的严重感染包括肺炎、蜂窝组织炎、泌尿系统感染等[21],故托法替尼应避免在患有活动性严重感染(包括局部感染)的患者中使用。此外,食管溃疡、肌酸激酶升高、机会性感染、流感、鼻咽炎等不良反应也曾见于托法替尼治疗UC的研究中,但发生率较低[16]。上述不良反应可能与高剂量托法替尼影响多个JAK受体有关[10]。
5 结语
UC具有慢性、复发性特点,给患者及社会带来了沉重的负担。JAK-STAT通路是UC发病的关键信号通路,托法替尼可作用于该通路治疗UC。托法替尼与生物制剂相比成本更低,患者获得的质量调整生命年数更多[45];此外,托法替尼可通过口服给药,患者的依从性较高。因此,国外针对其治疗UC的RCT、真实世界研究越来越多,但目前暂缺乏托法替尼与其他药物的比较研究。
2017年托法替尼于我国上市,被批准用于治疗难治性皮肌炎、RA等,暂无UC的适应证,目前国内也尚未见托法替尼治疗UC的临床研究。国外研究表明,托法替尼用于UC显示出较好的疗效和安全性,尤其是针对难治性UC患者,该药可降低UC患者行结肠切除术的几率或延迟切除时间。虽然已有研究证明托法替尼用于妊娠期患者的安全性较高,但样本量较小,说服力有限;加之其在儿童、青少年、老年UC患者中的疗效和安全性尚不确切,因此该药应慎用于妊娠期、儿童、青少年及老年UC患者。托法替尼治疗UC的不良反应亦不容忽视,尤其是带状疱疹感染、血栓栓塞、死亡、恶性肿瘤、MACE等。此外,未来需进一步研究托法替尼在我国人群中的疗效和安全性。
