KIM-1在TGF-β1诱导的大鼠肾小管上皮细胞纤维化因子表达中的作用
2019-03-01刘波王萍李霞张杰李丽
刘波 王萍 李霞 张杰 李丽
(1兖矿集团有限公司总医院肾内科,山东 邹城 273517;2济宁医学院附属医院肾内科)
肥胖、糖尿病、高血压等均会引起慢性肾脏疾病发生,肾小管间质纤维化是慢性肾脏疾病发展到终末期的共同特征,肾间质纤维化的发生与肾小管上皮细胞上皮间质转化(EMT)有关,在此过程中,上皮细胞标志特征逐渐消失,细胞开始表达α-平滑肌肌动蛋白(SMA)〔1,2〕。肾小管上皮细胞纤维化发生的诱导因素有很多,其中转化生长因子(TGF)-β1是重要的诱发因子,也是常用的体外研究肾小管上皮细胞纤维化的诱导因子〔3〕。肾脏损伤因子(KIM)-1是一种跨膜蛋白,可以反映肾功能的变化,在肾损伤中具有重要意义〔4,5〕。研究显示,KIM-1在肾纤维化组织中表达上调,并且可以用于判断肾功能的损伤情况〔6〕。本实验探讨KIM-1在TGF-β1诱导肾小管上皮细胞纤维化和EMT中的作用。
1 材料与方法
1.1主要材料 大鼠肾小管上皮细胞NRK52E购自成都正能生物;TGF-β1购自美国Pepreotech;Lipofectamine 2000购自美国Invitrogen;BCA蛋白检测试剂盒电化学发光(ECL)试剂盒购自美国Pierce;辣根过氧化物酶标记的免疫球蛋白(Ig)G购自美国Jackson;上皮钙黏附素(E-cadherin)抗体、α-SMA抗体购自美国BD;结缔组织生长因子(CTGF)抗体、1型胶原酶(Col1)抗体、3型胶原酶(Col3)抗体购自美国Abcam;荧光定量PCR试剂盒购自大连宝生物。
1.2细胞培养和分组 大鼠肾小管上皮细胞NRK52E培养于含10%胎牛血清的DMEM高糖培养液中,在37℃,5% CO2培养箱内培养。NRK52E细胞分为:对照组、对照组+TGF-β1、阴性组+TGF-β1、干扰组+TGF-β1,对照组+TGF-β1、阴性组+TGF-β1、干扰组+TGF-β1细胞分别用TGF-β1刺激,刺激方法为:在细胞培养液中添加10 ng/ml的TGF-β1继续孵育72 h。阴性组+TGF-β1、干扰组+TGF-β1细胞在TGF-β1刺激前,分别转染siRNA对照和KIM-1 siRNA,细胞转染用脂质体转染法,具体步骤同Lipofectamine 2000转染试剂说明书。
1.3qRT-PCR法检测 TGF-β1刺激后的肾小管上皮细胞中KIM-1的表达水平 对照组、对照组+TGF-β1细胞处理方法同上,提取细胞的RNA,步骤简述如下:在细胞中添加TRIZOL,用移液枪反复吹打混合后,转移到离心管中,以低温4℃,离心10 min,弃上清,加入三氯甲烷,上下颠倒混合后,置于冰上孵育15 min,低温4℃,离心10 min,吸取上清溶液,与异丙醇混合沉淀RNA,乙醇洗涤,用DEPC水溶解。取RNA,在72℃变性约10 min后,42℃孵育60 min,95℃孵育5 min,逆转录合成cDNA。取cDNA,用荧光定量PCR测定计算KIM-1 mRNA水平,步骤同荧光定量PCR试剂盒。
1.4Western印迹法检测TGF-β1刺激后的肾小管上皮细胞中KIM-1的表达水平 对照组、对照组+TGF-β1细胞处理方法同上,用PBS洗涤3次以后,在细胞中添加细胞裂解液,在冰上裂解30 min后,置于低温4℃离心10 min,吸取上清,保存在-80℃。用BCA法检测蛋白浓度。取蛋白样品,以每个泳道添加30 μg蛋白样品进行蛋白电泳,电泳用10%的分离胶、5%的浓缩胶。上样前,把蛋白样品与上样缓冲液在100℃孵育5 min。用转膜仪把蛋白转移到PVDF膜上,电流调整为350 mA。用5%脱脂奶粉封闭后,再分别与一抗和二抗反应,一抗以1∶600稀释,二抗以1∶2 000稀释。ECL显色,Alpha-view对蛋白进行定量分析。
1.5Western印迹检测细胞中EMT标志蛋白E-cadherin、α-SMA和纤维化因子CTGF、Col1、Col3的表达 对照组、对照组+TGF-β1、阴性组+TGF-β1、干扰组+TGF-β1细胞处理方法同上,用Western印迹法检测细胞中EMT标志蛋白E-cadherin、α-SMA和纤维化因子CTGF、Col1、Col3的表达,E-cadherin、α-SMA一抗以1∶800稀释,CTGF、Col1、Col3一抗以1∶1 000稀释。步骤同上。
1.6统计分析 应用SPSS21.0软件进行独立样本t检验、单因素方差分析、LSD-t检验。
2 结 果
2.1KIM-1在TGF-β1作用后的肾小管上皮细胞中表达上调 对照组+TGF-β1细胞中KIM-1蛋白和mRNA水平均显著高于对照组(P<0.05)。TGF-β1诱导肾小管上皮细胞表达KIM-1。见图1、表1。

图1 Western印迹检测KIM-1在TGF-β1作用后的肾小管上皮细胞中的表达

组别KIM-1 mRNAKIM-1蛋白对照组1.00±0.000.28±0.02对照组+TGF-β14.36±0.241)0.97±0.051)
与对照组比较:1)P<0.05
2.2转染KIM-1 siRNA后的肾小管上皮细胞中KIM-1蛋白和mRNA水平表达下调 干扰组+TGF-β1细胞中KIM-1蛋白和mRNA水平较对照组+TGF-β1显著降低(P<0.05)。阴性组+TGF-β1细胞中KIM-1蛋白和mRNA水平与对照组+TGF-β1比较差异无统计学意义(P>0.05)。KIM-1 siRNA成功下调了肾小管上皮细胞中KIM-1的表达和转录。见图2、表2。
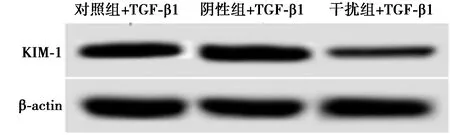
图2 Western印迹测定转染KIM-1 siRNA后的肾小管上皮细胞中KIM-1蛋白表达

组别KIM-1 mRNAKIM-1蛋白对照组+TGF-β11.00±0.000.93±0.11阴性组+TGF-β10.98±0.130.95±0.14干扰组+TGF-β10.41±0.061)0.36±0.051)
与对照组+TGF-β1比较:1)P<0.05
2.3下调KIM-1抑制TGF-β1诱导的肾小管上皮细胞EMT 与对照组比较,对照组+TGF-β1细胞中E-cadherin蛋白表达显著下调,α-SMA蛋白表达显著升高(P<0.05)。与对照组+TGF-β1比较,干扰组+TGF-β1细胞中E-cadherin蛋白水平显著升高,α-SMA蛋白水平显著降低(P<0.05)。阴性组+TGF-β1细胞中E-cadherin、α-SMA蛋白与对照组+TGF-β1比较,差异无统计学意义(P>0.05)。TGF-β1诱导肾小管上皮细胞EMT,而下调KIM-1可以减弱TGF-β1对肾小管上皮细胞EMT的诱导作用。见图3、表3。

组别E-cadherinα-SMA对照组0.83±0.090.25±0.04对照组+TGF-β10.48±0.071)0.75±0.091)阴性组+TGF-β10.46±0.080.73±0.05干扰组+TGF-β10.67±0.072)0.60±0.052)
与对照组比较:1)P<0.05;与对照组+TGF-β1比较:2)P<0.05,下表同
2.4下调KIM-1抑制TGF-β1诱导的肾小管上皮细胞表达纤维化因子CTGF、Col1、Col3 与对照组比较,对照组+TGF-β1细胞中CTGF、Col1、Col3蛋白表达显著升高(P<0.05)。与对照组+TGF-β1比较,干扰组+TGF-β1细胞中CTGF、Col1、Col3蛋白水平显著降低(P<0.05)。阴性组+TGF-β1细胞中CTGF、Col1、Col3蛋白与对照组+TGF-β1比较,差异无统计学意义(P>0.05)。TGF-β1诱导肾小管上皮细胞表达纤维化因子CTGF、Col1、Col3,而下调KIM-1可以减弱TGF-β1对肾小管上皮细胞表达CTGF、Col1、Col3的诱导作用。见表4、图4。

图4 Western印迹检测下调KIM-1后的肾小管上皮细胞纤维化因子的表达

组别CTGFCol1Col3对照组0.35±0.030.25±0.020.12±0.03对照组+TGF-β10.69±0.051)0.52±0.061)0.28±0.021)阴性组+TGF-β10.68±0.090.53±0.080.29±0.04干扰组+TGF-β10.46±0.052)0.40±0.042)0.19±0.032)
3 讨 论
KIM-1蛋白含有一个6个半胱氨酸构成的球蛋白和黏液素的功能区域连接而成的结构域,在正常的肾脏组织中表达水平极低,在损伤后的肾组织中异常升高〔7,8〕。KIM-1水平与患者肾组织损伤程度的诊断、预后等有关〔9〕。KIM-1可以诱导急性肾损伤大鼠肾小管上皮细胞发挥清除组织碎片的作用,而清除组织碎片有利于肾小管重构,KIM-1是急性肾损伤发生后炎症反应的关键环节〔10,11〕。同样在慢性肾损伤中发现,KIM-1表达明显的区域肾小管损伤严重,肾纤维化程度高,KIM-1与慢性肾脏疾病有关〔12,13〕。研究显示,TGF-β1刺激后的肾小管上皮细胞中KIM-1表达水平升高,KIM-1可能参与肾小管上皮细胞纤维化的发生〔14〕。本实验的结果显示,TGF-β1处理以后的肾小管上皮细胞中KIM-1的转录和表达水平均升高,这与上述报道相符合。上皮细胞黏附在基底膜上,是一种极性细胞,其侧面可以与邻近的上皮细胞相互作用,形成类似于铺路石样的形态,而间充质细胞可以分化为多种不同的间质细胞,在胚胎的发育中具有重要作用〔15〕。EMT主要表现为上皮细胞形态特征减弱,逐渐与基底膜分离,并获得间质细胞的标志,在心肌纤维化、肾组织纤维化、癌症转移等疾病的发生中有重要作用〔16〕。肾小管上皮细胞EMT的发生与肾组织的损伤有关,如肾小球肾炎、高血压、糖尿病肾病等,研究表明,在不同原因引起的肾组织损伤中均发现有不同程度的肾小管EMT,并且EMT发生水平不仅与血肌酐水平等相关,还与肾纤维化的程度及预后有关〔17〕。本实验结果显示,TGF-β1处理后的肾小管上皮细胞EMT水平升高,而敲低KIM-1可以抑制TGF-β1诱导的肾小管上皮细胞EMT,提示KIM-1在肾小管上皮细胞转分化中具有重要作用。
肾组织纤维化与细胞分泌的多种纤维化因子的表达有关,CTGF是由349个氨基酸组成的多肽,属于一种生长因子,参与细胞外基质、细胞黏附、有丝分裂等过程,在肾纤维化中发挥促进作用,在多种原因引起的肾损伤中表达上调〔18〕。Col1、Col3过度表达是肾纤维化发生的重要原因,其表达水平升高后可以促进肾小管上皮细胞纤维化〔19〕。研究表明,TGF-β1作为一种重要的肾纤维化诱发因子,可以促进肾小管上皮细胞中Col1、Col3、CTGF的表达〔20〕。本实验结果表明,敲低KIM-1可以抑制TGF-β1诱导的肾小管上皮细胞表达Col1、Col3、CTGF,敲低KIM-1具有抑制肾小管上皮细胞纤维化的作用。
KIM-1在肾纤维化中表达上调,在TGF-β1诱导肾小管上皮细胞纤维化中表达升高,敲低KIM-1的表达水平可以抑制TGF-β1诱导的肾小管上皮细胞EMT和表达纤维化因子,KIM-1可能是一个潜在的干预肾间质纤维化的靶点。
