加味脑泰方对去势脑缺血大鼠海马ATF4/CHOP/Puma通路的影响*
2019-02-28秦莉花成绍武王国佐王珊珊龚盛强葛金文
秦莉花, 刘 林, 成绍武, 李 晟, 王国佐, 黄 娟, 刘 洋, 王珊珊, 龚盛强, 程 诚, 葛金文△
(湖南中医药大学 1中西医结合心脑疾病防治湖南省重点实验室, 2护理学院, 3第一附属医院, 4人文与管理学院, 湖南 长沙 410208)
文献研究显示女性缺血性脑卒中患者治疗后的死亡率、复发率、残疾率和病死率明显高于男性患者[1];实验研究也发现雌性去势后脑缺血发病率更严重[2];绝经后女性更容易发生中风[3]。缺血性脑卒中发病机制复杂,涉及多方面[4],最终导致神经元死亡。而内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡途径是新发现的凋亡信号途径[5]。 中医药治疗中风历史悠久、有丰富的临床经验。脑泰方治疗急性脑梗死临床疗效显著[6],本课题组前期研究发现加味脑泰方(Jiawei-Naotai formula, JWNTF)能抑制缺血性脑卒中海马神经元死亡[2]。为了进一步研究加味脑泰方抗去势脑缺血大鼠神经细胞死亡的机制,采用去势脑缺血大鼠为研究对象,研究加味脑泰方对去势脑缺血海马神经元活化转录因子4(activating transcription factor 4,ATF4)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、p53上调凋亡调控因子(p53 up-regulated modulator of apoptosis,Puma)、Bax、Bcl-2和caspase-3蛋白,以及Bax、Bcl-2和caspase-3 mRNA表达的影响。
材 料 和 方 法
1 动物
清洁级雌性Sprague-Dawley (SD)大鼠24只,体质量(230±10) g, 8~10周龄,由湖南中医药大学第一附属医院实验中心提供,许可证号为SCXK(湘)2014-0013,常规标准饲料分笼喂养。
2 药物
加味脑泰方由黄芪20 g、墨旱莲15 g、地龙10 g、女贞子10 g、僵蚕10 g和川芎5 g组成,经湖南中医药大学第一附属医院实验中心经水煎煮浓缩冷冻备用。实验用加味脑泰方的剂量是24 g/kg。17β-雌二醇(17β-estradiol,17β-E2)的剂量是0.18 mg/kg。所有药物购于湖南中医药大学第一附属医院。
3 试剂与仪器
抗ATF4、CHOP、PUMA、Bax和Bcl-2抗体(北京博奥森公司);抗caspase-3(activated)抗体(上海生工); II 抗(北京中杉金桥公司);ECL化学发光试剂盒(GE Healthcare);水合氯醛(国药集团);线栓(2636 A4,北京西浓科技有限公司)。凝胶成像分析系统(Bio-Rad)。
4 方法
4.1分组及给药 将大鼠随机分为假手术(sham)组、模型(model;去卵巢+脑缺血)组、阳性对照(po-sitive control,PC;雌激素+去卵巢+脑缺血)组和加味脑泰方(JWNTF;加味脑泰方+去卵巢+脑缺血)组。行去卵巢术后第11天阳性对照组和加味脑泰方组分别给予 17β-E2和加味脑泰方灌胃,剂量为0.18 mg/kg和24 g/kg,连续灌胃3 d;假手术组和模型组均给予等量生理盐水灌胃。
4.2动物模型的建立 参照前期的造模方法[2, 7]进行去卵巢术和脑缺血模型的造模。将模型组、阳性对照组和加味脑泰方组大鼠术前禁食12 h,腹腔注射0.1 kg/L水合氯醛麻醉后,于背部两侧剪开约3 cm切口,扎紧双侧输卵管后切除双侧卵巢,缝合;假手术组于背部剪开切口后直接缝合。手术后腹腔注射青霉素3 d。
去卵巢术后第5天起,连续5 d,每天取大鼠阴道分泌物进行涂片以不出现动情周期反应为去势模型成功。去卵巢术后第14天模型组、阳性对照组和加味脑泰方组大鼠采用大脑中动脉内栓线阻断方法制备脑缺血模型,腹腔注射水合氯醛麻醉后,颈部正中切开皮肤,暴露右颈总动脉,分离颈外动脉和颈内动脉,结扎颈外动脉近、远心端,鱼线插入颈内动脉,深度约(18.5±0.5) mm至微感阻力,用线固定线栓,逐层缝合。术后24 h进行参考Longa的5分制法[5]进行神经功能评分,1~3分为模型成功。假手术组仅切开皮肤、分离颈总动脉后即缝合。
4.3RT-qPCR实验 脑缺血造模24 h行神经功能评分后,大鼠用腹腔注射0.1 kg/L水合氯醛麻醉,将在冰盒上快速取右侧海马组织置于液氮冻存,-80 ℃冰箱保存备用,用1 mL TRIzol提取海马组织总RNA,具体操作按照TRIzol试剂盒说明的步骤进行,RNA的浓度和纯度分别通过紫外分光光度计测定和电泳检测。按照逆转录试剂盒合成cDNA并进行 PCR扩增,反应条件为: 95 ℃ 15 min; 95 ℃ 20 s、59 ℃ 1 min、95 ℃ 15 s、72 ℃ 15 s, 40个循环。反应结束后确认PCR的扩增曲线和熔解曲线,得出Ct值,同一cDNA样本设3个复孔,求其Ct均值,并以β-actin的Ct值作为内参照。引物序列见表1。

表1 RT-qPCR的引物序列
4.4Western blot实验 将取材后于-80 ℃冰箱保存的海马组织,按说明书提取蛋白并测定含量,采用考马斯亮蓝法检测蛋白质含量。经灌胶、上样、凝胶电泳、转膜等步骤后,加入5% TBST-BSA于室温封闭1 h,分别与兔抗大鼠ATF4、CHOP、Puma、Bcl-2、Bax和caspase-3 抗体(1∶100)和兔抗大鼠β-actin抗体(1∶500)溶液混合,4 ℃摇床过夜,用TBST在室温下脱色摇床上洗2次,每次10 min,再用TBS 1次,每次10 min。然后加入山羊抗兔 II 抗(1∶2 500)室温下孵育1 h后,用TBST在室温下脱色摇床上洗2次,每次10 min,再用TBS洗1次。采用ECL化学发光法显影,加入ECL化学发光液反应1 min后放入凝胶成像系统中扫描成像,以β-actin作为内参照,用Quantity One软件分析目标条带的吸光度。
5 统计学分析
所有数据均输入计算机,用SPSS 17.0软件进行处理。实验数据以均数±标准差(mean±SD)表示,多组间比较如方差齐时用访查分析,并选择SNK-q法进行各组均数间的两两比较,方差不齐选择Dunnett T3法。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠的神经功能评分
与假手术组比较,其余各组大鼠的神经功能评分明显升高(P<0.05);与模型组比较,阳性对照组和加味脑泰方组大鼠的神经功能评分明显降低(P<0.05);加味脑泰方组与阳性对照组比较差异无统计学显著性,见图1。
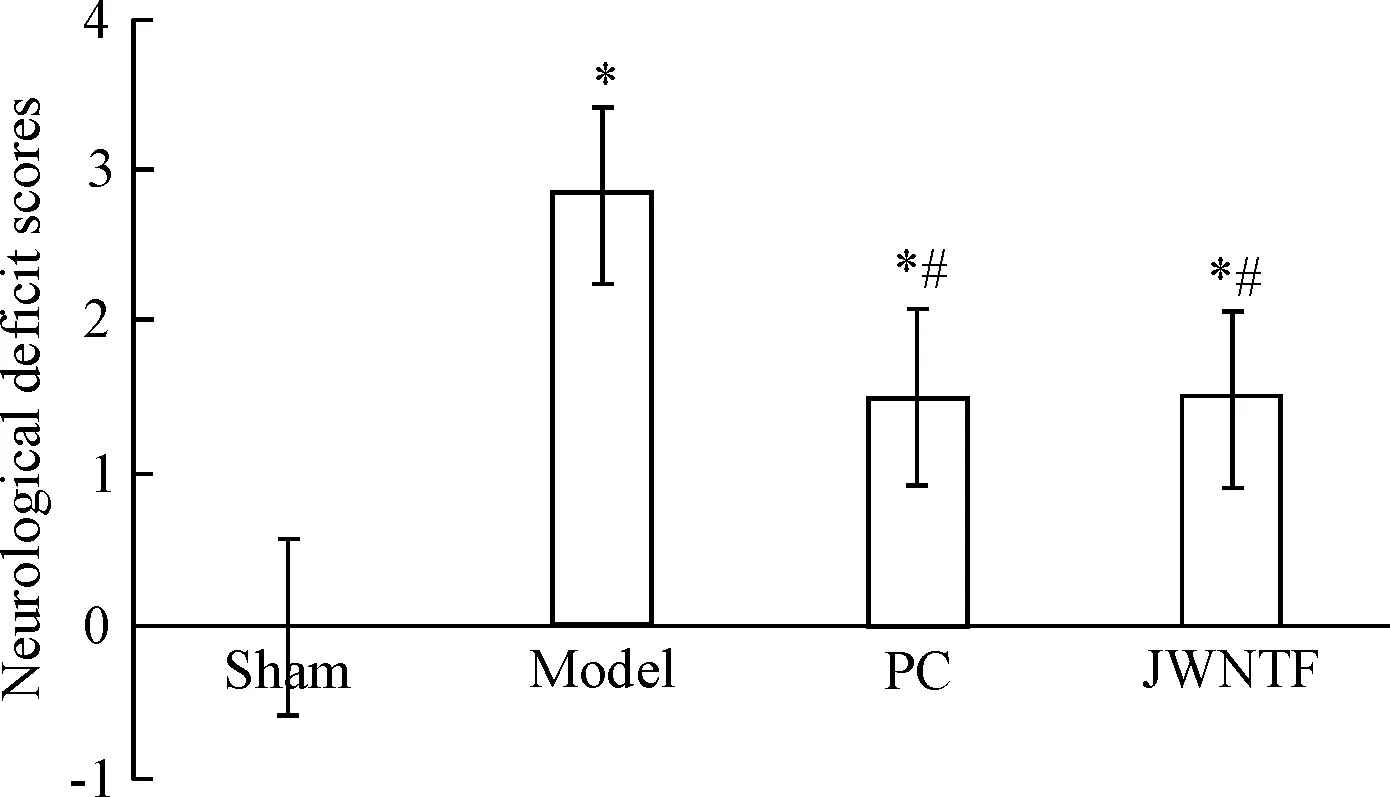
Figure 1.Neurological deficit scores of the rats in each group. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsmodel group.
图1各组大鼠的神经功能评分
2 各组大鼠海马Bax、Bcl-2和caspase-3的mRNA表达
与假手术组比较,其余各组Bax和caspase-3的mRNA表达明显增高,Bcl-2的mRNA表达明显降低(P<0.05);与模型组比较,阳性对照组和加味脑泰方组的Bax和caspase-3的mRNA明显降低,Bcl-2明显升高(P<0.05);与阳性对照组比较,加味脑泰方组caspase-3的mRNA表达明显减低(P<0.05),见表2。

表2 各组大鼠海马组织中Bax、Bcl-2和caspase-3的mRNA表达
*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsPC group.
3 加味脑泰方对去势脑缺血大鼠海马ATF4、CHOP、Puma、Bax、Bcl-2和caspase-3蛋白表达的影响
与假手术组比较,各组大鼠海马组织中ATF4、CHOP、Puma、Bax和caspase-3的蛋白表达明显升高,Bcl-2的蛋白水平明显降低(P<0.05);与模型组比较,阳性对照组和加味脑泰方组的ATF4、CHOP、Puma、Bax和caspase-3蛋白表达明显降低、Bcl-2明显升高(P<0.05);与阳性对照组比较,加味脑泰方组的ATF4和Puma蛋白表达降低(P<0.05),见图2及表3、4。
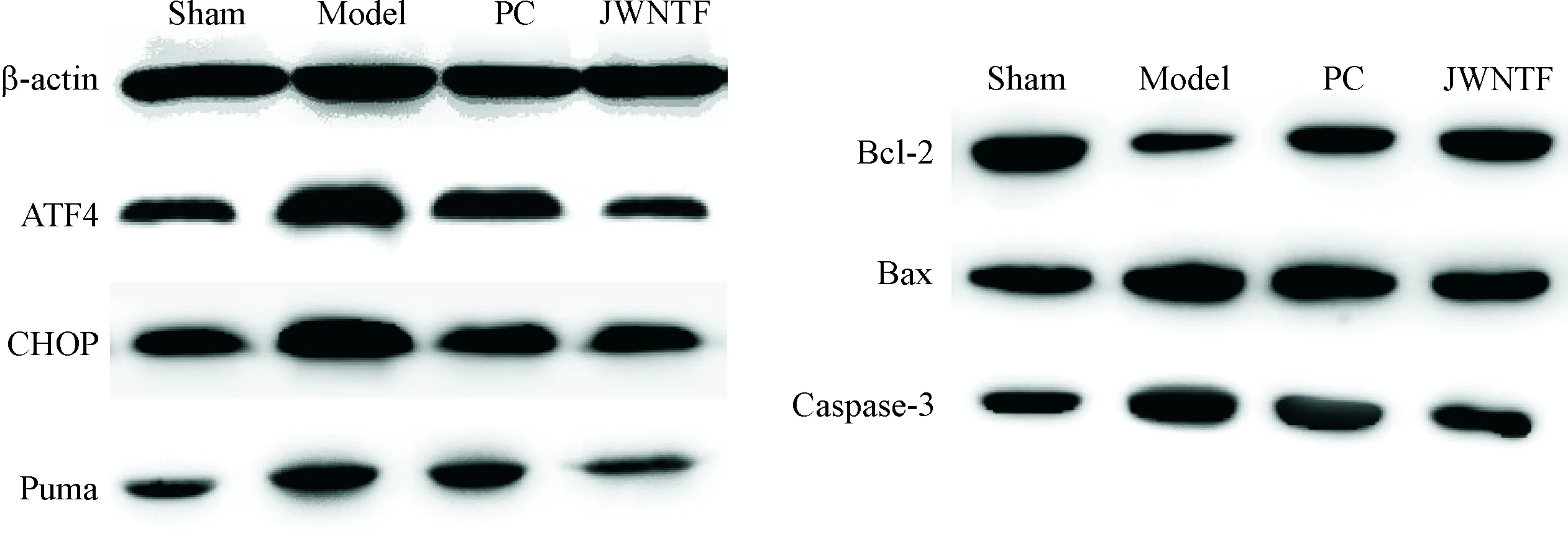
Figure 2.The effects of JWNTF on the protein levels of Bax, Bcl-2, caspase-3, ATF4, CHOP and Puma determined by Western blot.
图2Westernblot分析结果
表3各组大鼠海马组织中Bax、Bcl-2和caspase-3蛋白的表达
Table 3.The protein expression of Bax, Bcl-2 and caspase-3 in the rat hippocampus of each group (Mean±SD.n=6)
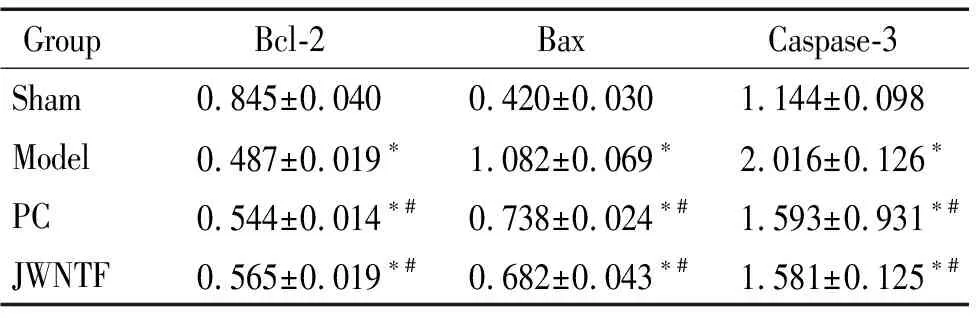
GroupBcl-2BaxCaspase-3Sham0.845±0.0400.420±0.0301.144±0.098Model0.487±0.019∗1.082±0.069∗2.016±0.126∗PC0.544±0.014∗#0.738±0.024∗#1.593±0.931∗#JWNTF0.565±0.019∗#0.682±0.043∗#1.581±0.125∗#
*P<0.05vssham group;#P<0.05vsmodel group.
表4各组大鼠海马组织中ATF4、CHOP和Puma蛋白的表达
Table 4.The protein expression of ATF4,CHOP and Puma in the rat hippocampus in each group (Mean±SD.n=5)
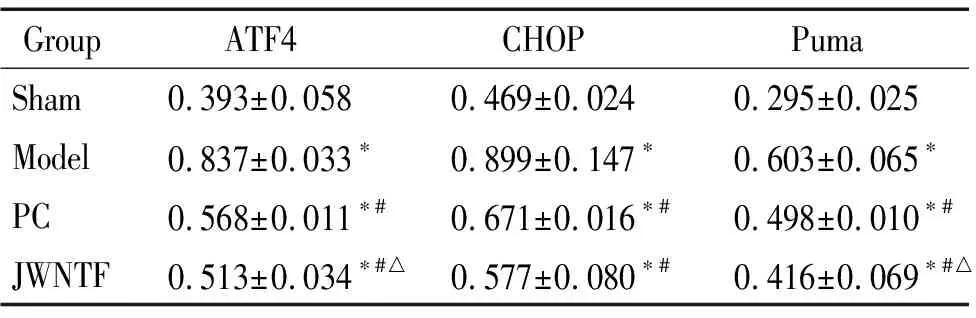
GroupATF4CHOPPumaSham0.393±0.0580.469±0.0240.295±0.025Model0.837±0.033∗0.899±0.147∗0.603±0.065∗PC0.568±0.011∗#0.671±0.016∗#0.498±0.010∗#JWNTF0.513±0.034∗#△0.577±0.080∗#0.416±0.069∗#△
*P<0.05vssham group;#P<0.05vsmodel group;△P<0.05vsPC group.
讨 论
缺血性脑卒中神经损伤的分子机制复杂,与钙超载、内质网应激和谷氨酸盐中毒等密切相关[4],其中CHOP通路是ERS诱导细胞凋亡主要通路[8],CHOP基因是ERS特异性转录因子,也是发生过度ERS的标志。ERS上游3条信号通路IRE-1、ATF6和PERK途径的激活存在广泛交流,都能激活CHOP基因的转录,而最主要途径为 PERK/elF2α/ATF4信号通路,诱导CHOP蛋白表达最为强烈[5],而CHOP是细胞凋亡的重要标志物[9],因此,CHOP在PERK通路诱导的细胞调亡过程中起决定性的作用。CHOP与ATF4可能作为ERS和凋亡信号通路中重要的调节信号分子,决定细胞的最终走向[10],其中Puma是CHOP的一个下游基因,是Bcl-2家族BH3-onIy亚家族成员,其凋亡效应是通过其BH3结构域和Bax/Bak及Bcl-2/Bcl-xL相互作用、竞争结合Bcl而激活了Bax的转位而实现。当Bcl-2高表达时具有抗细胞凋亡作用,反之,则启动凋亡。Caspase家族成员中的 caspase-3被称为“死亡执行蛋白酶”,在细胞凋亡过程中占核心地位[11]。Bcl-2和Bax被激活后通过线粒体途径介导细胞色素C和其它凋亡因子释放,激活caspase-3,诱导细胞死亡。
当细胞受到感染或缺血、缺氧刺激持续存在时,CHOP表达上调从而诱发细胞凋亡[9]。文献报道氧糖剥夺引起海马神经元细胞损伤,ATF4表达增加[12];动物实验发现脑缺血/再灌注大鼠模型中CHOP表达明显升高[9,13]。雄性大鼠脑缺血后Bcl-2和caspase-3表达降低,Bax表达升高[14-15],这与我们的实验结果一致。本研究结果显示去势脑缺血大鼠海马组织caspase-3表达明显升高,与文献报道一致[16]。
溶栓治疗是治疗急性期缺血性脑卒中最有效的治疗方法。但是,由于溶栓治疗时间窗的限制致目前患者行溶栓治疗的比例很低[16],因此,开发一种安全、有效的药物对缺血性脑卒中的治疗非常必要。前期研究显示加味脑泰方明显抑制细胞死亡[2]。本研究显示加味脑泰方抑制ATF4、CHOP、Puma、Bax和caspase-3表达,促进Bcl-2表达,这提示加味脑泰方可能通过抑制ATF4/CHOP/Puma通路以减轻缺血性脑卒中脑损伤。加味脑泰方中黄芪、二至丸(女贞子、墨旱莲)均具有植物雌激素作用[17-18],前期也显示能提高雌激素水平[2]。雌激素主要通过与雌激素受体(estrogen receptor,ER)结合而发挥作用,ER可通过其它转录因子(AP1和SP1等)与DNA非直接结合、非配体依赖式与DNA结合调节基因的表达。沉默AP-1基因后CHOP基因表达降低[19],而PUMA基因富含GC序列,SP1和Puma基因的启动子相结合,促进Puma表达从而诱导凋亡[20],提示ATF4/CHOP/Puma通路与ER密切相关。而本研究不足之处是并未研究两者的相关性,今后将采用ER和ATF4/CHOP/Puma通路的抑制剂进行干预,进一步研究两者的关系。
