SDF-1α/CXCR4轴通过诱导胰腺癌上皮-间充质转化促进肿瘤迁移和侵袭*
2019-02-28李若梦邹金茂李雅晴陈少杰练国达陈茵婷黄开红
李若梦, 邹金茂, 李雅晴, 陈少杰, 练国达, 陈茵婷, 苏 红, 黄开红
(中山大学孙逸仙纪念医院消化内科, 广东省恶性肿瘤表观遗传和基因调控重点实验室, 广东 广州 510120)
胰腺癌发病隐匿,早期即可发生远处转移,且对放化疗均不敏感,因此临床预后极差,5年生存率仅为6%[1-2]。近年来,越来越多的证据表明肿瘤微环境(tumor microenvironment,TME)在胰腺癌的发生发展过程中发挥重要作用[3]。基质细胞衍生因子1 (stromal cell-derived factor-1,SDF-1; 又称趋化因子CXCL12)作为胰腺癌微环境中一种重要的趋化因子,主要在肿瘤间充质细胞中表达,而肿瘤细胞则高表达其特异性受体CXCR4。SDF-1/CXCR4轴可激活多条下游信号通路,参与胰腺癌的发生发展过程,尤其是侵袭和转移[4]。本研究旨在探讨SDF-1/CXCR4轴对胰腺癌细胞迁移和侵袭能力的影响及其作用机制。
材 料 和 方 法
1 细胞
人胰腺癌细胞株PANC-1和Capan-2购自ATCC, BxPc-3和SW1990购自中国科学院细胞库。
2 主要试剂和仪器
SDF-1α购自Peprotech;AMD3100购自Sigma-Aldrich;兔抗人E-cadherin单克隆抗体、兔抗人N-cadherin单克隆抗体、兔抗人波形蛋白(vimentin)单克隆抗体、鼠抗人SNAIL单克隆抗体和鼠抗人β-actin单克隆抗体均购自Cell Signaling Technology;兔抗人TWIST多克隆抗体购自Abcam;高糖DMEM培养液购自Gibco;胎牛血清购自HyClone;TRIzol购自TaKaRa;基质胶和Transwell小室(8 μm孔径,聚碳酸酯膜)购自Corning;HRP标记山羊抗兔IgG(H+L)购自上海爱必信公司;HRP标记山羊抗鼠IgG(H+L)购自Merck Millipore;MTS试剂购自Promega;其它生化试剂均为进口分装或国产分析纯。PCR引物由上海生工生物工程公司合成,见表1。LightCycler 96 Real-Time PCR System(Roche);G:BOX XT4智能成像系统(Syngene);Eclipse 80i正置成像显微镜 (Nikon)。

表1 引物序列
3 主要方法
3.1细胞培养 人胰腺癌细胞株PANC-1、BxPc-3、SW1990和Capan-2均培养于含10%胎牛血清的DMEM培养液、恒温37 ℃、5%CO2培养箱中,培养瓶中的细胞贴壁生长至80%~90%融合时用0.25%胰蛋白酶消化传代。
3.2SDF-1α及AMD3100处理PANC-1细胞实验分组 将细胞接种于12孔板中,每孔加入1 mL完全培养液,含1.5×105个细胞。待细胞贴壁生长至约80%融合时,去掉培养液,用PBS洗2遍后,每孔加入1 mL无血清培养液饥饿处理细胞12 h。12 h后,去掉培养液。为检测SDF-1α处理不同时间对细胞上皮-间充质转化(epithelial-mesenchymal transition, EMT)相关标志物表达的影响,各组分别加入1 mL含100 μg/L SDF-1α无血清培养液处理细胞12 h、24 h、48 h和72 h;为检测不同浓度SDF-1α对细胞EMT相关标志物表达的影响,参考相关文献的浓度分组[5],我们设置了50 μg/L、100 μg/L和200 μg/L 3个SDF-1α浓度梯度组,即各组分别加入1 mL含50 μg/L、100 μg/L和200 μg/L SDF-1α无血清培养液处理细胞48 h;为检测激活或阻断CXCR4对细胞EMT相关标志物表达的影响,我们设置了对照组、SDF-1处理组、SDF-1+AMD3100处理组和AMD3100处理组,对照组仅加入1 mL无血清培养液,SDF-1处理组加入1 mL含100 μg/L SDF-1α的无血清培养液,SDF-1+AMD3100处理组先加入1 mL含1 mg/L AMD3100的无血清培养液于培养箱孵育30 min后再加入100 μg/L SDF-1α,AMD3100处理组加入1 mL含1 mg/L AMD3100的无血清培养液,处理细胞48 h。
3.3RT-qPCR实验检测CXCR4的表达 按TRIzol说明书提取细胞总RNA,逆转录为CDNA。PCR反应在LightCycler 96 PCR仪上进行,每个样品同时设3个复孔。反应程序为:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,97 ℃ 1 s,40个循环;37 ℃ 30 s,1个循环。反应结束后,记录扩增曲线、熔解曲线及样本的循环阈值(Ct),以β-actin为内参照校正各组mRNA的表达水平,采用2-ΔΔCt公式进行相对定量计算。实验独立重复3次。
3.4Western blot实验 细胞处理相应时间后,用PBS洗3次,加RIPA裂解15 min后提取细胞蛋白,用BCA试剂盒测定蛋白浓度。20 μg等量蛋白上样,SDS-PAGE (70 mV恒压电泳至肉眼可见Marker分离后,换100 mV恒压电泳),用0.45 μm PVDF膜200 mA恒流电转150 min,5%脱脂奶粉封闭1 h,加入Ⅰ抗稀释液(1∶1 000)4 ℃孵育过夜;TBST洗膜后,加入Ⅱ抗稀释液 (1∶5 000)室温孵育1 h。洗膜后用化学发光法(ECL)显像。
3.5Transwell迁移和侵袭实验 将Transwell小室置于24孔板中。侵袭实验前,在小室上室铺70 μL 1∶10稀释基质胶,置于培养箱过夜,待胶凝固后备用。迁移试验无需铺胶。将处于对数生长期的PANC-1细胞消化后用PBS洗1遍,用无血清培养液制成3×108/L的细胞悬液,分为对照组、SDF-1处理组、SDF-1+AMD3100处理组和AMD3100处理组:对照组和SDF-1处理组为仅含无血清培养液的细胞悬液,SDF-1+AMD3100处理组和AMD3100处理组的细胞悬液中先加入1 mg/L AMD3100于培养箱孵育30 min。向各组每个小室上室加入100 μL细胞悬液;对照组和AMD3100处理组下室加入500 μL含1%血清的培养液,SDF-1处理组和SDF-1+AMD3100处理组下室加入500 μL含1%血清和100 μg/L SDF-1α的培养液。将含小室的24孔板置于37 ℃、5%CO2培养箱中培养16 h(迁移试验)和48 h(侵袭试验)。培养相应时间后,取出小室,用棉签轻轻擦去上室面细胞;纯甲醇室温固定下室面细胞15 min,PBS洗2次,棉签擦干上室面,室温放置5 min晾干;用结晶紫染色液染30 min,用双蒸水洗3次,室温充分风干;置于显微镜下观察并拍照,计算穿膜细胞数。实验独立重复3次。
3.6MTS实验 分为对照组、SDF-1处理组、SDF-1+AMD3100处理组和AMD3100处理组,对照组为仅用完全培养液重悬的细胞悬液,SDF-1处理组为含100 μg/L SDF-1α的细胞悬液,SDF-1+AMD3100处理组细胞悬液中先加入1 mg/L AMD3100于培养箱孵育30 min后再加入100 μg/L SDF-1α,AMD3100处理组为含1 mg/L AMD3100的细胞悬液。将PANC-1细胞悬液接种于96孔板,每孔加入200 μL培养液,含1×103个细胞。贴壁生长0 h(种板8 h)、24 h、48 h和72 h后去除培养液,每孔加入100 μL含有10% MTS溶液的DMEM培养液,37 ℃、 5%CO2培养箱中继续培养3 h。以空白组调零,酶标仪检测490 nm吸光度(A)值。实验独立重复3次。
4 统计学处理
用SPSS 20.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
结 果
1 不同胰腺癌细胞株中CXCR4的mRNA表达情况
4种细胞株中均存在CXCR4 mRNA的表达,其中PANC-1细胞株中的表达水平最高,SW1990 细胞株中最低(P<0.05),见图1,因此,后续实验选择PANC-1细胞为研究对象。

Figure 1.The mRNA levels of CXCR4 in SW1990, BxPc-3, Capan-2 and PANC-1 cells were detected by RT-qPCR. Mean±SD.n=3.*P<0.05,**P<0.01vsSW1990.
图1胰腺癌细胞株SW1990、BxPc-3、Capan-2和PANC-1中CXCR4mRNA表达水平
2 激活或阻断CXCR4对PANC-1细胞株迁移和侵袭功能的影响
与对照组相比,100 μg/L SDF-1α组可显著促进PANC-1细胞迁移和侵袭(P<0.05);与SDF-1α组相比,预先用1 mg/L AMD3100处理PANC-1细胞后再加入100 μg/L SDF-1α,PANC-1细胞的迁移和侵袭能力显著降低(P<0.01),与对照组相比无明显差异,见图2、表2。
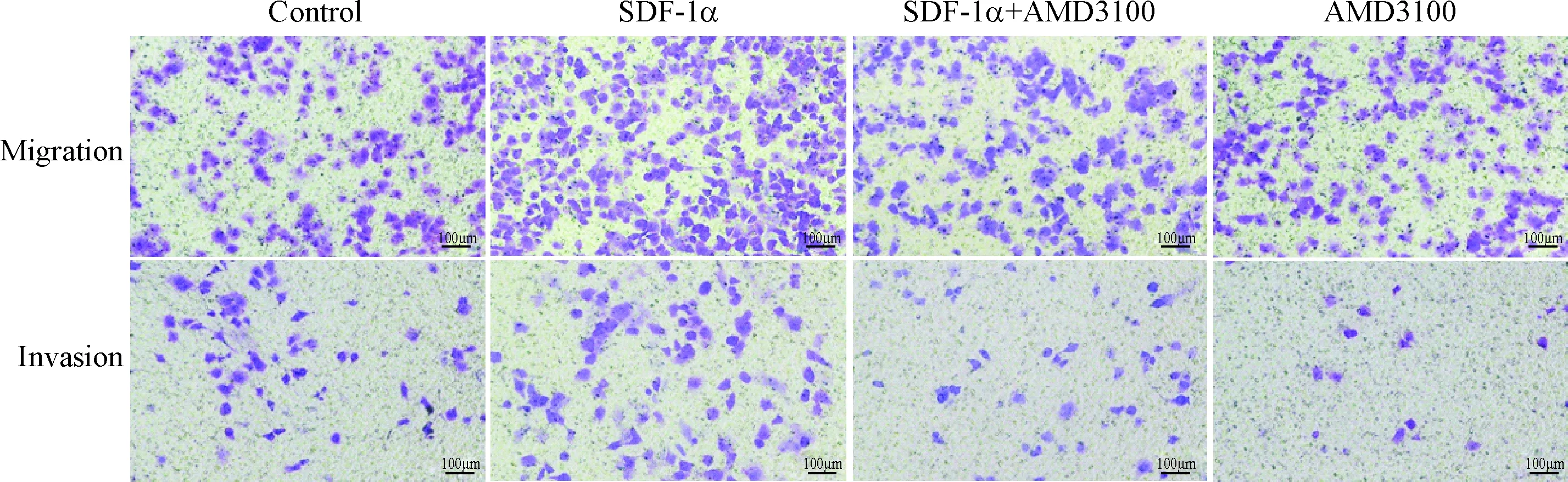
Figure 2.The migration and invasion PANC-1 cells treated with SDF-1α and AMD3100 (×100).
图2PANC-1细胞株经SDF-1α及AMD3100处理后迁移和侵袭能力的变化

表2 每视野迁移和侵袭细胞数
**P<0.01vscontrol group;##P<0.01vsSDF-1α group.
3 激活或阻断CXCR4对PANC-1细胞株活力的影响
PANC-1细胞经100 μg/L SDF-1α组处理72 h后,吸光度相比对照组增加(P<0.05),即细胞活力增强;而预先用1 mg/L AMD3100处理PANC-1细胞后再加入100 μg/L SDF-1α以及仅使用1 mg/L AMD3100处理PANC-1细胞,与对照组相比,对PANC-1细胞活力无显著影响,见图3。
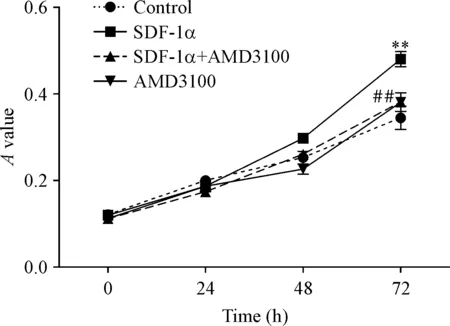
Figure 3.The MTS absorbance (A) value of PANC-1 cells. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsSDF-1α group.
图3PANC-1细胞株经SDF-1α及AMD3100处理后0h、24h、48h和72h的吸光度值
4 SDF-1α对PANC-1细胞株EMT相关标志物及EMT诱导转录因子表达的影响
PANC-1细胞株分别经100 μg/L SDF-1α处理12 h、24 h、48 h和72 h后,E-cadherin表达水平在48 h和72 h明显下降,N-cadherin、vimentin和SNAIL表达水平在12 h~48 h明显上升,而在72 h时稍升高,综合各EMT相关指标,24 h和48 h为SDF-1α最佳作用时间,见图4A。PANC-1细胞株分别经50 μg/L、100 μg/L和200 μg/L SDF-1α处理后,E-cadherin表达水平随SDF-1α浓度升高而逐渐降低,vimentin、SNAIL和TWIST表达均升高(P<0.01)。综合各EMT相关指标,SDF-1α最佳作用浓度为100 μg/L,见图4B。
5 激活或阻断CXCR4对PANC-1细胞株EMT相关标志物及EMT诱导转录因子表达的影响
PANC-1细胞株经100 μg/L SDF-1α处理48 h后,E-cadherin表达水平相比对照组下降,vimentin、SNAIL和TWIST表达水平上升;而经100 μg/L SDF-1α+1 mg/L AMD3100和1 mg/L AMD3100分别处理48 h后,E-cadherin、vimentin、SNAIL和TWIST表达水平与对照组无明显差异,见图5。
讨 论
SDF-1又名CXCL12,属于CXC趋化因子家族,在多种组织细胞中广泛表达,对各种成熟和不成熟的造血细胞有显著趋化作用[5-6]。SDF-1主要有α和β 2种亚型,SDF-1α为优势表型,由骨髓基质细胞和内皮细胞分泌,几乎存在于所有器官中,促进组织破坏[7]。CXCR4是一种高度保守的7次跨膜G蛋白偶联受体,在许多正常组织中不表达或低表达,而在多种肿瘤包括胰腺癌中高表达[8],通过与SDF-1α结合形成SDF-1/CXCR4轴,激活ERK1/2、JNK、Akt、p38 MAPK、GSK-3β等通路,参与肿瘤增殖、转移、血管生成等过程[7, 9-11]。
在本研究中,检测了4种胰腺癌细胞株中的CXCR4 mRNA表达水平,观察到低分化的胰腺癌细胞株PANC-1相比其它3种细胞株显著高表达CXCR4 mRNA,这与文献报道一致[5],即CXCR4在胰腺癌细胞中的表达水平与细胞恶性程度有关,CXCR4可能参与胰腺癌细胞的转移。应用PANC-1进行生物学功能实验,证实SDF-1α能促进高表达CXCR4的PANC-1细胞迁移和侵袭,并增强其活力。研究认为SDF-1/CXCR4轴可激活MAPK、PI3K等通路,介导肿瘤细胞增殖[12]。在本研究中,我们发现SDF-1可促进PANC-1细胞间充质标志物表达上调,而上皮标志物表达下调,并伴随EMT诱导转录因子SNAIL和TWIST的改变。EMT是细胞形态由上皮表型向间质表型的转化,在此过程中,肿瘤细胞紧密黏附蛋白如E-cadherin蛋白表达下调,N-cadherin和vimentin等蛋白表达上调,导致细胞间紧密连接及细胞极性破坏,细胞间黏附减弱,细胞由多边形变为梭形,运动性增强,迁移和侵袭能力增强。EMT调控机制复杂,涉及表观修饰及转录调节,EMT诱导转录因子如SNAIL和TWIST是其中的关键分子,SNAIL主要抑制上皮标志物的表达,而TWIST能诱导间充质标志物的表达[13-16]。因而,我们的结果提示SDF-1/CXCR4轴能通过调控SNAIL和TWIST而促进PANC-1细胞发生EMT,进而增强其迁移和侵袭能力。更为重要的是,加入AMD3100后,这种促进作用可被阻断。AMD3100是一种CXCR4的高度特异性非肽类拮抗剂,可与CXCR4结合而阻断SDF-1/CXCR4轴[17]。近年来已有针对该靶点的治疗方案在研究中,包括化疗药物联合CXCR4拮抗剂[18]、CXCR4抗体[19-20]和AMD3100纳米微粒[20]等。
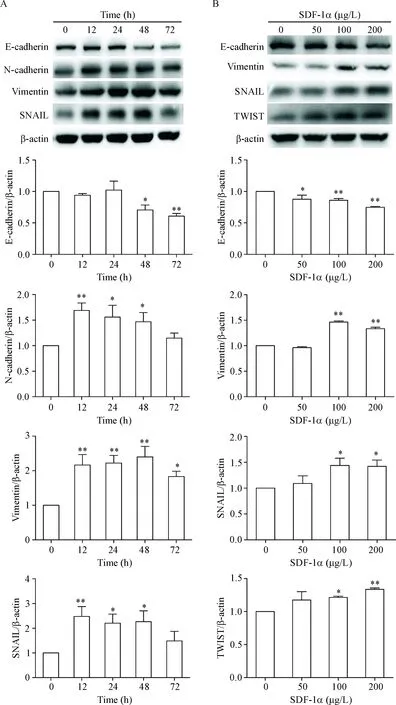
Figure 4.The expression levels of EMT-related markers and EMT-inducing transcription factors. A: PANC-1 cells were treated with 100 μg/L SDF-1α for different hours; B: PANC-1 cells were treated with different concentrations of SDF-1α for 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h or 0 μg/L.
图4PANC-1细胞株经SDF-1α处理后EMT相关标志物及EMT诱导转录因子的表达
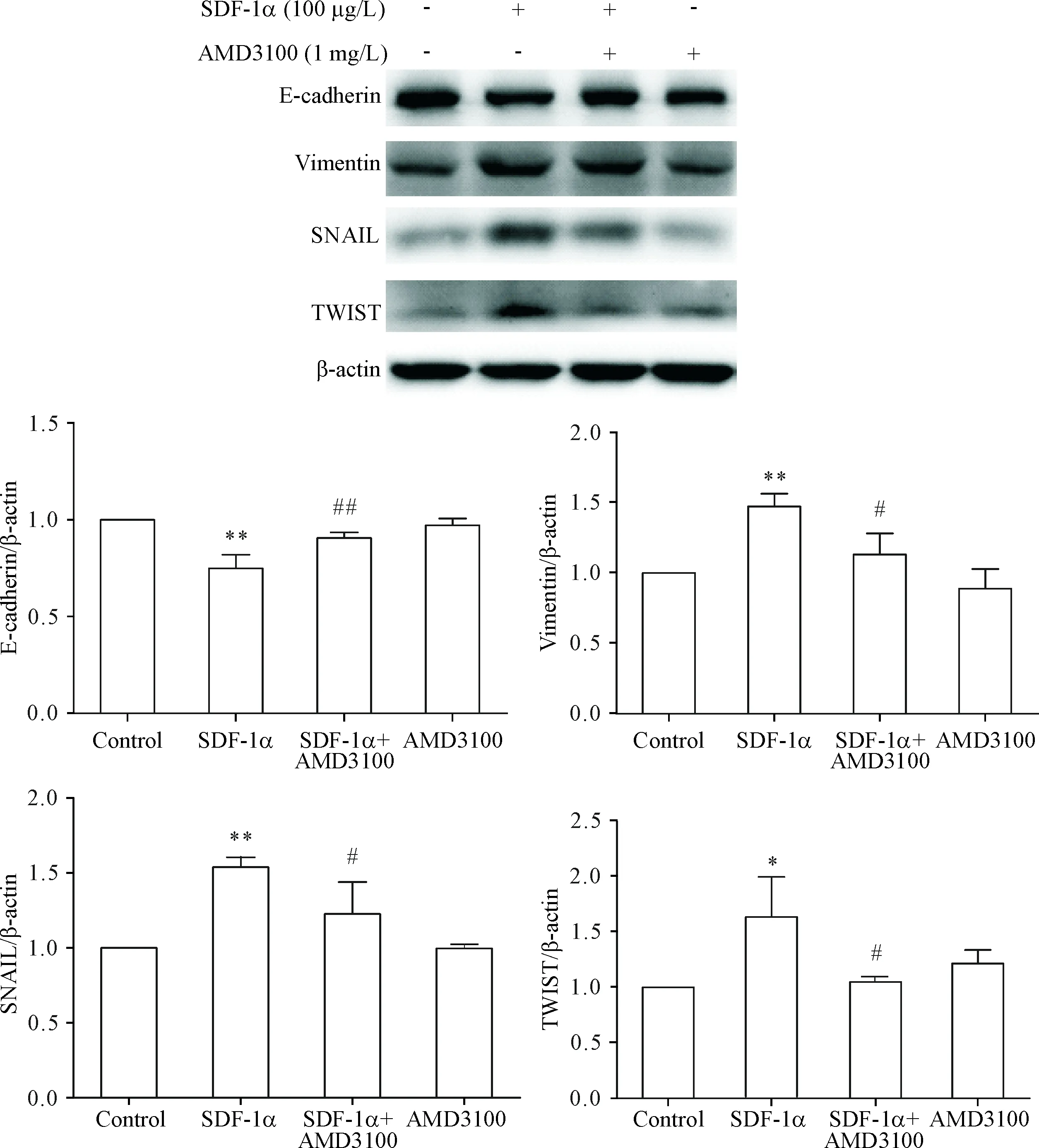
Figure 5.The expression levels of EMT-related markers and EMT-inducing transcription factors in PANC-1 cells treated with SDF-1α and AMD3100 for 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsSDF-1α group.
图5PANC-1细胞株经SDF-1α及AMD3100处理后EMT相关标志物及EMT诱导转录因子的表达
综上所述,SDF-1α/CXCR4轴在胰腺癌侵袭与转移中发挥了一定作用,有望成为胰腺癌治疗的有效靶点。
