内质网应激诱导的自噬对肝细胞凋亡的影响*
2019-02-28马子华谢汝佳
郑 璐, 韩 冰, 2, 汤 雷, 田 甜, 蔡 爽, 余 蕾, 马子华, 杨 婷, 2, 杨 勤, 2△, 谢汝佳, 2△
(贵州医科大学 1病理生理学教研室, 2贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025)
内质网作为真核细胞重要的膜性细胞器,在细胞的生理调控中扮演着十分重要的角色。许多有害因素,如营养过剩或缺乏、Ca2+平衡紊乱、氧化应激、炎症和缺氧等均可导致内质网的稳态被打破,使大量未折叠/错误折叠蛋白在内质网腔中聚集[1-2],从而导致内质网应激(endoplasmic reticulum stress,ERS)的发生。ERS时细胞为了对抗有害因素所带来的不利影响而启动未折叠蛋白反应(unfolded protein response,UPR),以此来恢复内质网的平衡[3]。此外,ERS时还可通过细胞内的蛋白质降解系统对内质网腔中的未折叠/错误折叠蛋白进行降解,从而减轻内质网的负荷,促进细胞存活。
真核生物细胞内有2种主要的蛋白质降解系统:一是泛素-蛋白酶体降解系统,二是自噬。ERS时聚集在内质网腔中的未折叠/错误折叠蛋白能够被泛素-蛋白酶体降解已早有定论。研究证实蛋白酶体是内质网相关蛋白降解(endoplasmic reticulum-associated degradation,ERAD)系统的组成部分,如果使用蛋白酶体抑制剂则会导致内质网功能损害而促进细胞凋亡的发生[4]。近年来有研究发现自噬可能也参与了对未折叠/错误折叠蛋白的降解过程[5],但自噬对ERS时细胞功能有何影响,目前尚无定论。本研究采用二硫苏糖醇(dithiothreitol,DTT)处理体外培养的人正常肝细胞LO2,建立内质网应激细胞模型,观察内质网应激下自噬的发生情况;然后采用自噬诱导剂雷帕霉素(rapamycin,RAP)预处理LO2细胞,观察其对内质网应激诱导的细胞凋亡的影响。
材 料 和 方 法
1 材料
人正常肝细胞LO2(中国科学院典型培养物保藏中心上海细胞库)。DMEM培养基和胎牛血清(Gibco);胰酶、彩虹Marker、BCA蛋白定量试剂盒、二硫苏糖醇和电镜固定液(北京索莱宝科技有限公司);细胞裂解液、蛋白酶抑制剂和Annexin V-FITC/PI细胞凋亡检测试剂盒(江苏凯基生物技术有限公司);逆转录试剂盒(Thermo K1622);兔抗β-actin抗体、兔抗自噬相关基因12(autophagy-related gene 12,Atg12)、兔抗Atg5、兔抗微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、兔抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、兔抗蛋白激酶R样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)、兔抗活化转录因子4(activating transcription factor 4,ATF4)和兔抗C/EBP同源蛋白(C/EBP homologous protein,CHOP)抗体(Abcam);雷帕霉素(LC)。
2 方法
2.1细胞培养 LO2细胞培养于含10%胎牛血清、1%青链霉素的DMEM培养基中,在37 ℃、5% CO2的培养箱中培养,2~3 d换1次液,细胞密度85%时以1∶2传代备用。
2.2多功能实时无标记细胞分析仪(real-time cellular analysis,RTCA)检测不同浓度DTT对LO2细胞增殖的影响 RTCA DP系统通过 E-plate 底部的电极检测贴壁细胞的电阻抗,可反映细胞的数量、活力、形态以及贴壁情况,以细胞指数(cell index,CI)作为检测指标。取对数期生长的细胞,使用含EDTA的胰酶消化后制成细胞悬液进行细胞计数,每孔以7×103个细胞接种于E-plate,待细胞贴壁后分别加入终浓度为0 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、4.0 mmol/L和6.0 mmol/L的DTT处理细胞,每个浓度设置3个复孔。连续动态监测96 h,观察不同浓度DTT对LO2细胞增殖的影响,每10 min记录1次。采用RTCA软件分析获取CI值并选出后续实验中的最佳药物浓度。
2.3内质网应激细胞模型的建立 根据RTCA实验结果,给予终浓度为2.0 mmol/L的DTT诱导LO2细胞发生内质网应激,DTT处理时间分别为0 h、6 h、12 h和24 h。收集的细胞样本用于real-time PCR、Western blot及流式细胞术检测。
2.4Real-time PCR法检测GRP78、PERK、ATF4、CHOP、Atg12、Atg5和LC3的 mRNA表达水平 将各组细胞用PBS洗2次,加入1.0 mL TRIzol裂解液在冰上裂解10 min,收集细胞裂解液提取总RNA。采用核酸蛋白仪检测RNA浓度,并根据A260/A280的比值确定所提RNA的纯度,所有样本的A260/A280比值均在1.8~2.0的范围内,符合实验要求。按照Thermo K1622逆转录试剂盒说明书配制逆转录反应体系:5× reaction buffer 4 μL,dNTP Mix 2 μL,Oligo dT 1 μL,RNase inhibitor 1 μL,transcriptase 1 μL,RNA样品为含1 μg RNA的体积,RNase-free H2O为11 μL减去RNA样品的体积。反应条件为25 ℃ 10 min、48 ℃ 60 min、95 ℃ 5 min。逆转录合成的cDNA保存于4 ℃短期内使用。按照说明书配置实时荧光定量PCR反应体系:2×SYBR Green PCR Master Mix 12.5 μL,上、下游引物各1 μL、cDNA 模板2 μL,RNase-free H2O 8.5 μL,总体积25 μL。反应条件为:预变性95 ℃ 30 s; 95 ℃ 5 s、60 ℃ 30 s,共40个循环。mRNA的相对表达量以2-ΔΔCt表示。所用引物序列见表1。

表1 Real-time PCR引物序列
2.5Western blot法检测GRP78、PERK、p-PERK、ATF4、CHOP、Atg12、Atg5和LC3蛋白水平的变化 收集各组细胞,分别加入300 μL细胞裂解液,在冰上裂解10 min。收集细胞悬液,12 000 r/min、4 ℃离心30 min,取上清,用BCA蛋白定量试剂盒进行蛋白定量。以40 μg总蛋白上样,行SDS-PAGE,电泳结束后转移蛋白至PVDF膜,用含5%脱脂奶粉的TBST封闭90 min。将兔抗GRP78、PERK、p-PERK、ATF4、CHOP以及Atg12、Atg5和LC3用抗体稀释液按相应比例稀释后与PVDF膜在4 ℃摇床孵育过夜;次日用TBST洗膜后加入Ⅱ抗(1∶4 000)室温孵育90 min,TBST洗膜3次,ECL发光成像,以β-actin为内参照。用Image Lab图像分析软件对每个条带灰度值进行半定量分析。
2.6透射电镜检测自噬的发生情况 使用含EDTA的胰酶消化细胞,1 000 r/min离心5 min,将上清小心弃掉,加入电镜固定液固定细胞,将固定好的细胞经逐级乙醇脱水后,用70%乙醇醋酸双氧铀块染色,包埋、切片后用透射电子显微镜进行观察。
2.7流式细胞术检测细胞凋亡 将细胞随机分为正常对照(control)组、DTT组(给予终浓度为2.0 mmol/L的DTT处理细胞24 h)和雷帕霉素预处理+DTT组(400 nmol/L的雷帕霉素预处理细胞1 h后,再给予终浓度为2.0 mmol/L的DTT处理24 h)。使用不含EDTA的胰酶消化各组细胞,用PBS洗涤细胞2次,2 000 r/min离心5 min。取5×105细胞,加入500 μL的Binding Buffer悬浮细胞,每组细胞中加入5 μL Annexin V-FITC混匀后,再加入5 μL PI混匀,室温避光反应15 min后用流式细胞仪进行检测。
3 统计学处理
采用SPSS 17.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法,多重比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 RTCA动态监测不同浓度的DTT对LO2细胞增殖的影响
与0 mmol/L DTT组比较,0.5 mmol/L和1.0 mmol/L DTT对细胞增殖没有明显的抑制作用,2.0 mmol/L DTT对细胞增殖抑制作用明显(P<0.05),并且随着浓度的增加,对细胞增殖的抑制作用越明显,见图1。
2 Real-time PCR检测GRP78、PERK、ATF4、CHOP、Atg12、Atg5和LC3的mRNA表达情况
Real-time PCR结果显示,与0 h组比较,DTT处理LO2细胞6 h后,内质网应激信号通路相关因子GRP78、PERK和ATF4的mRNA表达明显增加(P<0.05),而CHOP的mRNA表达无显著变化;随着DTT作用时间延长,DTT处理LO2细胞12 h后,GRP78、PERK和ATF4的mRNA表达较6 h组进一步增高,而CHOP的mRNA水平也较DTT 0 h及6 h组明显增加(P<0.05);DTT处理细胞24 h后GRP78、PERK和ATF4的mRNA表达有所下降,但仍显著高于DTT 0 h组,而CHOP mRNA的表达仍保持在较高水平(P<0.05)。另外,还观察到DTT处理LO2细胞6 h、12 h和24 h后,自噬相关因子Atg12、Atg5及LC3的表达均较DTT 0 h组显著增加(P<0.05),并且随着DTT作用时间的延长,Atg12、Atg5及LC3的mRNA表达逐渐增加,见图2。
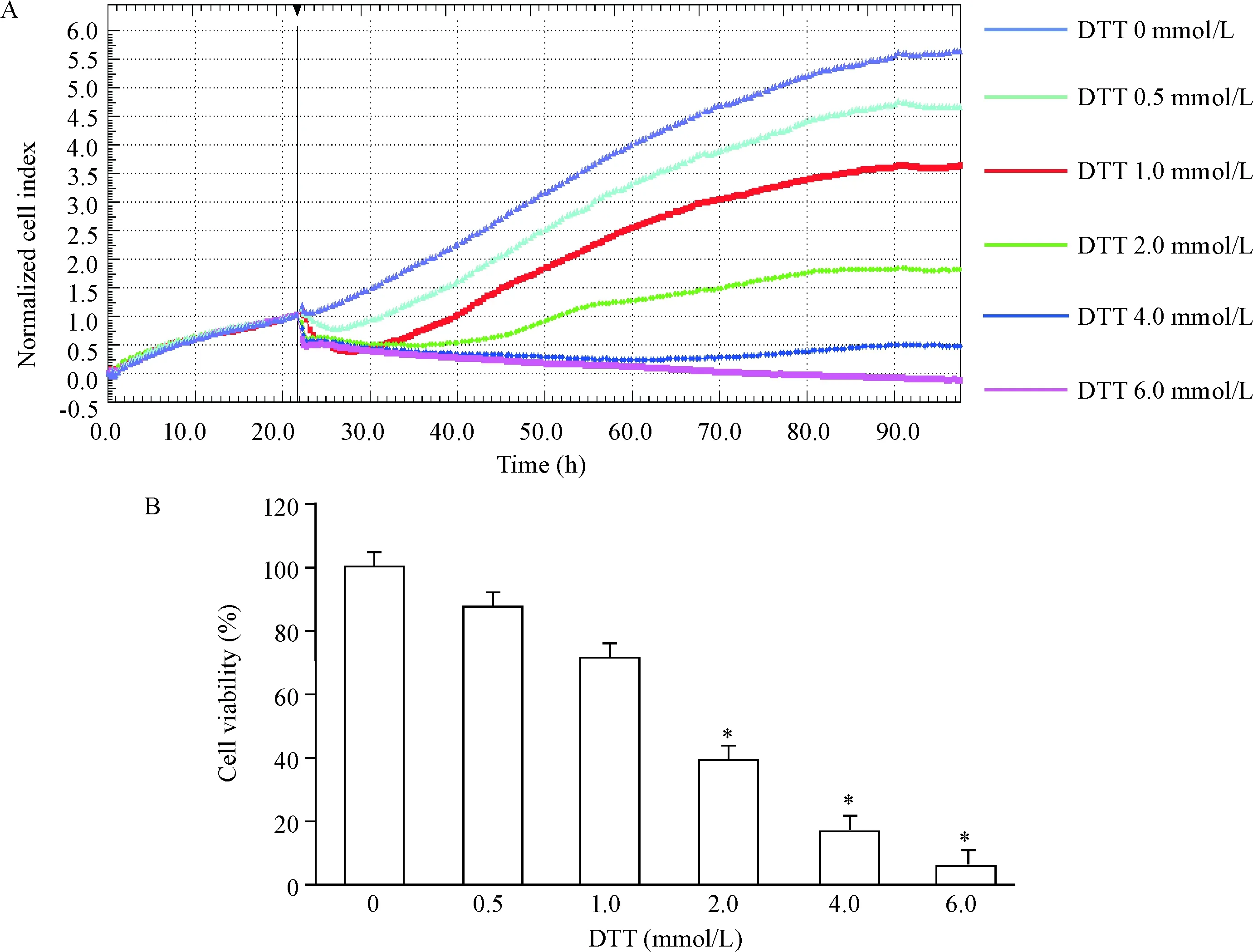
Figure 1.Dynamic monitoring of the normalized cell index of LO2 cells treated with different concentrations of DTT by RTCA xCELLigence system (A), and the viability of LO2 cells exposed to DTT at different concentrations for 24 h (B). Mean±SD.n=6.*P<0.05vs0 mmol/L DTT group.
图1RTCAxCELLigence系统动态监测不同浓度DTT处理的LO2细胞的标准化细胞指数
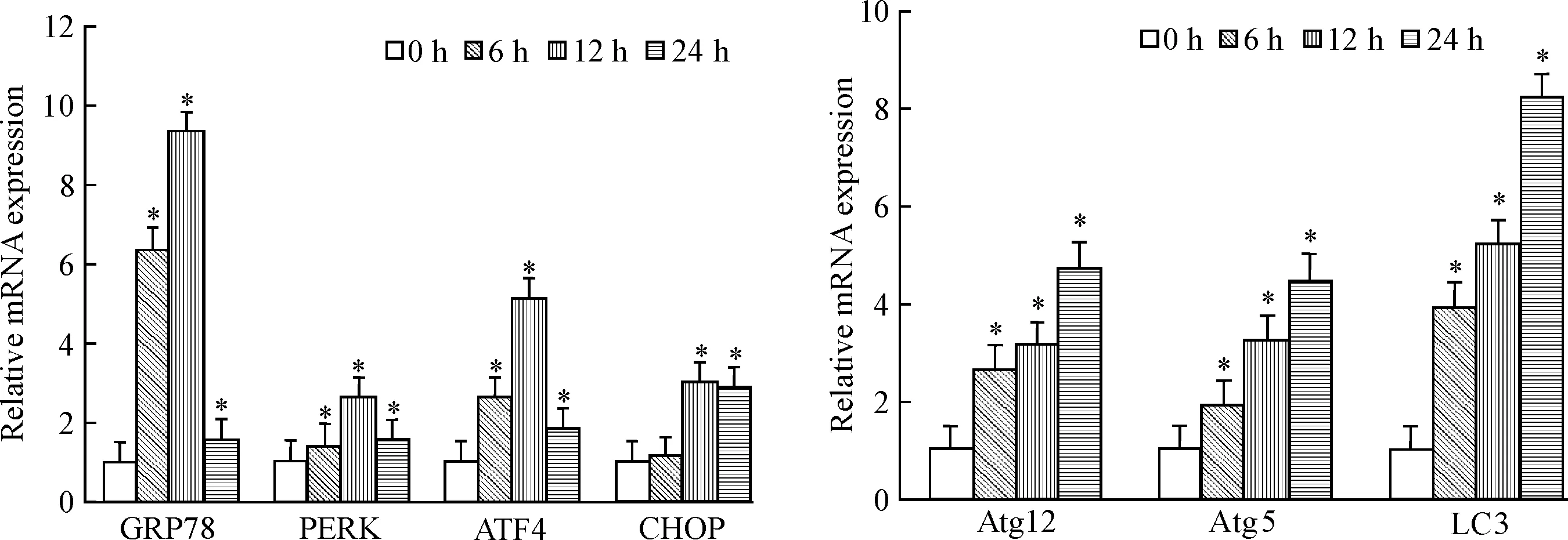
Figure 2.The mRNA expression of GRP78, PERK, ATF4, CHOP, Atg12, Atg5 and LC3 after DTT stimulation. Mean±SD.n=5.*P<0.05vs0 h group.
图2Real-timePCR检测DTT处理细胞后GRP78、PERK、ATF4、CHOP、Atg12、Atg5和LC3的mRNA表达
3 DTT处理LO2细胞后GRP78、PERK、p-PERK、ATF4、CHOP、Atg12、Atg5和LC3蛋白水平的变化
Western blot检测结果显示,与0 h组比较,DTT处理LO2细胞6 h后内质网应激相关蛋白GRP78和p-PERK蛋白水平无明显变化,而PERK、ATF4和CHOP的表达显著增高(P<0.05);DTT作用12 h和24 h后,GRP78和p-PERK的蛋白水平较DTT 0 h及6 h组显著上调(P<0.05);PERK、ATF4和CHOP的表达仍保持在高水平。此外,还观察到DTT作用6 h、12 h和24 h后,细胞中自噬相关蛋白Atg5、Atg12和LC3的表达均较DTT 0 h组显著增加,且LC3Ⅱ/LC3Ⅰ的比值也较DTT 0 h组显著增高(P<0.05),见图3。
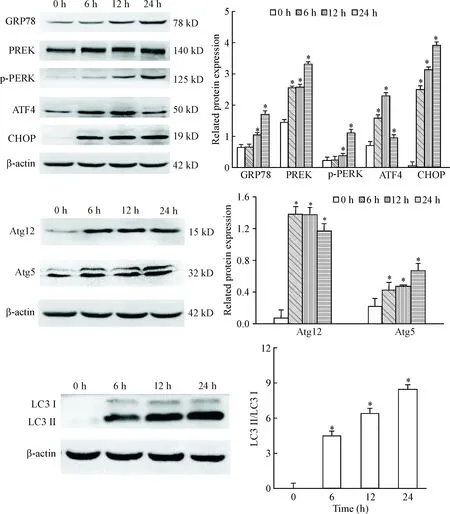
Figure 3.The protein levels of GRP78, PERK, p-PERK, ATF4,CHOP, Atg12, Atg5 and LC3 in the LO2 cells exposed to 2.0 mmol/L DTT at different time points. Mean±SD.n=3.*P<0.05vs0 h group.
图32.0mmol/LDTT处理LO2细胞不同时间对GRP78、PERK、p-PERK、ATF4、CHOP、Atg12、Atg5和LC3蛋白水平的影响
4 透射电子显微镜检测自噬发生情况
透射电子显微镜观察结果发现,DTT处理LO2细胞6 h、12 h和24 h组细胞质内均可见自噬小体(箭头所示),并且随着DTT处理LO2时间的延长,自噬小体数量逐渐增加,而0 h组无此现象;经雷帕霉素预处理后,细胞质内自噬小体进一步增多,见图4。
5 流式细胞术检测LO2细胞凋亡
流式细胞术检测发现,2.0 mmol/L DTT处理LO2细胞0 h、6 h、12 h和24 h后,DTT 0 h组细胞凋亡率为(4.40±0.53)%,DTT 6 h组的凋亡率为(9.70±1.42)%;随着DTT处理时间的延长,DTT 12 h组及24 h组的细胞凋亡率进一步增加(P<0.01),见图5。另外,雷帕霉素预处理+ DTT 24 h组的细胞凋亡率较单独的DTT处理细胞24 h组显著下降(P<0.05),见图6。
讨 论
内质网作为真核细胞重要的膜性细胞器,是细胞内脂质代谢及蛋白质合成后折叠与聚集的场所,在细胞的生理调控中扮演着十分重要的角色,因此,内质网功能正常是细胞存活以及维持机体正常生理功能的关键[1-3]。肝细胞拥有数量丰富的内质网,不论是蛋白质的合成与分泌、胆固醇的生物合成还是外源性化学物质的代谢均与内质网的功能密切相关,因此,内质网功能的紊乱势必会对肝细胞功能造成影响进而导致疾病的发生。研究证实许多肝脏疾病(例如病毒性肝炎、非酒精性脂肪性肝病和肝纤维化等)的发生均与内质网应激及其介导的细胞凋亡有关[4-6]。本研究采用内质网应激诱导剂DTT处理体外培养的LO2细胞,经real-time PCR及Western blot检测发现,随着DTT作用时间的延长,内质网应激标志蛋白GRP78的mRNA及蛋白表达水平显著增加。GRP78是广泛分布于内质网中的一种分子伴侣,其主要作用是协助蛋白质的折叠、装配和运输[7]。研究证实内质网应激时表达增加的GRP78可促进内质网腔中未折叠/错误折叠的蛋白质进行正确折叠,从而恢复内质网的功能并促进细胞存活,故GRP78表达上调也被视为内质网应激发生的标志[8-9]。近年来有研究发现,ERS时细胞除通过上调GRP78等分子伴侣的表达来促进未折叠/错误折叠蛋白进行正确折叠外,还可通过细胞内的蛋白质降解系统对未折叠/错误折叠蛋白进行降解,从而减轻内质网负荷。

Figure 4.Transmission electron microscopy was used to observe the occurrence of autophagy in the LO2 cells treated with 2.0 mmol/L DTT at different time points (A) and after pretreatment with RAP (B).
图4透射电子显微镜观察2.0mmol/LDTT处理LO2细胞不同时间后自噬发生情况及RAP预处理后自噬的发生情况
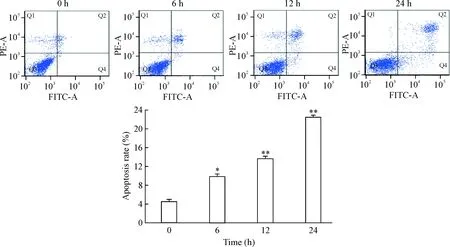
Figure 5.The effect of DTT at 2.0 mmol/L on the apoptosis of the LO2 cells at different time points. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h group.
图52.0mmol/LDTT处理LO2细胞不同时间后对细胞凋亡的影响
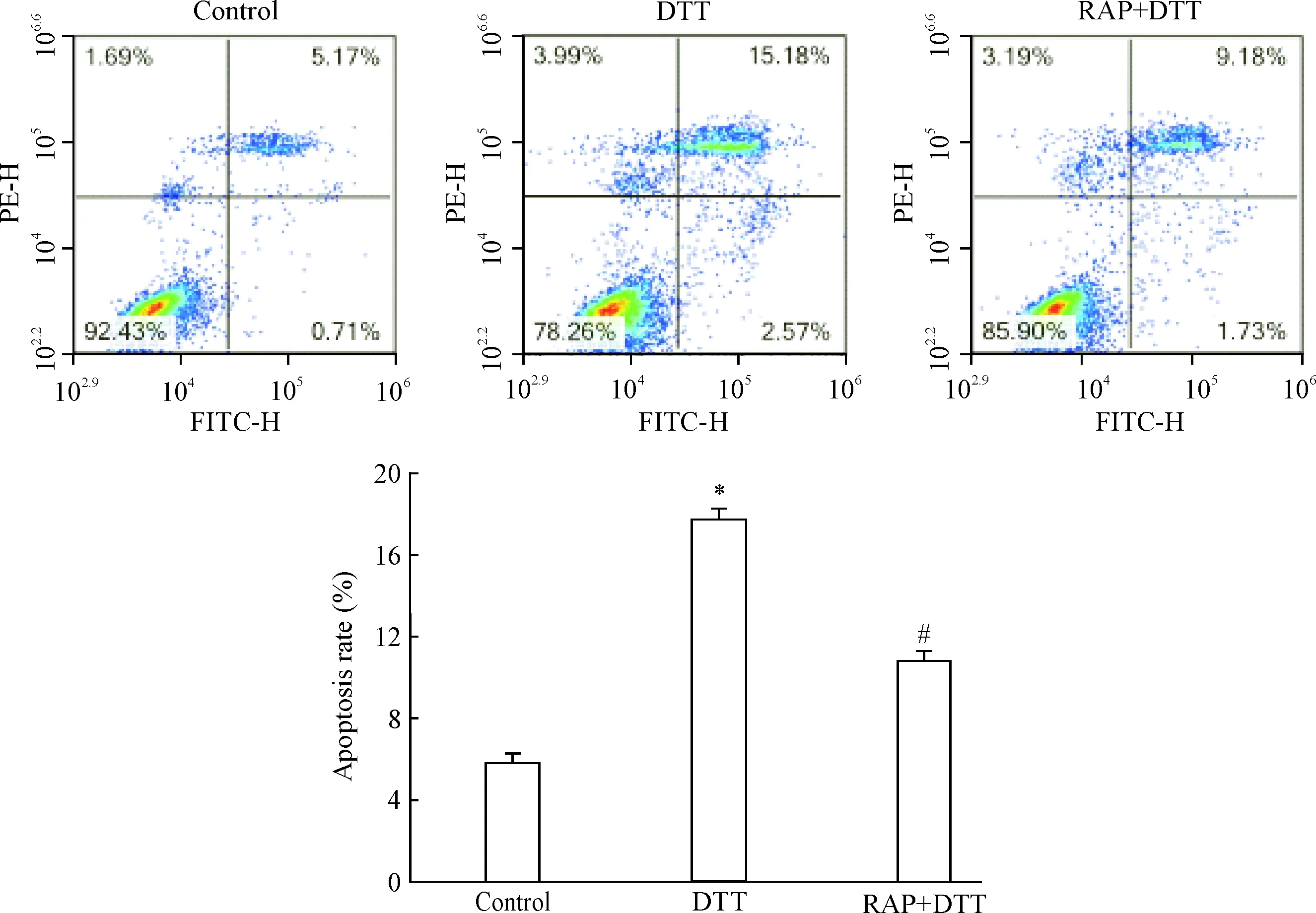
Figure 6.The effect of RAP pretreatment on the apoptosis of LO2 cells induced by DTT. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsDTT group.
图6RAP预处理后对DTT诱导的LO2细胞凋亡的影响
真核生物细胞内有2种主要的蛋白质降解系统,一是泛素-蛋白酶体降解系统,二是自噬[10]。已有研究证明ERS可诱导自噬的发生[11-12]。在本次研究中发现,内质网应激诱导剂DTT处理LO2细胞6、12和24 h后,细胞中自噬小体显著增多,其中以12及24 h组更为明显;此外还观察到DTT处理LO2细胞后能显著上调细胞中自噬相关因子Atg12、Atg5及LC3的mRNA 及蛋白表达水平,同时Western blot 检测发现LC3 II/LC3 I的比值也较0 h组显著增高。由于LC3有LC3 I和LC3 II 2种形式,且随着自噬的发生,LC3 I将与自噬泡膜表面的磷脂酰乙醇胺(phosphatidylethanolamine,PA)结合转变成LC3 II;当自噬泡膜闭合时,只有LC3 II定位于自噬泡膜上,因此LC3 I向LC3 II的转化可作为自噬发生的标志[13],上述结果证实肝细胞LO2发生ERS时的确可以诱导自噬的发生,而自噬水平增高对ERS状态下细胞的命运有何影响,目前尚存在争议。
在本次研究中发现,DTT处理LO2细胞后,细胞中PERK、ATF4及CHOP 的mRNA水平明显增高,同时PERK、p-PERK、ATF4及CHOP 的蛋白表达水平也显著上调,上述结果提示DTT处理细胞后ERS介导的凋亡信号通路发生了活化,这是因为ERS时由于内质网功能障碍导致大量未折叠/错误折叠蛋白在内质网腔中聚集,作为分子伴侣的GRP78去结合和处理未折叠/错误折叠蛋白,因此与内质网应激感受蛋白PERK解离。解离后的PERK通过自身磷酸化被激活,而p-PERK可进一步激活其下游的真核翻译起始因子2α(eukaryotic translation initiation factor 2α, eIF2α),并促进下游促凋亡蛋白ATF4及CHOP的表达从而诱导细胞凋亡[2, 14]。流式细胞术结果也显示随着DTT处理LO2细胞时间的延长,LO2细胞凋亡率也显著增加。从表面上看,细胞自噬水平增高的同时细胞凋亡也显著增加了,因此很容易得出自噬水平增加可促进细胞凋亡的结论。但也有学者对这一结论提出了质疑,认为自噬是细胞对抗损伤因素的一种重要的代偿保护机制,而细胞凋亡增加有可能是细胞自身代偿不足所造成的[15]。为进一步研究自噬水平增高究竟对细胞发挥保护作用还是损伤作用,本实验采用自噬诱导剂雷帕霉素预处理LO2细胞,观察外源性上调细胞自噬水平后对ERS状态下细胞凋亡的影响,结果发现,雷帕霉素预处理LO2细胞后,能在一定程度上减轻内质网应激诱导的细胞凋亡,这与Tang等[16]的研究结果一致。
综上所述,肝细胞发生内质网应激时可诱导自噬的发生,而自噬水平增高可能是细胞的一种重要的代偿保护机制,但如果损伤因素过重或持续时间过久,细胞自身的代偿机制不足于对抗损伤因素时,可导致细胞走向凋亡。雷帕霉素预处理可在一定程度上减轻内质网应激诱导的细胞凋亡,从而发挥保护肝细胞的作用。
