羊种布鲁菌16M LPS单克隆抗体制备与鉴定
2019-02-28周曼莉周学章周玉成张海威乔连江杨艳玲
周曼莉,周学章,周玉成,张海威,乔连江,杨艳玲
布鲁菌病(Brucellosis)是一种由布鲁菌(Brucella)引起的人兽共患传染病,简称布病。根据致病性和宿主特异性,将布鲁菌分为6个种 20个生物型[1]。近年来,随着我国畜牧业的快速发展,布鲁菌病疫情呈逐年上升趋势,对养殖业和人类健康造成严重威胁。流行病学调查显示,羊种布鲁菌的侵袭力和致病力最强,最易引起人类布鲁菌病的暴发和流行[2],并且90%以上的致病菌均为羊种布鲁菌[3-5]。布鲁菌感染后引起宿主产生明显的体液免疫反应,主要是针对布鲁菌表面的LPS产生抗体,这也是血清学检测的依据。同时,LPS是布病重要的诊断抗原,也是布鲁菌重要的毒力因子[6]。由此可见,LPS的深入研究对寻找有效的疫苗靶标、设计构建减毒活菌苗[7],以及开发有效的诊断试剂,建立新型快速诊断方法具有重大意义。在目前的研究中,人们多使用牛种布鲁菌或者是疫苗株来提取布鲁菌LPS[8-11],但这些LPS对检测羊种布鲁菌还存在局限性。目前,猪种布鲁菌、牛种布鲁菌以及羊种布鲁菌是对畜牧业发展造成严重危害的主要布鲁菌种。因此,筛选有效的布鲁菌单克隆抗体为实现我国家畜布病彻底净化提供必要的技术保障。
本试验旨在通过提取羊种布鲁菌16M LPS,制备效价高、反应原性强、敏感性高、应用范围广的单克隆抗体,拟为后续研究单克隆抗体的特性及建立布鲁菌快速病原及抗体诊断方法奠定实验基础,同时为研制布病临床快速检测产品提供技术保障。
1 材料与方法
1.1 试验动物及菌种
1.1.1选取8只20 g左右,6~8周龄SPF级雌性Balb/c小鼠,购自辽宁长生生物技术有限公司,饲养于中国农业科学院特产研究所实验动物房,免疫小鼠及阴性对照小鼠于相同条件饲养,饲养环境良好,饲养过程中Balb/c小鼠精神状态良好。
1.1.2羊种布鲁菌16M为军事兽医研究所保藏馈赠,SP2/0细胞、小鼠来源的巨噬细胞系RAW264.7为本实验室保存;大肠杆菌O157裂解抗原、鸡沙门氏菌裂解抗原、福氏志贺菌全菌、鸭源鸡杆菌1-S脂多糖由吉林检验检疫局技术中心微生物实验室提供。
1.2主要试剂 阳性血清(抗羊种布鲁菌16M小鼠血清)来自长春军事兽医研究所;阴性血清(正常小鼠血清)为实验室自制;布鲁氏菌A、M单因子血清 (针对于羊布鲁氏菌O链M抗原和牛布鲁氏菌O链A抗原的血清抗体)购自广州宜康生物科技有限公司;布鲁菌试管凝集抗原购自北京中海生物公司;HAT、HT、山羊抗鼠IgG/HRP均为SIGMA公司产品;PEG1500为Roche公司产品;新生牛血清由GIBCO公司生产;包被抗体、各型亚类二抗均为Southern Biotech公司产品;TMB、SDS-PAGE凝胶快速配制试剂盒为碧云天公司产品;银染试剂盒为索莱宝公司产品;LPS定量检测试剂盒为上海润裕生物有限公司产品;石蜡油为西格玛奥德里奇(上海贸易有限公司)产品;
1.3免疫原制备 参考文献[12],采用酚水法提取羊种布鲁菌16M的LPS。取菌液离心,收沉淀。将蒸馏水,水饱和酚加入沉淀中,水浴,4 ℃冷却并离心8 h。收酚层和水层,透析至无酚味后,冻干。用水溶解,将含1%饱和醋酸钠的冷甲醇加入粗提取的LPS中,至加入LPS体积的3倍, 4 ℃于冰箱摇转2 h。收沉淀,重复1次上述离心操作后,加灭菌纯水溶解沉淀。使用脂多糖定量检测试剂盒检测LPS浓度,按照文献[13]介绍的方法配制8%的SDS-PAGE凝胶进行电泳,并根据银染试剂盒说明书进行银染显色鉴定LPS纯度。
1.4Balb/c小鼠的免疫 参照文献[14]免疫小鼠。取LPS 60 μg与等量的弗氏完全佐剂混合,对4只编号为1、2、3、4的雌性Balb/c小鼠皮下多点注射进行初次免疫,两周后取LPS 30 μg与等量的弗氏不完全佐剂混合进行加强免疫。对免疫好的Balb/c小鼠进行尾静脉采血,于37 ℃放置1 h后4 ℃过夜,收集血清。参考文献[15]进行间接ELISA方法检测免疫血清效价,并设空白对照和阴性对照。最终确定可以与SP2/0细胞进行融合的Balb/c小鼠,取LPS 50 μg进行腹腔注射免疫。
1.5细胞融合 根据文献[16]的方法,进行细胞融合。取正常小鼠的腹腔巨噬细胞作为饲养层细胞,取免疫小鼠的脾细胞与SP2/0细胞,加入预温的选择培养基HAT。37 ℃条件下,在PEG1 500的作用下进行细胞融合。加入无血清的IMDM终止融合,离心,加入新生牛血清及准备好的胸腺细胞,加入半固体培养基中,混匀,倒入培养皿中,放入孵箱培养。
1.6杂交瘤细胞筛选 将融合后的细胞培养于96孔板中,用2 μg/mL 的“LPS”包板,吸取有杂交瘤细胞生长的细胞孔的培养上清,采用上述间接ELISA方法进行筛选。阴性对照为SP2/0细胞培养上清、空白对照为PBS、阳性对照为阳性血清用PBS稀释100倍。筛选共进行两次。加入终止液,将96孔板于双波长(450 nm,630 nm)处测定吸光值。
1.7腹水制备及纯化 取石蜡油500 μL腹腔注射10周龄Balb/c小鼠。给Balb/c小鼠注射阳性杂交瘤细胞5×105~9×105个。待Balb/c小鼠腹腔明显膨大后,将采集的腹水于5 000 r/min离心10 min,取上清。根据文献[17]的方法,将上清使用ProteinA柱进行纯化。将上清稀释并离心,使用0.22 μm滤膜过滤。用10倍柱体积的偶联缓冲液平衡柱子,保持流速为1 mL/min。上样,保持相同流速,收集液体。再使用5倍柱体积偶联缓冲液过柱,等量洗脱液洗脱抗体。调整pH,使用PBS过夜透析抗体。将抗体分装冻存。
1.8 单克隆抗体的鉴定
1.8.1免疫效价检测 对4只免疫好的Balb/c小鼠进行尾静脉采血,采用上述间接ELISA法检测其免疫血清。将收集的已免疫的Balb/c小鼠血清用样品稀释液从200倍开始2倍梯度稀释,空白对照为PBS,阴性对照为阴性血清200倍稀释。选择免疫效价高,精神状态好的Balb/c小鼠做后续细胞融合实验。
1.8.2单克隆抗体亲和常数及效价检测 采用上述间接ELISA方法,将两株单克隆抗体用样品稀释液从200倍开始进行2倍梯度稀释,检测其亲和常数及效价。
1.8.3单克隆抗体亚类鉴定 用PBS将抗体稀释至0.5 μg/mL,4 ℃过夜。加入封闭液,37 ℃孵育2 h。加入杂交瘤细胞上清,37 ℃孵育1 h。加入用封闭液1∶1 000稀释的HRP标记的山羊抗鼠IgG,37 ℃孵育1 h。加入底物,于双波长(450 nm,630 nm)测定吸光值。
1.8.4单克隆抗体纯度检测 按照上述方法,对获得的两株单克隆抗体进行SDS-PAGE凝胶电泳(12%分离胶),检测抗体纯度。
1.8.5 特异性检测
1.8.5.1交叉反应性试验 参照上述方法,采用间接ELISA方法检测单克隆抗体与部分细菌的交叉反应以评价单克隆抗体的特异性。将羊种布鲁菌16M标准株与大肠杆菌O157裂解抗原、鸡沙门氏菌裂解抗原、福氏志贺菌全菌、鸭源鸡杆菌1-S脂多糖作为抗原包被酶标板,检测筛选的杂交瘤细胞的培养上清。反应后测定每孔的OD450值,观察这2株杂交瘤细胞上清是否与其他菌株反应。
1.8.5.2间接免疫荧光试验 参照文献[18]的实验方法,采用间接免疫荧光的实验方法,将小鼠巨噬细胞RAW264.7铺板培养过夜。给实验孔每孔加入细胞数量100倍的羊种布鲁菌16M、猪种布鲁菌S2、牛种布鲁菌2308感染细胞5 h。加入含100 μg/mL的庆大霉素培养基作用2 h,于37 ℃培养。加入80%预冷丙酮固定细胞。加入Triton X-100室温摇床。加入一抗(阳性杂交瘤细胞上清,1∶4稀释),孵育1 h。加入FITC标记的山羊抗鼠IgG(1∶50稀释),避光孵育1 h。用荧光显微镜观察。
1.8.5.3布鲁菌A、M因子血清凝集试验 取两种单抗各30 μL,加入等量的LPS进行玻片凝集试验。再取经灭菌纯水溶解的布鲁菌A、M因子血清30 μL,加入等量的LPS进行玻片凝集试验。以5 min内出现凝集判为阳性。以此来判断制备的单抗可以识别的抗原位点。
1.8.5.4试管凝集试验 按照1∶12.5,1∶25,1∶50,1∶100,1∶200,1∶400,1∶800的比例稀释制备的LPS单克隆抗体Anti-A-LPS:5和Anti-A-LPS:10。在每管中加入1∶20稀释的布鲁菌试管凝集抗原500 μL,于37 ℃培养箱孵育24 h后观察结果。设置PBS为空白对照。
2 结 果
2.1免疫原制备 将提取的羊种布鲁菌16M的LPS进行SDS-PAGE凝胶电泳,并银染显色,使用脂多糖定量检测试剂盒检测LPS的浓度。结果显示,用酚水法提取得到的LPS条带清晰明显,无其他杂带,其浓度为1 mg/mL。表明其纯度较高,浓度可以达到继续后续实验的要求。

1:蛋白Marker; 2:羊种布鲁菌16M LPS图1 布鲁菌16M的LPS电泳银染结果Fig.1 Silver-stined SDS-polyacrylamide gels B. melitensis 16M LPS
2.2免疫Balb/c小鼠效价检测 采用间接ELISA方法对免疫的Balb/c小鼠抗体效价进行检测。结果显示:1号Balb/c小鼠的免疫血清效价为1∶3 200;2号Balb/c小鼠的免疫血清效价为1∶1 600;3号Balb/c小鼠的免疫血清效价为1∶1 600;4号Balb/c小鼠的免疫血清效价为1∶6 400;因此,取50 μg纯化好的LPS对4号Balb/c小鼠进行腹腔注射免疫,选取免疫好的4号Balb/c小鼠的脾细胞与SP2/0 细胞进行融合。检测结果如表1及图2所示。
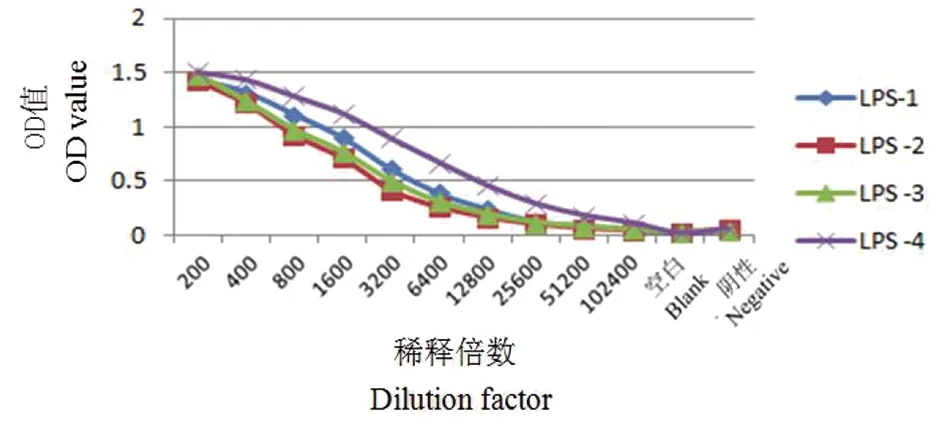
图2 免疫Balb/c小鼠抗体效价ELISA检测结果Fig.2 Antibody titers in immunized mice by ELISA
2.3杂交瘤细胞筛选 用纯化的LPS包板,采用间接ELISA方法筛选阳性杂交瘤细胞,最终得到2株能稳定分泌抗布鲁菌16M LPS的阳性杂交瘤细胞株,命名为Anti-A-LPS:5和Anti-A-LPS:10。检测结果见表2。
表1 免疫Balb/c小鼠抗体效价ELISA检测结果
Tab.1 ELISA test results of antibody titer of immunized Balb/c mice
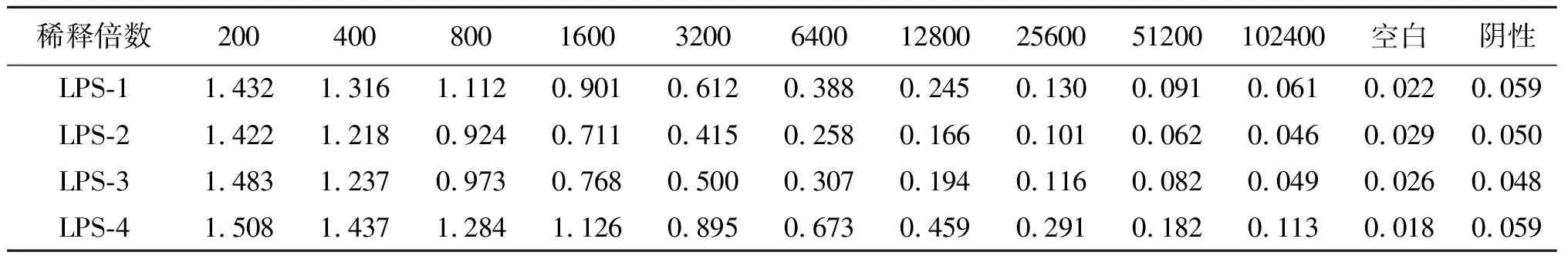
稀释倍数200400800160032006400128002560051200102400空白阴性LPS-11.4321.3161.1120.9010.6120.3880.2450.1300.0910.0610.0220.059LPS-21.4221.2180.9240.7110.4150.2580.1660.1010.0620.0460.0290.050LPS-31.4831.2370.9730.7680.5000.3070.1940.1160.0820.0490.0260.048LPS-41.5081.4371.2841.1260.8950.6730.4590.2910.1820.1130.0180.059
注:数据为ELISA OD(450 nm,630 nm)值
表2 杂交瘤细胞培养上清检测结果
Tab.2 Hybridoma cell culture supernatant test results
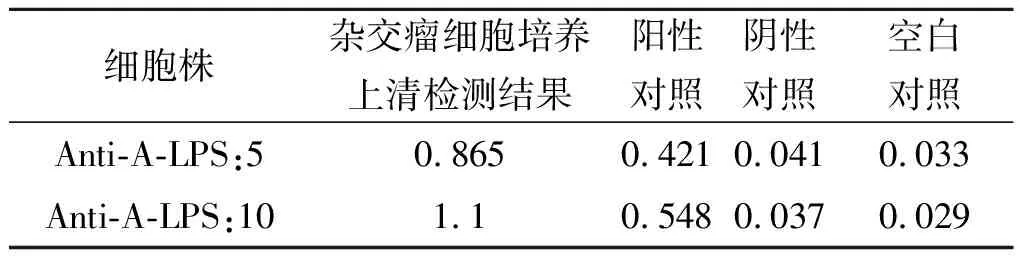
细胞株杂交瘤细胞培养上清检测结果阳性对照阴性对照空白对照Anti-A-LPS:50.8650.4210.0410.033Anti-A-LPS:101.10.5480.0370.029
注:数据为ELISA OD(450 nm,630 nm)值
2.4单克隆抗体亲和常数及效价检测 将制备出的两株单克隆抗体从200倍开始进行2倍梯度稀释,采用间接ELISA方法检测其亲和常数及效价。结果显示,Anti-A-LPS:5和Anti-A-LPS:10的亲和常数分别为1.12×109和1.11×109,效价分别为1∶6 400和1∶12 800。表明其效价高。检测结果见表3及图3。
表3 单克隆抗体亲和常数及效价检测结果
Tab.3 Affinity constants and titers of monoclonal antibodies
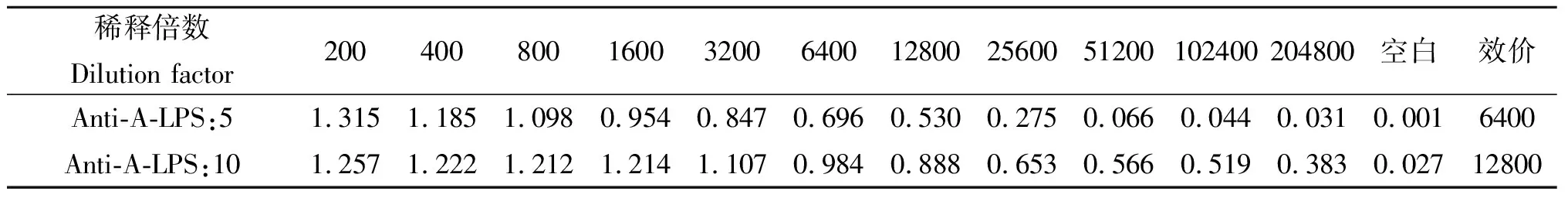
稀释倍数Dilution factor200400800160032006400128002560051200102400204800空白效价Anti-A-LPS:51.3151.1851.0980.9540.8470.6960.5300.2750.0660.0440.0310.0016400Anti-A-LPS:101.2571.2221.2121.2141.1070.9840.8880.6530.5660.5190.3830.02712800
注:数据为ELISA OD(450 nm,630 nm)
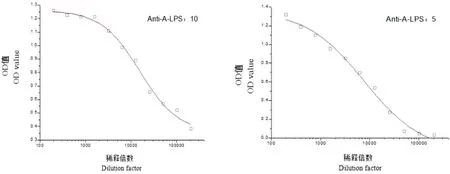
图3 单克隆抗体亲和常数及效价检测结果Fig.3 Affinity constant and titer test results of monoclonal antibodies
2.5单克隆抗体亚类鉴定 将纯化的两株单克隆抗体按照1.8.2方法进行亚类鉴定。结果显示,两株单克隆抗体分别为IgG3和IgG1,轻链类型均为κ型。检测结果见表4。
表4 单克隆抗体亚类鉴定结果
Tab.4 Identification results of monoclonal antibody subclasses

编号Anti-A-LPS:5Anti-A-LPS:10IgG30.4930.022IgG10.0320.433κ0.1040.095
注:数据为ELISA OD(450 nm,630 nm)值
2.6单克隆抗体纯度检测 通过SDS-PAGE凝胶电泳对收腹水纯化后的两株单克隆抗体进行纯度检测。结果显示,两株单克隆抗体均在55 kD和25 kD左右处出现明显条带,分别单克隆抗体的重链和轻链,凝胶上无其他杂带。表明本试验获得的这两株单克隆抗体纯度较高,无其他杂蛋白。结果见图4。
2.7 特异性检测
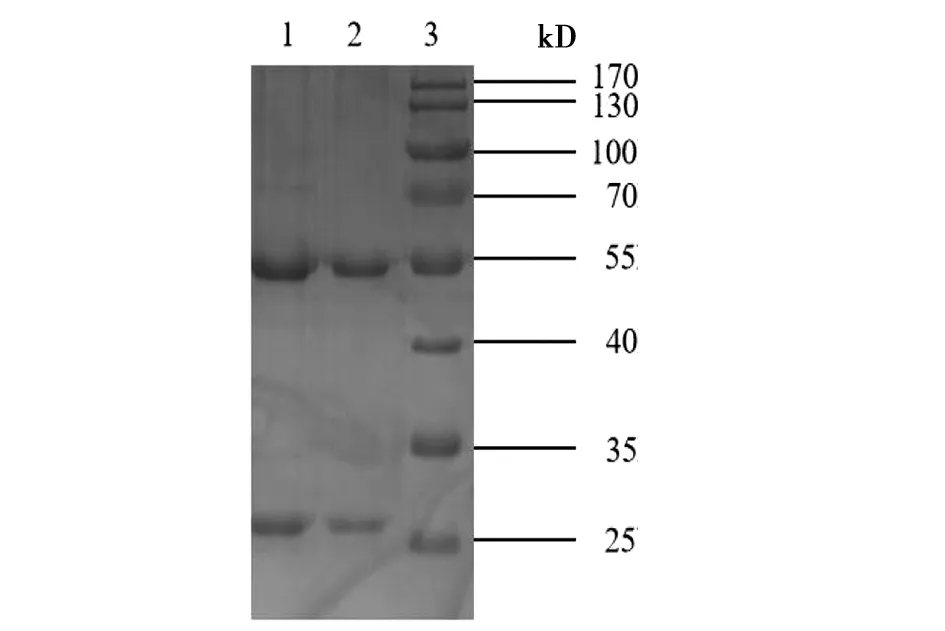
1:Anti-A-LPS:5;2:Anti-A-LPS:10;3:Marker图4 单克隆抗体SDS-PAGE图Fig.4 SDS-PAGE map of monoclonal antibodies
2.7.1交叉反应性试验 通过ELISA方法对单克隆抗体的特异性进行检测。从实验结果可见,本实验获得的两株杂交瘤细胞分泌的单克隆抗体上清与大肠杆菌O157裂解抗原、鸡沙门氏菌裂解抗原、福氏志贺菌全菌、鸭源鸡杆菌1-S脂多糖不发生反应,均呈现阴性,只与灭活的羊种布鲁菌16M裂解抗原发生反应,呈现阳性。表明本试验获得的两株单克隆抗体特异性强。试验结果见表5。
表5 5种不同菌株与两株杂交瘤细胞上清反应结果
Tab.5 Results of reaction between five different strains and two hybridoma cell supernatants
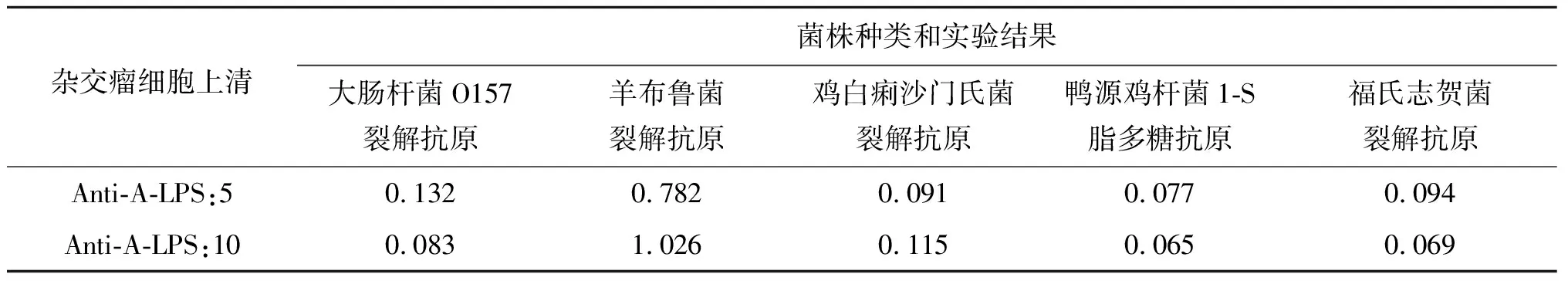
杂交瘤细胞上清菌株种类和实验结果大肠杆菌O157裂解抗原羊布鲁菌裂解抗原鸡白痢沙门氏菌裂解抗原鸭源鸡杆菌1-S脂多糖抗原福氏志贺菌裂解抗原Anti-A-LPS:50.1320.7820.0910.0770.094Anti-A-LPS:100.0831.0260.1150.0650.069
注:数据为ELISA OD(450 nm,630 nm)值
2.7.2间接免疫荧光试验 通过间接免疫荧光方法对筛选出的两株单克隆抗体进行一抗孵育1 h的效果评价试验。结果显示,两株单克隆抗体在1 h内均能与羊种布鲁菌16M、猪种布鲁菌S2、牛种布鲁菌2308结合,且结合效果较好。结果见图5。
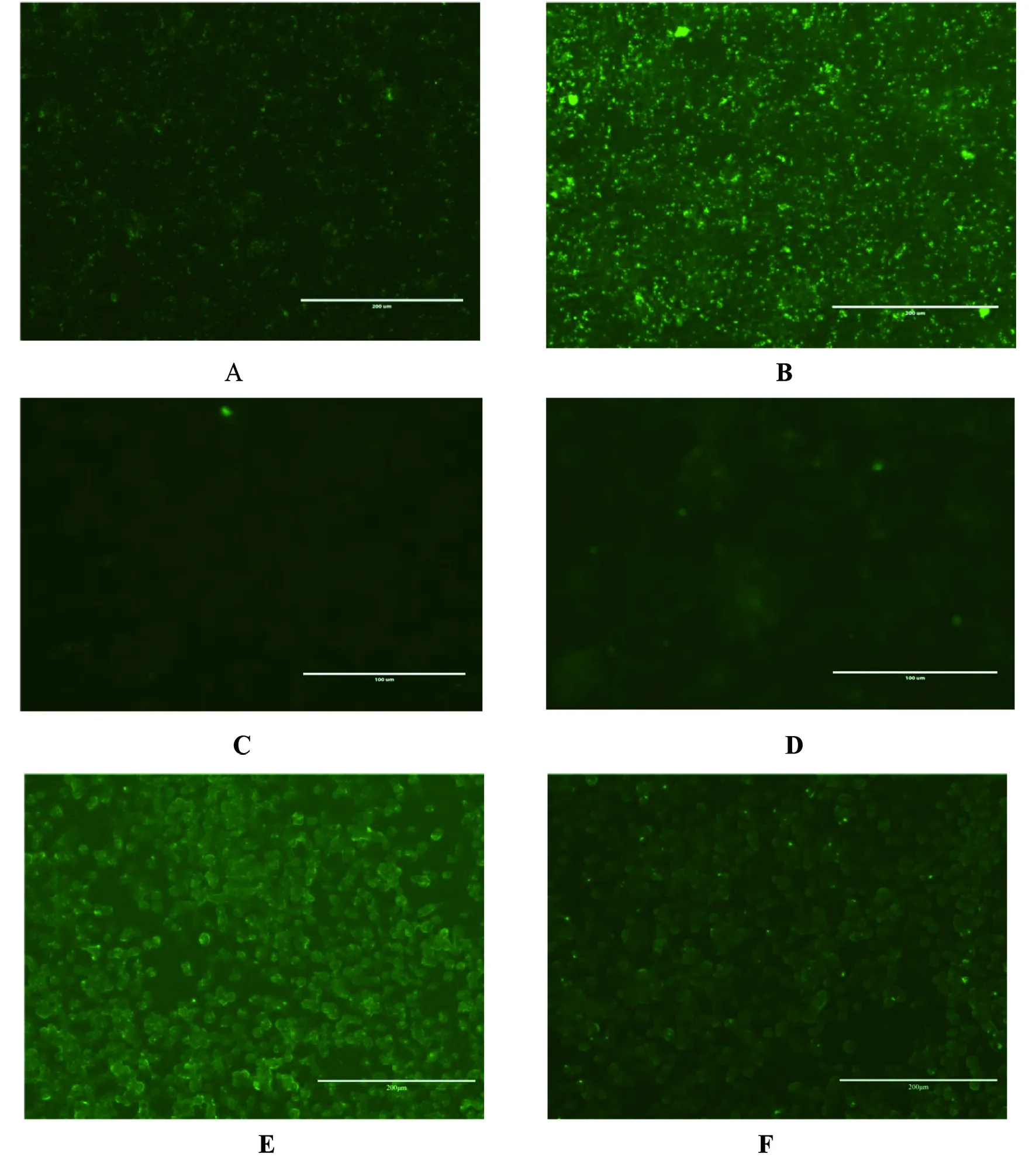
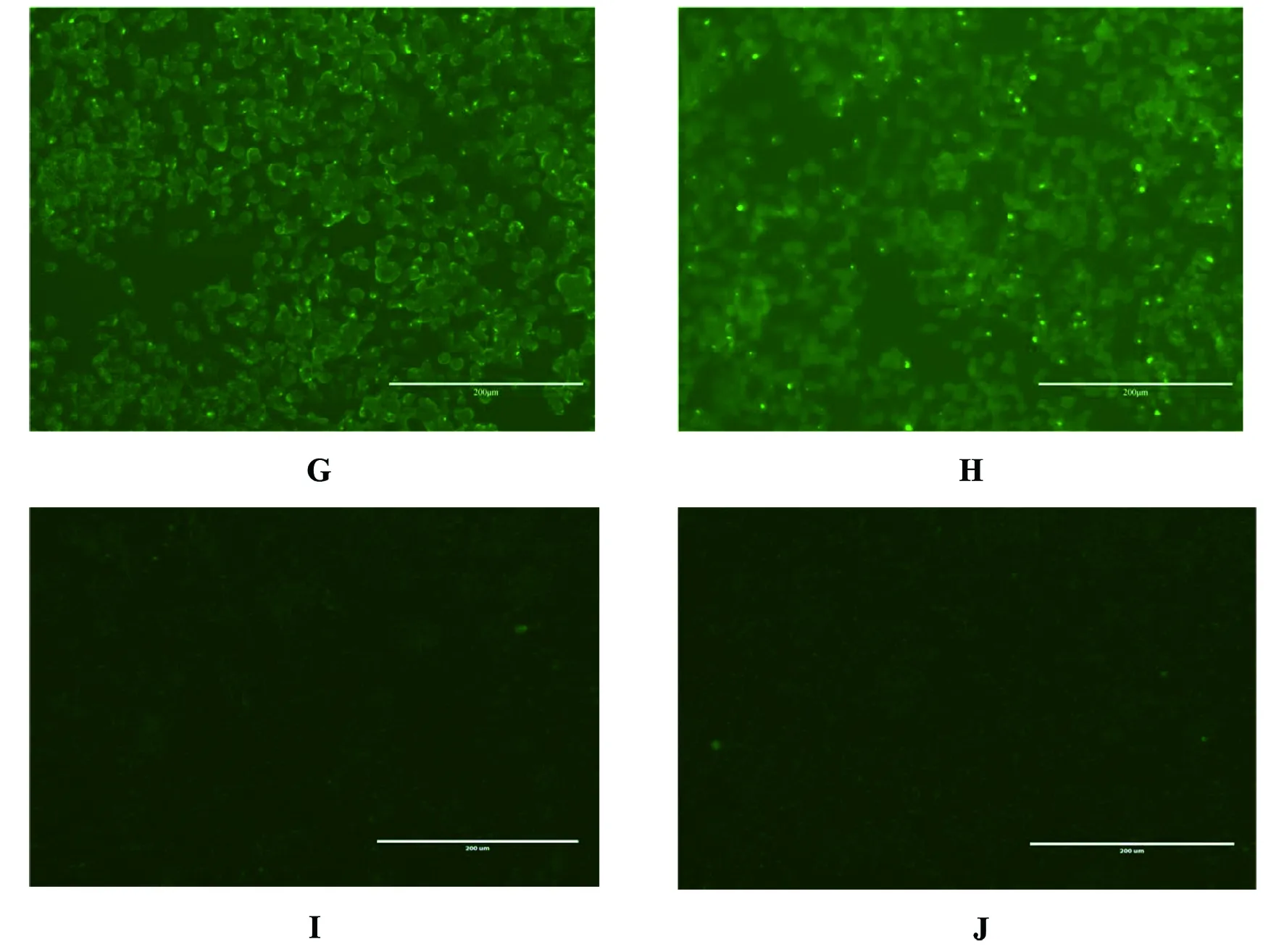
A:Anti-A-LPS:5与16M反应;B: Anti-A-LPS:10与16M反应;C:Anti-A-LPS:5的阴性对照;D:Anti-A-LPS:10的阴性对照;E: Anti-A-LPS:5与S2反应;F:Anti-A-LPS:5与2308反应;G:Anti-A-LPS:10与S2反应;H:Anti-A-LPS:10与2308反应;I:Anti-A-LPS:5的阴性对照;J:Anti-A-LPS:10的阴性对照图5 单克隆抗体间接免疫荧光试验结果Fig.5 Indirect immunofluorescence test of monoclonal antibody
2.7.3布鲁菌A、M因子血清凝集试验 通过将LPS分别与两株单抗及布鲁菌A、M因子血清进行玻片凝集试验,以此来判断两株单抗的特异性。实验结果显示,LPS分别与Anti-A-LPS:5和Anti-A-LPS:10两株单抗发生凝集,同时与布鲁菌A、M因子血清也发生凝集。表明制备的两株单抗均可以识别布鲁菌A、M抗原位点。结果见图6。
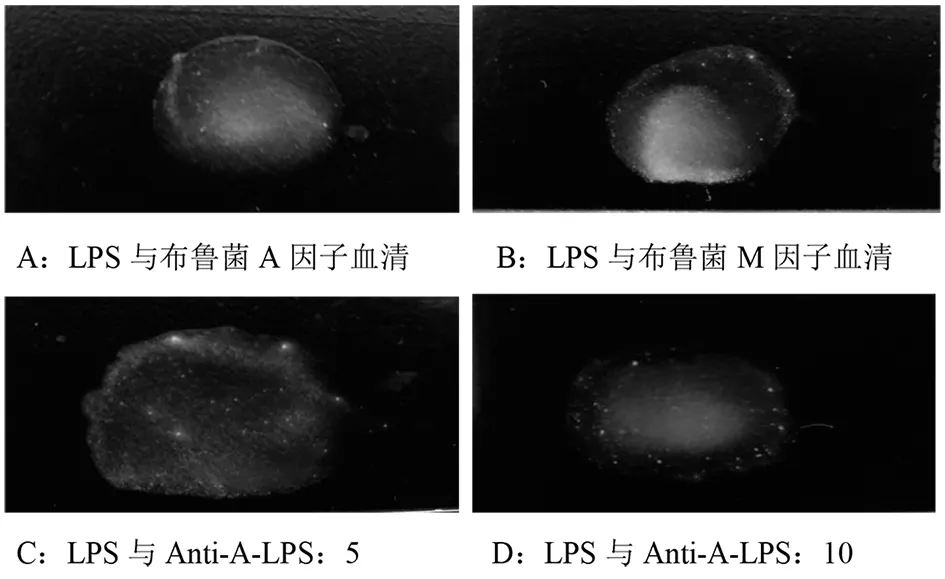
图6 布鲁菌A、M因子血清凝集试验结果Fig.6 Serum slide agglutination test of factor A and M of Brucella
2.7.4试管凝集试验 试验结果显示,制备的两株布鲁菌LPS单克隆抗体均能与布鲁菌试管凝集抗原发生特异性免疫反应,并且敏感性高,稀释至1∶800倍时依然可以发生明显的凝集反应。试验结果如图7所示。

图7 单克隆抗体与试管凝集抗原反应Fig.7 Monoclonal antibody reacts with tube agglutination antigen
3 讨 论
光滑型布鲁菌表面的LPS是布鲁菌重要的毒力分子和抗原物质。将平滑型布鲁菌LPS合成所需酶的编码基因进行突变,就可以产生粗糙型的布鲁菌突变株,并且使其毒力减弱,针对这一特点可以设计减毒活疫苗[19]。布鲁菌LPS可逃避宿主免疫系统识别,这有利于布鲁菌入侵宿主细胞并在胞内生存[20]。布鲁菌感染后引起宿主产生明显的体液免疫反应,然而最明显且最持久的抗体还是针对布鲁菌表面LPS而产生的。由于布鲁菌表面的LPS是非典型的LPS,不同于其他革兰氏阴性菌,因此针对它制备单抗进行布鲁菌病原或抗体检测具有良好的检测效果。所以,目前针对布鲁菌抗体进行检测的产品大部分都是针对布鲁菌LPS进行设计研制的。如IDEXX的布鲁菌抗体检测试剂盒,以及国内一些公司生产的胶体金快速抗体检测卡等。
在单抗制备过程中,LPS的提取是比较关键的技术。由于LPS的提取难度较大,提取量较少,提取过程较复杂,因此本研究利用热酚法提取了羊种布鲁菌16M LPS,所得LPS收量较大,并且节约了提取时间。在其他研究中LPS的提取时间一般在5天以上,我们的研究中将时间缩短至3 d。采用SDS-PAGE分离后进行银染鉴定,结果显示提取的LPS纯度和浓度均较高。这是制备单克隆抗体的基本保障。
在我国布病的危害日益增加,因此,制备效价高、反应原性强、敏感性高、应用范围广的布鲁菌LPS单克隆抗体对于布鲁菌检测及防控具有重要价值。本研究筛选鉴定了5株单克隆抗体,我们从中筛选了两株反应原性强的单抗进行了免疫学验证。通过免疫荧光试验,布鲁菌A,M因子血清凝集试验及试管凝集试验发现这两株单抗均能发生免疫反应,且其与大肠杆菌O157裂解抗原、鸡沙门氏菌裂解抗原、福氏志贺菌全菌、鸭源鸡杆菌1-S脂多糖均无免疫反应。这一结果与王艳[21]研究结果相符。由于布鲁菌的生存和增殖主要是在巨噬细胞中,因此我们选用羊种布鲁菌16M、猪种布鲁菌S2、牛种布鲁菌2308感染巨噬细胞系RAW264.7,用制备的两株单克隆抗体作为一抗进行免疫荧光检测。结果显示,制备的两株单抗均能与羊种布鲁菌16M、猪种布鲁菌S2、牛种布鲁菌2308结合,这对于研制检测布鲁菌的诊断产品具有重要价值,这也是本研究具有的特殊意义。除此之外,我们还将LPS分别与两株单克隆抗体及布鲁菌A、M因子血清进行玻片凝集试验,最终确定获得的两株单克隆抗体均可以识别布鲁菌A、M抗原位点。试管凝集试验结果显示,这两株单克隆抗体均能与布鲁菌试管凝集抗原发生特异性反应,而且两株单克隆抗体的敏感性均可以达到1∶800,这个结果与其他研究结果相比,我们制备的单抗具有较好的敏感性。通过以上研究,我们成功地提取了羊种布鲁菌16M LPS,同时筛选鉴定了两株单克隆抗体,这两株单克隆抗体均具有良好的亲和效果,反应原性及敏感性。为本实验后续研究这两株单克隆抗体的特性,建立布鲁菌快速病原及抗体检测方法及研制快速检测产品奠定了良好的实验基础。
利益冲突:无
