微小隐孢子虫IId亚型早期感染对HCT-8细胞TLRs的影响
2019-02-28王臣荣张振杰张贵玲牛子文张龙现张素梅
王臣荣,张振杰,张 璐,张贵玲,牛子文,张龙现,张素梅
隐孢子虫是重要的人兽共患原虫之一,可致感染宿主以腹泻为主要临床症状的隐孢子虫病[1-2]。隐孢子虫多通过“粪-口”途径传播,牛被认为是人类隐孢子虫病的重要传染源,牛粪污染水源和食物是导致人体隐孢子虫病暴发的主要因素[3-5]。寄生于牛的隐孢子虫主要有4种:微小隐孢子虫(C.parvum)、安氏隐孢子虫(C.andersoni)、牛隐孢子虫(C.bovis)和芮氏隐孢子虫(C.ryanae)[6]。而C.parvum是最重要的人兽共患隐孢子虫虫种,世界范围内人体隐孢子虫病例约45%由该虫引起,而其它3个寄生于牛的虫种均具有宿主特异性[1,7]。犊牛感染的C.parvum虫亚型常见的属IIa亚型家族,多见于北美洲、南美洲、欧洲和澳洲等国家和地区,而在北非、中亚和东亚等国家和地区,则以IId亚型家族更为常见[7-12]。目前在中国动物和人中分离出的C.parvum均为IId亚型[8]。
C.parvum是一种机会性致病原虫,其致病能力与宿主的免疫状况相关[13]。TLRs (Toll-like receptors, TLRs)是一种常见的病原模式识别受体,其在病原体入侵宿主细胞期间起着非常重要的作用。一旦病原分子被TLRs识别,这些模式受体招募接头蛋白,激活下游信号进一步分泌粘附分子、炎症因子(细胞因子或者趋化因子)和抗菌肽来抵抗C.parvum的感染[14-15]。C.parvumIIa亚型早期感染对人胆管上皮细胞及结肠腺癌细胞TLRs的影响已被研究[16-17],结果显示C.parvum感染导致人胆管上皮细胞TLR4的上调是通过let-7i的下调导致的,但是作为中国流行株的C.parvumIId亚型感染对人肠上皮细胞TLRs的影响尚未见报道,而本实验室已发表数据显示C.parvumIId亚型感染会导致人结肠癌细胞HCT-8细胞miRNAs表达谱发生改变[18]。因此本研究利用qPCR分析C.parvumIId亚型早期感染(4 h和12 h)对HCT-8细胞TLRs的影响,并利用生物信息学分析这些表达差异显著的miRNAs与TLRs的关系,为C.parvum感染肠道上皮细胞机制的研究提供基础。
1 材料与方法
1.1主要试剂 DMEM培养基购自索莱宝科技有限公司;胎牛血清(Fetal bovine serum,FBS)购自四季青公司;TRIzol购自Invitrogen公司;TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒及SYBR Premix Ex Taq II(Tli RNaseH Plus)试剂盒都购自索莱宝科技有限公司。
1.2试验细胞及虫株 HCT-8细胞及C.parvumIId亚型卵囊均为本实验室保存。
1.3C.parvumIId亚型卵囊无菌化处理 向卵囊加入适量灭菌双蒸水和10%次氯酸钠溶液,保证次氯酸钠终浓度为2.5%,后涡旋振荡,4 ℃静置10 min,5 000 r/min,离心10 min,反复洗涤3次,弃上清,将沉淀置入DMEM培养基中,用于感染HCT-8细胞。另取部分无菌化C.parvum卵囊,100 ℃水浴5 min,使C.parvum卵囊活性丧失,丧失活性的卵囊作为阴性对照组。
1.4HCT-8细胞的培养及感染 参考朱惠丽等[19]建立的C.parvum感染HCT-8细胞的方法,将状态良好的HCT-8细胞消化,加入适量含10%胎牛血清的DMEM培养基,向六孔板中加入2 mL细胞培养基,37 ℃, 5% CO2培养。待HCT-8细胞贴壁70%~80 %时,弃掉细胞培养液,以无菌PBS洗涤2次,试验组每孔加入2 mL 2% FBS 及100 U/mL青链霉素的DMEM培养基,其中含有1×107个无菌化C.parvum卵囊,对照组加入等量丧失活性的C.parvum卵囊,2.5 h后,弃去6孔板中的细胞培养基,添加2 mL 2% FBS 及100 U/mL青链霉素的DMEM培养基,在4 h及12 h后分别弃掉细胞培养液,以无菌PBS洗涤2次后向六孔板加入1 mL Trizol,吹打细胞,使细胞裂解,室温静止5 min,放入-80 ℃超低温冰箱中保存。
1.5细胞RNA的提取 在-80 ℃超低温冰箱中取出加Trizol的HCT-8细胞,溶解并震荡,后加入200 L氯仿,震荡混匀,室温静置5 min。12 000 r/min,离心15 min,完全吸取上清于1.5 mL离心管,勿吸入白色蛋白层后加入500 L异丙醇,轻轻摇匀,4 ℃静置10 min,12 000 r/min,离心10 min,弃上清。向沉淀中加入1 000 L用DEPC水配置的75%乙醇。8 000 r/min,离心10 min,弃上清,重复2次。置于超净台6~8 min后向沉淀中加入20 L DEPC水。
1.6RNA浓度、纯度和完整性鉴定 利用NanoDrop 2000超微量分光光度计测出RNA的A260/A280和A260/A230。利用甲醛变性琼脂糖凝胶电泳技术,利用28S RNA与18S RNA条带宽度评价RNA的完整性。
1.7qPCR分析TLRs表达情况 参照反转录试剂盒说明书对提取的RNA进行反转录,以反转录的cDNA为模板,以GAPDH为内参,采用qPCR检测10种TLR mRNA表达量,PCR引物见表1。
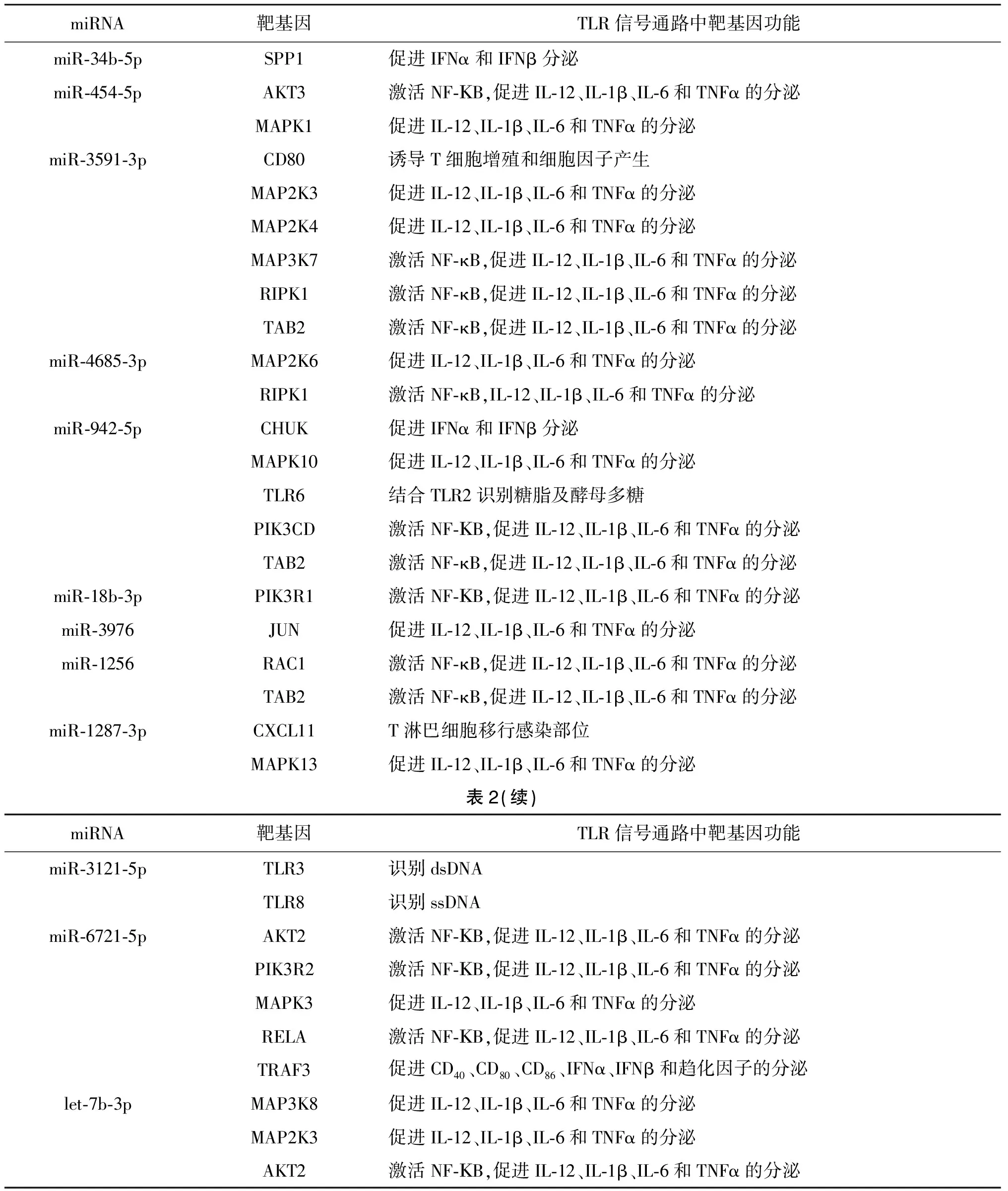
1.8生物信息学分析表达差异显著miRNAs和TLRs的关系 本实验室已发表数据显示C.parvumIId亚型感染会导致人结肠癌细胞HCT-8细胞miRNAs表达谱发生改变[18],这些表达差异显著的miRNAs包括hsa-miR-122-5p、hsa-miR-3591-3p、hsa-miR-6074、hsa-miR-454-5p、hsa-miR-34b-5p、hsa-miR-4685-3p、hsa-miR-1908-3p、hsa-miR-942-5p、hsa-miR-5580-3p、hsa-miR-6763-5p、hsa-miR-181d-3p、hsa-miR-18b-3p、hsa-miR-4689、hsa-miR-1256、hsa-miR-3976、hsa-let-7b-3p、hsa-miR-6721-5p、hsa-miR-3118、hsa-miR-3121-5p及hsa-miR-1287-3p,利用Target Scan Human 7.2和 miRDB分别预测差异表达的miRNAs靶基因,并取其交集,进一步分析差异表达的miRNAs与TLRs的关系。
表1 TLRs及GAPDH引物
Tab.1 Details of primers of TLRs and GAPDH

TLRs引物上游引物下游引物TLR1GGTGTTGGCTGTGACT-GTGATGGAGTTCTTCTAAGGG-TATGTLR2GATGCCTACTGGGTG-GAGAAGACGGAAATGG-GAGAAGTTLR3CCAAGCCT-TCAACGACTGTTGCGTGTTTCCAGAGCCTLR4GGTGATTGTTGTGGT-GTCCCAAGTGTTCCTGCT-GAGAAGGCGTLR5CAACCTTACAGCGAACCAAACATCCCAACAGAGCTLR6CAGTTAATACTT-TAGGGTGCTCGTTTCTATGTGGTT-GAGGGTLR7CCTTTCCCAGAGCATA-CAGCGGACAGAACTCCCA-CAGAGCTLR8CAGAGCATCAAC-CAAAGCAAGCTGCCGTAGCCT-CAAATACTLR9GTGCAGCCGGAGAT-GTTTCGTGAATGAGTGCTCGT-GGTAGTLR10GCCCACCACAATCTCT-TCCAGCCCACATTTACGC-CTATCCTTGAPDHAGAAGGCTGGGGCT-CATTTGAGGGGCCATCCA-CAGTCTTC
1.9数据的统计及分析 采用2-△△Ct方法对处理数据,并利用GraphPad Prism 8对处理的数据进行作图和统计学分析,P<0.05表示有统计学意义,检验水准α=0.05。
2 结 果
2.1RNA纯度及完整性鉴定 提取RNA的A260/A280比值范围为1.9~2.07,A260/A230比值范围为2.0~2.2。经甲醛变性琼脂糖凝胶电泳后,可以显示28S RNA与18S RNA条带宽度约为2∶1,5S RNA条带模糊(图1)。
1-2:RNA from 4 h post infection; 3-4: RNA from 12 h post infection; 5: RNA from uninfection HCT-8图1 甲醛变性琼脂糖凝胶电泳图Fig.1 Picture of formaldehyde denatured agarose gel electrophoresis
2.2HCT-8细胞中TLRs的表达 提取HCT-8细胞RNA,反转录为cDNA,扩增TLR1~10基因片段其电泳图(图2)。对扩增出的目的片段进行测序及比对分析发现扩增出的10个片段确为TLR1~10 mRNA特异性片段。
M:DL 2000;1-10:TLR1-10;11:GAPDH图2 TLR1~10及GAPDH琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of TLR1-10 and GAPDH
2.3C.parvumIId亚型早期感染(4 h和12 h)对HCT-8细胞TLRs的影响 采用2Ct方法对数据进行处理,在C.parvumIId亚型感染HCT-8细胞4 h和12 h,只有TLR2和TLR4上调,其中感染4 h TLR2较对照组上调3倍(t=4.961,P=0.0077),TLR4较对照组上调3倍(t=22.31,P<0.0001)具有统计学意义;感染12 h TLR2较对照组上调1.5倍(t=4.052,P=0.004 1),TLR4较对照组上调1倍(t=12.18,P=0.000 3)具有统计学意义;其余TLRs在统计学上无明显变化,其中感染4 h TLR1(t=0.8941,P=0.421 8),TLR3(t=0.666 7,P=0.541 5),TLR5(t=0.500 1,P=0.643 3),TLR6(t=1.013,P=0.368 5),TLR7(t=1.578,P=0.157 8),TLR8(t=2.115,P=0.101 9),TLR9(t=0.159 6,P=0.880 9)及TLR10(t=2.032,P=0.112 0);感染12 h TLR1(t=1.983,P=0.118 3),TLR3(t=0.337 1,P=0.753 0),TLR5(t=0.616 7,P=0.570 8),TLR6(t=0.606 4,P=0.577 0),TLR7(t=1.158,P=0.311 4),TLR8(t=2.305,P=0.082 5),TLR9(t=0.135 6,P=0.898 0)及TLR10(t=2.485,P=0.067 8),结果见图3和4。
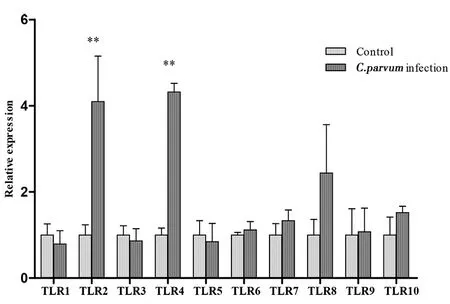
图3 微小隐孢子虫IId亚型感染4 h对HCT-8细胞TLRs转录的影响Fig.3 Transcription of TLRs in HCT-8 cells at 4 hours after C. parvum infection
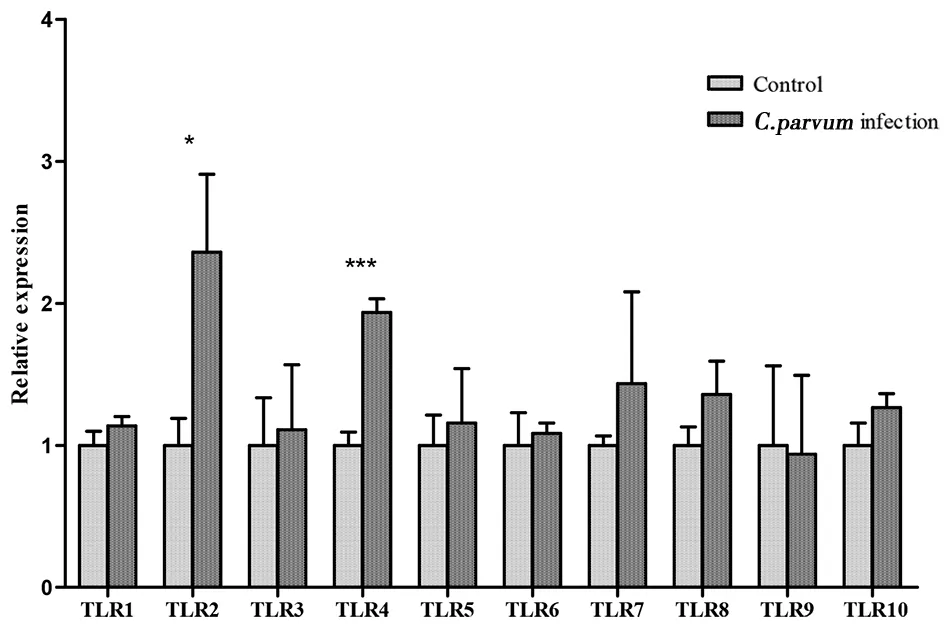
图4 微小隐孢子虫IId亚型感染12 h对HCT-8细胞TLRs转录的影响Fig.4 Transcription of TLRs in HCT-8 cells at 12 hours after C. parvum infection
表2 TLR信号通路中miRNAs的预测靶基因
Tab.2 Predicted target genes of miRNAs in TLR signaling pathways
miRNA靶基因TLR信号通路中靶基因功能miR-34b-5pSPP1促进IFNα和IFNβ分泌miR-454-5pAKT3激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌MAPK1促进IL-12、IL-1β、IL-6和TNFα的分泌miR-3591-3pCD80诱导T细胞增殖和细胞因子产生 MAP2K3促进IL-12、IL-1β、IL-6和TNFα的分泌MAP2K4促进IL-12、IL-1β、IL-6和TNFα的分泌MAP3K7激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌RIPK1激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌TAB2激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌miR-4685-3pMAP2K6促进IL-12、IL-1β、IL-6和TNFα的分泌RIPK1激活NF-κB,IL-12、IL-1β、IL-6和TNFα的分泌miR-942-5pCHUK促进IFNα和IFNβ分泌MAPK10促进IL-12、IL-1β、IL-6和TNFα的分泌TLR6结合TLR2识别糖脂及酵母多糖PIK3CD激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌TAB2激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌miR-18b-3pPIK3R1激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌miR-3976JUN促进IL-12、IL-1β、IL-6和TNFα的分泌miR-1256RAC1激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌TAB2激活NF-κB,促进IL-12、IL-1β、IL-6和TNFα的分泌miR-1287-3pCXCL11T淋巴细胞移行感染部位MAPK13促进IL-12、IL-1β、IL-6和TNFα的分泌表2(续)miRNA靶基因TLR信号通路中靶基因功能miR-3121-5pTLR3识别dsDNATLR8识别ssDNAmiR-6721-5pAKT2激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌PIK3R2激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌MAPK3促进IL-12、IL-1β、IL-6和TNFα的分泌RELA激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌TRAF3促进CD40、CD80、CD86、IFNα、IFNβ和趋化因子的分泌let-7b-3pMAP3K8促进IL-12、IL-1β、IL-6和TNFα的分泌MAP2K3促进IL-12、IL-1β、IL-6和TNFα的分泌AKT2激活NF-ΚB,促进IL-12、IL-1β、IL-6和TNFα的分泌
3 讨 论
研究报道C.parvumIIa亚型卵囊感染的人胆管上皮细胞和Caco-2细胞均表达TLR1~TLR10 mRNA,并且TLR2和TLR4 mRNA被显著上调[16-17],与本研究C.parvumIId亚型早期感染致HCT-8细胞TLR2和TLR4 mRNA显著上调一致,说明C.parvum早期感染人胆管上皮细胞和人小肠上皮细胞都会引起其TLR2和TLR4 mRNA的显著上调,TLR2和TLR4的显著上调可能与细胞识别C.parvum有关。研究报道C.parvumIIa亚型卵囊早期感染致人胆管上皮细胞TLR2和TLR4的上调,导致其下游的IL-1R相关激酶、p-38和NF-kB活化进而来抵抗C.parvum的感染[16]。
关于感染C.parvum的宿主miRNAs介导TLRs的表达研究并不多,Chen等[20]报道微小隐孢子虫IIa亚型卵囊感染导致人胆管上皮细胞let-7i下调,let-7i在转录后水平抑制TLR4的表达,下调的let-7i可以导致TLR4蛋白表达水平提高,进而来调节宿主细胞对微小隐孢子虫的免疫反应。而本研究通过预测表达差异显著miRNA的靶基因,发现这些预测的靶基因中没有TLR2和TLR4,但是这些靶基因中有TLR信号通路相关的基因。由于本研究未在蛋白水平上对TLR1~10进行分析,因此下一步应对TLR1~10蛋白作进一步分析,结合表达差异显著的miRNAs,进一步发现miRNAs与TLR信号通路间的调控关系。
综上所述,C.parvumIId亚型早期感染致HCT-8细胞TLR2和TLR4 mRNA显著上调,而TLR2和TLR4的显著上调可能在C.parvum感染肠道上皮细胞方面起到一定的作用。通过生物信息学分析,发现差异表达miRNAs的预测靶向中有TLR信号通路相关基因。
利益冲突:无
