四种单增李斯特菌常用核酸检测方法的评价与应用
2019-02-28纪顺师叶长芸
纪顺师,叶长芸
单增李斯特菌是一种革兰阳性、兼性厌氧的食源性细菌[1]。该菌感染可引起李斯特菌病,主要症状为败血症、脑膜炎、孕妇流产等,病死率高达20%~30%[2]。传统的培养基分离培养鉴定方法是进行细菌鉴定的“金标准”[3],标本中李斯特菌的检测均需通过2次增菌、选择性培养基分离和生化鉴定,整个过程需要5~7 d才能完成,耗时长[3]。虽然现有核酸检测方法能在数小时内完成目的基因的扩增和检测,但也存在一些不足。PCR方法需经过扩增、电泳以及凝胶成像等操作,耗时2~3 h且对仪器设备要求高,不适用于现场快速检测[4]。Real-time PCR方法能对扩增产物进行实时监测且不需要电泳和凝胶成像,但对仪器设备要求高且仪器价格昂贵[5]。环介导等温扩增(LAMP)技术和多交叉置换扩增(MCDA)技术克服了以上劣势[6],在Bst酶的作用下,只需在某一恒定温度(通常为60 ℃~65 ℃)下恒温反应1 h就可完成核酸扩增过程,扩增结果可通过染料颜色、浊度、电泳和胶体金标记试剂条等多种形式进行判断,对实验仪器的要求低且耗时少[7]。
本实验对文献报道的针对单增李斯特菌特异基因lmo0733检测的传统PCR、Real-time PCR、LAMP和MCDA 4种检测方法的特异性、灵敏度进行比较,并应用于模拟单增李斯特菌污染标本和市场采集的猪肉样本的检测,优选出一种特异性好、灵敏度高、快速、高效,能应用于现场检测的方法,为肉制品单增李斯特菌的快速检测及分离鉴定提供依据。
1 材料与方法
1.1 材 料
1.1.1实验菌株 本实验选用了43株单增李斯特菌、22株非单增李斯特菌和15株非李斯特菌,其中单增李斯特菌参考菌株EGD-e用于比较方法的灵敏度,菌株信息见表1。
表1 本实验所使用的菌株
Tab.1 Bacterial strains used in this study
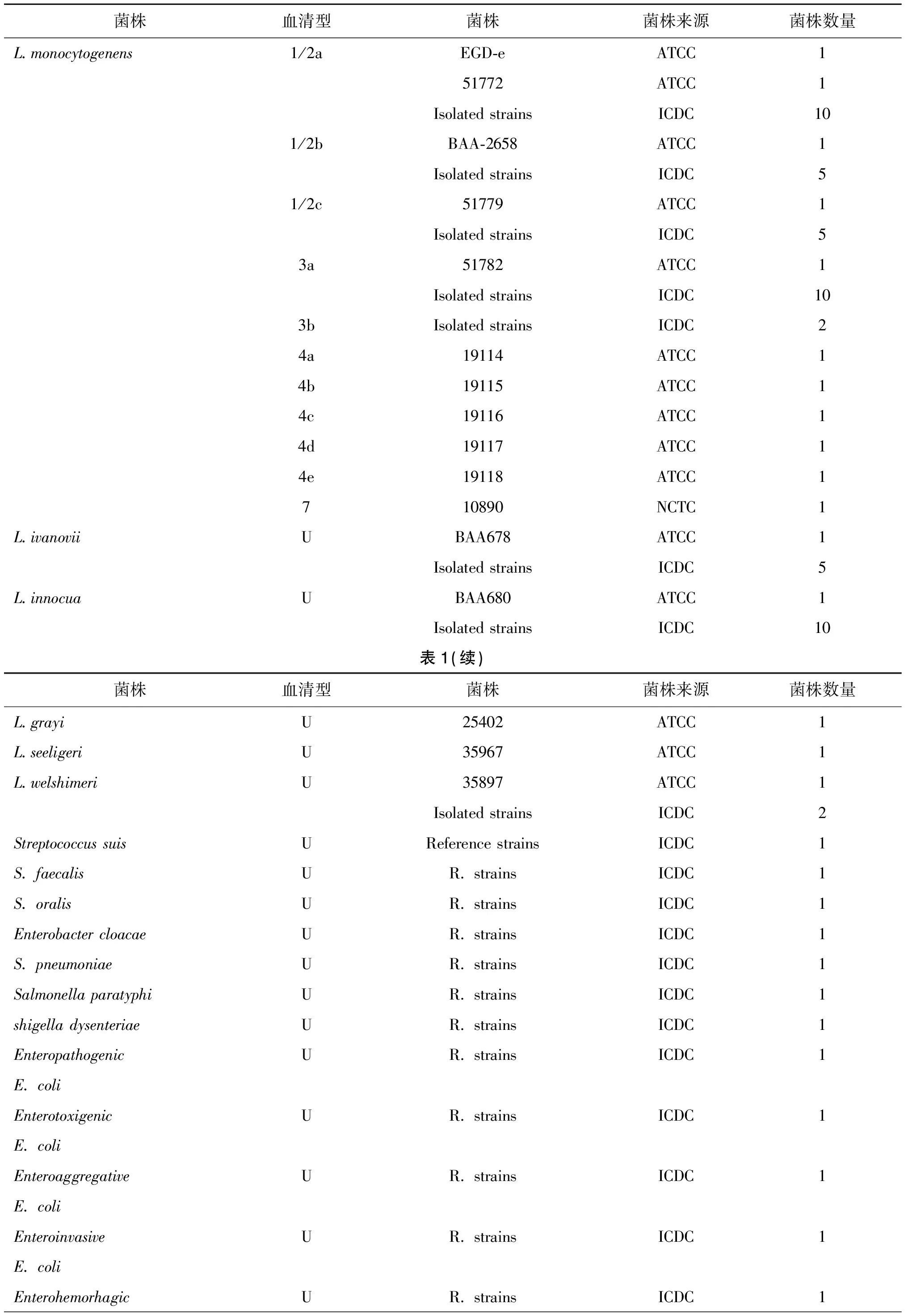
菌株血清型菌株菌株来源菌株数量L.monocytogenens1/2aEGD-eATCC151772ATCC1Isolated strainsICDC101/2bBAA-2658ATCC1Isolated strainsICDC51/2c51779ATCC1Isolated strainsICDC53a51782ATCC1Isolated strainsICDC103bIsolated strainsICDC24a19114ATCC14b19115ATCC14c19116ATCC14d19117ATCC14e19118ATCC1710890NCTC1L.ivanoviiUBAA678ATCC1Isolated strainsICDC5L.innocuaUBAA680ATCC1Isolated strainsICDC10表1(续)菌株血清型菌株菌株来源菌株数量L.grayiU25402ATCC1L.seeligeriU35967ATCC1L.welshimeriU35897ATCC1Isolated strainsICDC2Streptococcus suisUReference strainsICDC1S. faecalisUR. strainsICDC1S. oralisUR. strainsICDC1Enterobacter cloacaeUR. strainsICDC1S. pneumoniaeUR. strainsICDC1Salmonella paratyphiUR. strainsICDC1shigella dysenteriaeUR. strainsICDC1EnteropathogenicUR. strainsICDC1E. coliEnterotoxigenicUR. strainsICDC1E. coliEnteroaggregativeUR. strainsICDC1E. coliEnteroinvasiveUR. strainsICDC1E. coliEnterohemorhagicUR. strainsICDC1
aU,未知血清型;bATCC,美国模式培养物集存库;NCTC,国家标准菌库;ICDC,中国疾病预防控制中心传染病预防控制所。
1.1.2试剂与仪器 FRASER BROTH BASE、BRILLIANCETMLISTERIA AGAR BASE培养基(英国OXOID公司);脑心浸液(北京陆桥技术有限公司);细菌基因组提取试剂盒Bacteria Gene DNA kit(北京康为世纪生物科技有限公司);2×T5 Super PCR Mix(北京擎科新业生物技术公司);Premix Ex TaqTM II、 DL2000 DNA Marker(大连宝生物公司);Loopamp○RDNA反应试剂盒与Loopamp○R荧光检测试剂(北京葵沫生物科技有限公司);核酸恒温扩增试剂盒(北京甄敏生物科技有限公司);引物合成由北京奥科生物技术公司完成。Rotor-Gene Q real-time PCR system (QIAGEN Inc, Germany) ;凝胶成像系统 GEL Doc2000(美国Bio-rad公司);Loopamp○R实时浊度仪LAG320C(荣研生物科技中国公司)。
1.1.3DNA模版的制备 实验菌株(表1)按照试剂盒说明书提取核酸,溶于100 μL Elution buffer中。实际猪肉样本核酸提取步骤如下:取1 mL猪肉样本Fraser增菌培养物,13 000 r/min离心3 min,弃掉上清液,加入200 μL无菌去离子水重悬,金属浴100 ℃加热10 min,13 000 r/min离心3 min,取上清液作为DNA模板-20 ℃保存。
1.2 方 法
1.2.1引物设计 本研究中针对单增李斯特菌的特异基因lmo0733的传统PCR、Real-time PCR、LAMP和MCDA方法的检测引物参考相关文献[7-9],引物序列见表2。
1.2.2特异性验证 43株单增李斯特菌、22株非单增李斯特菌和15株非李斯特菌(表1)用于验证传统PCR、Real-time PCR、LAMP和MCDA方法的特异性,每种方法每个反应体系均加1 μL核酸作为模板,4种方法的具体操作步骤见参考文献[7-9]。
1.2.3灵敏度比较 将试剂盒提取的单增李斯特菌参考株EGD-e的DNA进行倍比稀释(10 ng、1 ng、100 pg、10 pg、1 pg、100 fg、10 fg、1 fg、0.1 fg),用于比较传统PCR、Real-time PCR、LAMP和MCDA方法的检测下限,每种方法均加1 μL倍比稀释的核酸作为模板,且每个稀释度至少重复实验3次。
表2 本研究所使用的引物
Tab.2 Primers used in this study
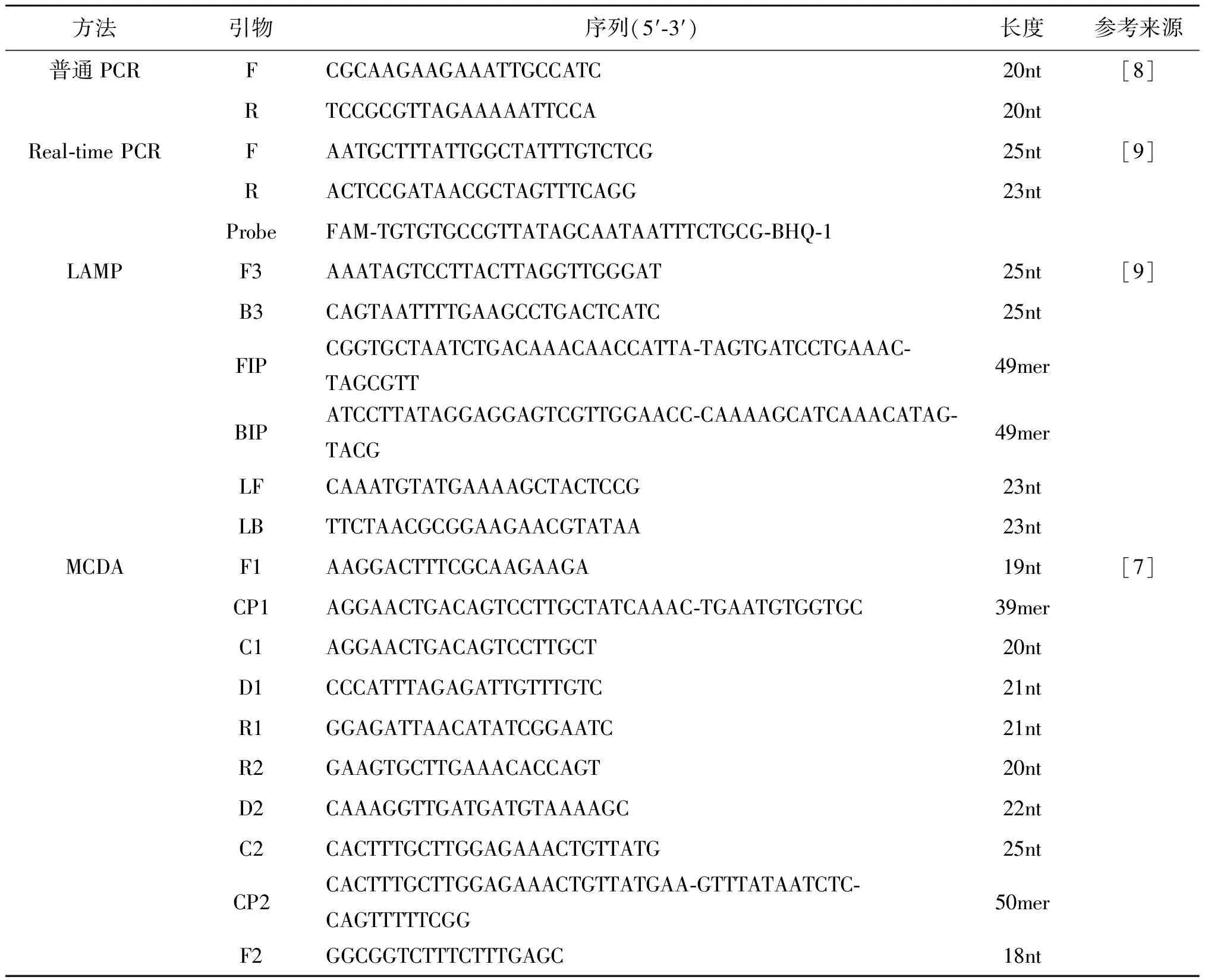
方法引物序列(5′-3′)长度参考来源普通PCRFCGCAAGAAGAAATTGCCATC 20nt[8]RTCCGCGTTAGAAAAATTCCA 20ntReal-time PCRFAATGCTTTATTGGCTATTTGTCTCG 25nt[9]RACTCCGATAACGCTAGTTTCAGG23ntProbeFAM-TGTGTGCCGTTATAGCAATAATTTCTGCG-BHQ-1LAMPF3AAATAGTCCTTACTTAGGTTGGGAT 25nt[9]B3CAGTAATTTTGAAGCCTGACTCATC25ntFIPCGGTGCTAATCTGACAAACAACCATTA-TAGTGATCCTGAAAC-TAGCGTT49merBIPATCCTTATAGGAGGAGTCGTTGGAACC-CAAAAGCATCAAACATAG-TACG49merLFCAAATGTATGAAAAGCTACTCCG23ntLBTTCTAACGCGGAAGAACGTATAA23ntMCDAF1AAGGACTTTCGCAAGAAGA19nt[7]CP1AGGAACTGACAGTCCTTGCTATCAAAC-TGAATGTGGTGC39merC1AGGAACTGACAGTCCTTGCT20ntD1CCCATTTAGAGATTGTTTGTC 21ntR1GGAGATTAACATATCGGAATC21ntR2GAAGTGCTTGAAACACCAGT20ntD2CAAAGGTTGATGATGTAAAAGC22ntC2CACTTTGCTTGGAGAAACTGTTATG25ntCP2CACTTTGCTTGGAGAAACTGTTATGAA-GTTTATAATCTC-CAGTTTTTCGG 50merF2GGCGGTCTTTCTTTGAGC 18nt
1.2.4模拟样本的制备 市场购买的新鲜猪肉作为原始模拟样本,称取25 g采用欧标方法(ISO11290-1:2017)进行单增李斯特菌的分离培养鉴定,单增李斯特菌检测阴性的猪肉样本被认为无单增李斯特菌污染,可用于制备模拟样本。挑取参考株EGD-e单菌落接种到5 mL BHI液体培养基,37 ℃,220 r/min增菌直至OD600达到0.6,吸取100 μL增菌液到900 μL PBS缓冲液中进行连续10倍稀释。分别对不同浓度稀释液进行菌落计数,得到100 μL增菌液中含有的单增李斯特菌数量,取100 μL稀释菌液与单增李斯特菌检测阴性的25 g猪肉样本混合制备成模拟样本,模拟样本中单增李斯特菌的终浓度分别为5×100CFU/25 g~5×108CFU/25 g。
1.2.5模拟样本灵敏度检测 制备的模拟样本用50 mL PBS缓冲液浸泡反复揉捏几次,将PBS冲洗液12 000 r/min离心10 min,弃上清液,保留沉淀,按照试剂盒说明书提取核酸。应用传统PCR、Real-time PCR、LAMP和MCDA方法对模拟样本进行检测,评价每种方法的检测灵敏度。
1.2.6欧标方法(ISO11290-1:2017)检测猪肉样本中的单增李斯特菌 某猪肉零售市场不同摊位采集的50份猪肉样本,取25 g猪肉样本加入到225 mL的Half Fraser增菌液中,30 ℃,220 r/min,增菌24 h。然后取0.1 mL一次增菌培养物加入到10 mL Fraser 增菌液中,37 ℃,220 r/min,增菌36~48 h。用接种环取3环二次增菌产物,接种至李斯特菌显色固体培养基,37 ℃恒温孵育24~36 h,平板上挑取5个单增李斯特菌典型或可疑菌落,涂布于BHI平板进行纯培养,用于单增李斯特菌鉴定。
1.2.7核酸检测方法检测猪肉样本增菌液培养物
取1 mL Fraser培养液中的增菌培养物提取DNA,13 000 r/min离心3 min,弃上清,加入200 μL去离子水重悬,100 ℃金属浴加热10 min,13 000 r/min离心3 min,取上清液作为模板,同时使用传统PCR、Real-time PCR、LAMP和MCDA方法进行单增李斯特菌核酸检测。
1.2.8欧标检测方法和4种核酸检测方法对猪肉样本分离单增李斯特菌检出率比较 以“金标准”中欧洲标准培养方法得到单增李斯特菌阳性的样本作为参照,比较4种核酸检测方法与欧洲标准方法的单增李斯特菌阳性检出率及一致性情况。
2 结 果
2.1引物验证 传统PCR、Real-time PCR、LAMP和MCDA方法的检测引物通过NCBI BLAST(Basic Local Alignment Search Tool)进行特异性比对,结果显示4种核酸检测方法的引物(表2)均为单增李斯特菌特异。
2.2特异性的验证 43株单增李斯特菌、22株非单增李斯特菌和15株非李斯特菌(表1)用于传统PCR、Real-time PCR、LAMP和MCDA方法的特异性验证,结果显示4种方法均能特异性扩增单增李斯特菌。
2.3灵敏度结果 如图1所示,对于单增李斯特菌参考株EGD-e倍比稀释的核酸,传统PCR方法的检测下限为10 pg/反应;Real-time PCR和LAMP方法的检测下限均为100 fg/反应,是传统PCR方法灵敏度的100倍;MCDA方法的检测下限为10 fg/反应,是传统PCR方法灵敏度的1 000倍,并且MCDA方法对于浓度为10 fg的核酸30 min内即可检测到。
2.4模拟样本检测灵敏度结果 如图2所示,传统PCR方法对于模拟污染猪肉样本的检测能力为5×103CFU/反应;Real-time PCR和LAMP方法检测模拟样本的能力达到5×102CFU/反应,是传统PCR方法灵敏度的10倍;MCDA方法的检测下限为5×101CFU/反应,灵敏度为传统PCR方法的100倍。因此,MCDA方法的对模拟样本的检测比其它3种核酸检测方法灵敏。
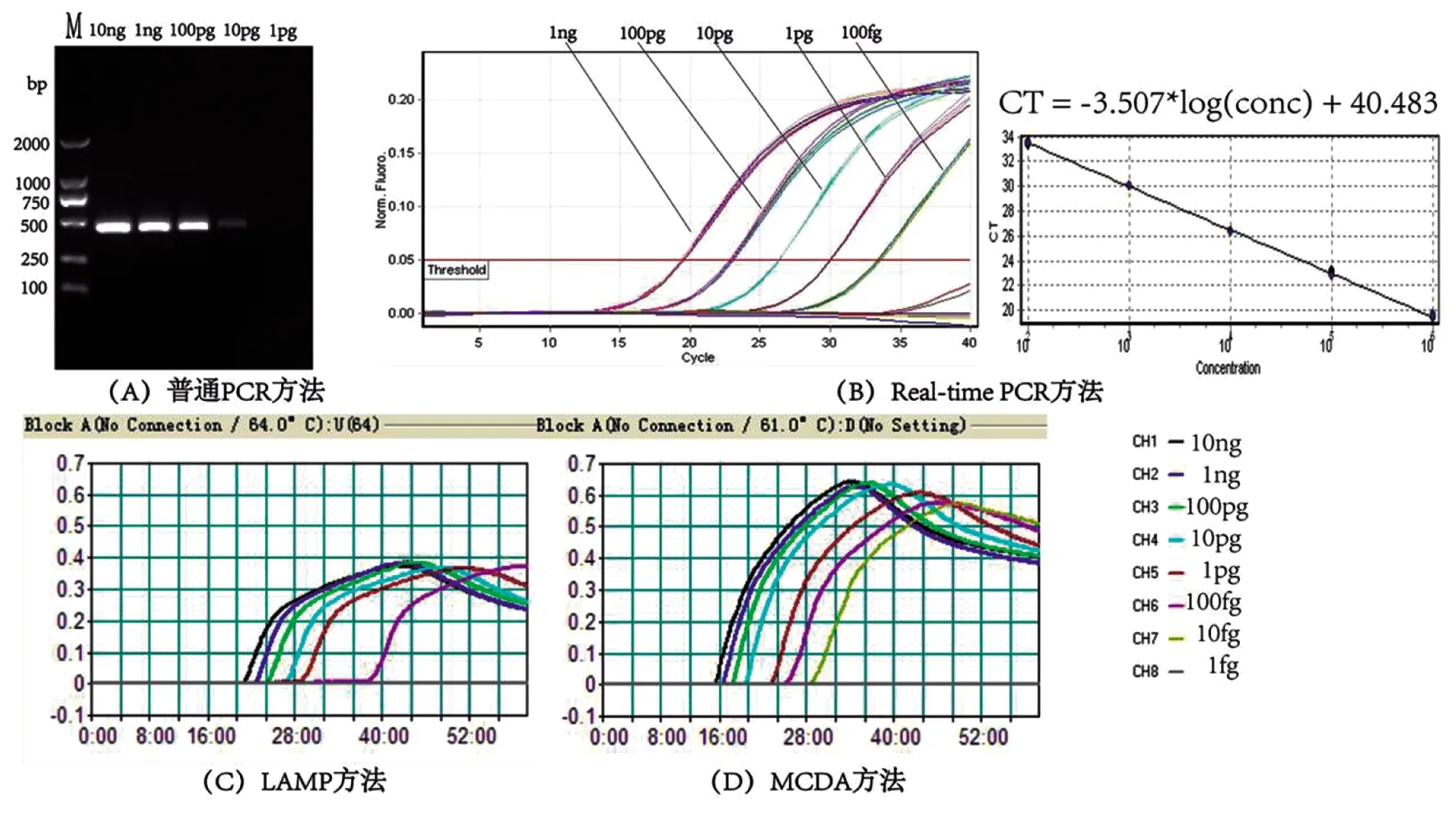
(A) 普通PCR方法的检测下限;(B) Real-time PCR方法的检测下限;(C) LAMP方法的检测下限,(D) MCDA方法的检测下限。M,DL2000bp,DNA Marker。图1 单增李斯特菌EGD-e菌株核酸检测下限 Fig.1 LOD of four methods for nucleic acid of L. monocytigenes EGD-e
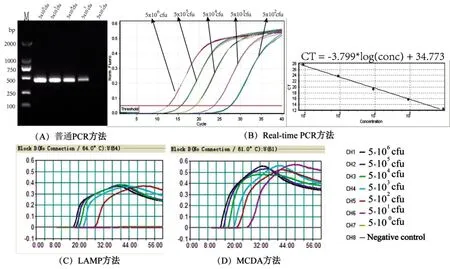
(A)普通PCR方法的检测下限;(B)Real-time PCR方法的检测下限;(C) LAMP方法的检测下限,(D) MCDA方法的检测下限。M,DL2000bp,DNA Marker。图2 4种核酸检测方法对模拟样本核酸的检测下限Fig.2 LOD of four nucleic acid detection methods for artificial contaminated samples
2.5欧标方法对市场猪肉样本中李斯特菌的检测结果 通过对纯培养的疑似单增李斯特菌菌落的鉴定,市场采集的50份猪肉样本中有13份样为单增李斯特菌阳性,分离率为26%。
2.6核酸检测方法对猪肉样本增菌液培养物的检测结果 应用传统PCR、Real-time PCR、LAMP和MCDA方法对50份猪肉样本的二次增菌培养物核酸的检测结果如表3所示。传统PCR方法检测到11份猪肉样本单增李斯特菌核酸阳性,Real-time PCR只检测到4份单增李斯特菌阳性样本,LAMP检测到15份样本为单增李斯特菌阳性,MCDA方法检测到18份样本为单增李斯特菌阳性。其中MCDA方法检测到的18份阳性样本包含了其它3种方法和传统分离培养方法得到的阳性样本。
随后将MCDA方法检测阳性而传统分离培养方法检测阴性的5份猪肉样本的Fraser增菌液,使用另一种李斯特菌选择培养基-阿洛糖增菌培养基[10],进行再次增菌分离培养。吸取1 mL Fraser增菌液到5 mL阿洛糖增菌液,35 ℃、220 r/min增菌30 h,涂布CM1080选择培养基,37 ℃培养24 h,挑取疑似菌落进行鉴定,结果5份样本均分离到单增李斯特菌。因此,对50份猪肉样本的检测,传统分离培养方法的单增李斯特菌阳性率为26%,MCDA方法的阳性率为36%。
3 讨 论
单增李斯特菌是一种重要的食源性细菌,广泛分布于自然界,常见于生冷食品。食用被单增李斯特菌污染的食品可导致严重的李斯特菌病,单增李斯特菌的发病率虽低但病死率高达20%~30%。因此,样本中单增李斯特菌的快速检测对于病例确诊和及时治疗很重要。
以往单增李斯特菌核酸检测的靶基因通常是hlyA、actA、prfA等[11-12],但有文献[8,13]报道这些基因不仅存在于单增李斯特菌,也在其他李斯特菌属细菌(如伊氏李斯特菌、希尔李斯特菌)中存在。目前lmo0733是被认为是单增李斯特菌特有的基因,因此本研究对以该基因为靶标的核酸检测方法进行了比较。
单增李斯特菌常用的核酸检测方法主要包括传统PCR、Real-time PCR,以及恒温扩增为基础的LAMP方法、MCDA方法。传统PCR方法是实验室最常用的核酸扩增检测方法,但扩增产物需经凝胶电泳成像才能读取扩增结果,整个过程耗时约2~3 h;Real-time PCR是在传统PCR的基础上,增加荧光基团和荧光检测装置,从而实现实时检测扩增结果,不需要凝胶电泳成像,但需要精密的仪器设备,价格较为昂贵;恒温扩增方法能够在恒温条件下1 h内能完成核酸的扩增,对仪器的要求较低,扩增结果可通过可视化等多种方式判读。
表3 分离培养方法和四种核酸检测方法对50份猪肉样本单增李斯特菌分离结果
Tab.3Listeriamonocytogenesisolation results of culture method and four nucleic acid methods on 50 pork samples
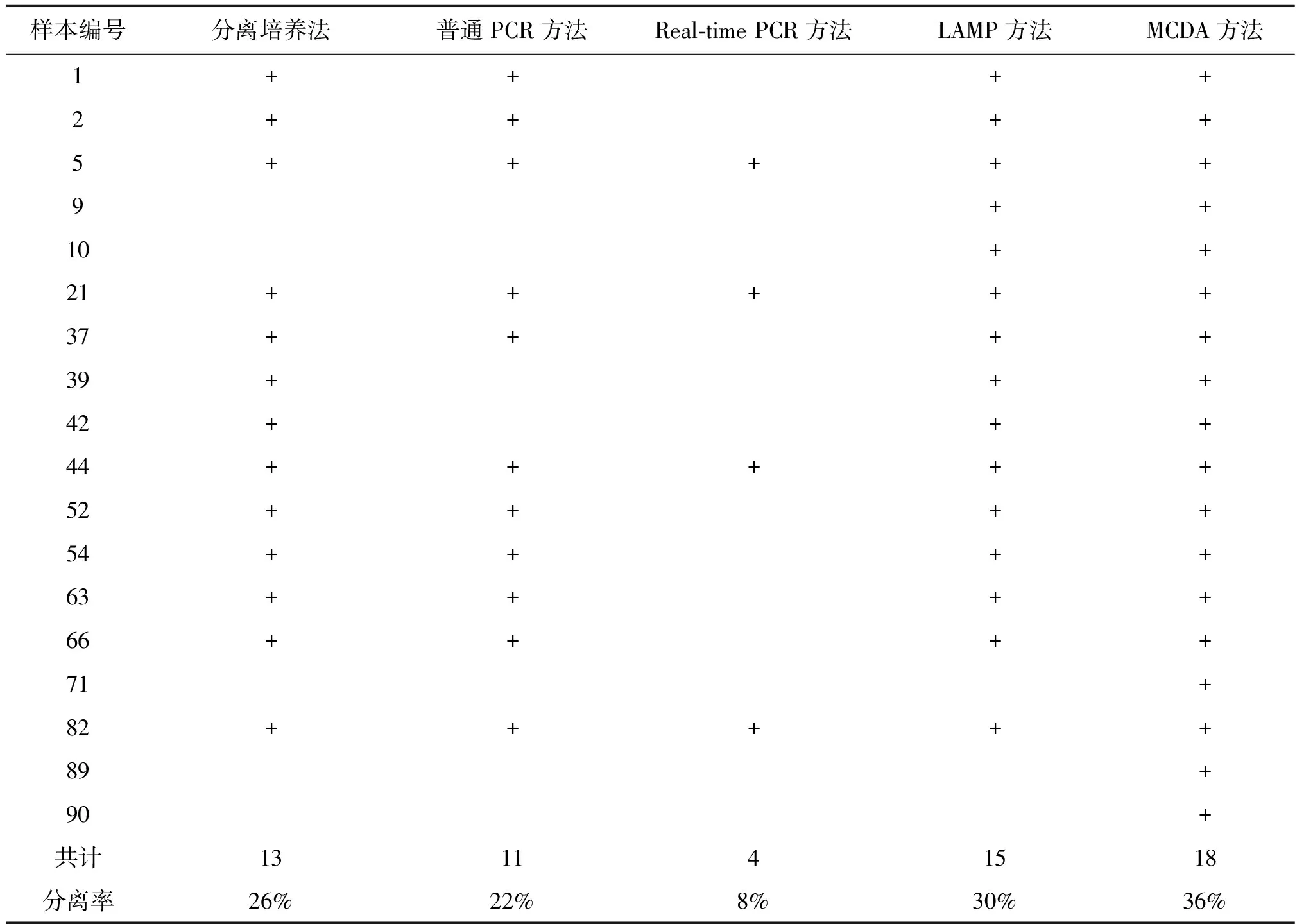
样本编号分离培养法普通PCR方法Real-time PCR方法LAMP方法MCDA方法1++++2++++5+++++9++10++21+++++37++++39+++42+++44+++++52++++54++++63++++66++++71+82+++++89+90+共计131141518分离率26%22%8%30%36%
注:传统分离培养方法和四种分子诊断方法检测均为阴性样未列出本;+:表示阳性结果。
本文应用的传统PCR、Real-time PCR、LAMP和MCDA 4种核酸检测方法均能准确检测单增李斯特菌。传统PCR方法对50份生肉样本的分离,核酸检测阳性的样本为11份,而传统分离培养方法结果为阳性的有13份,可能由于传统PCR方法检测灵敏度有限,增菌液中核酸量小于阈值导致假阴性结果;Real-time PCR方法对模拟样本的检测下限为5×102CFU/反应,但实际样本中只检测到4份,可能与水煮法制备核酸法导致二次增菌液培养物中某些物质未能去除,从而影响Real-time PCR方法的核酸扩增效率或荧光的检测有关;LAMP方法和MCDA方法在模拟样本和实际样本检测中都有很好的特异性和灵敏性,LAMP方法检测到15份单增李斯特菌阳性生肉样本,而MCDA方法检测到18份单增李斯特菌阳性样本,提示生肉样本的检测中MCDA方法比LAMP方法更为灵敏。
本研究证实多交叉置换扩增(MCDA)方法比其它3种核酸检测方法更为快速、灵敏且实用性强,在单增李斯特菌监测和单增李斯特菌疫情暴发时,应用MCDA方法可对增菌液进行快速筛检,减少分离培养及鉴定的时间(通常为32~72 h),节省人力和成本。因此,MCDA方法可作为快速筛检的分子诊断方法应用于肉制品样本中单增李斯特菌的检测。
利益冲突:无
