高内涵技术检测H2O2诱导心肌细胞凋亡实验方法的探讨
2019-02-27保和
, ,保和,
1 材料与方法
1.1 实验材料 96孔白板、96孔黑板、20 μL枪头、200 μL枪头、1 mL枪头、5 mL枪头、加样槽、试管架、棉球、酒精灯、移液器、50 mL离心管。
1.2 实验试剂 磷酸缓冲盐溶液(PBS)、平衡盐溶液、双抗(PS)、血清(FBS)、DMEM/F12培养基(Gibcal)、过氧化氢(H2O2)、Cell Counting Kit-8(日本同仁)、Mito Tracker4®Deep Red(Invitrogen,Eugene,USA,22624)、Hoechst33342(Invitrogen,Eugene,USA,H1399)、FITC Annexin V Apoptosis Detection Kit I(BD Pharmingen,556547)
1.3 实验仪器 FlexStation 3(MD,美国),高内涵仪器(PE,美国),Opretta system。
1.4 实验方法
1.4.1 细胞培养 将提取成功且纯度达90%的原代乳鼠心肌细胞接种于96孔白色培养板和96孔黑色培养板,接种细胞密度为3×104个/孔,每孔加入含5%胎牛血清的DMEM/F12培养基100 μL,置于CO2孵箱正常培养72 h后用于实验。
1.4.2 分组及造模 将H2O2原液用PBS配制成10 μmol/L的母液,再用DMEM/F12 培养基将母液配制成不同浓度溶液并加入白色细胞培养板,每孔100 μL。浓度分组,A组:DMEM/F12(control);B组:100 μmol/L;C组:200 μmol/L;D组:300 μmol/L;E组:400 μmol/L;F组:500 μmol/L;G组:600 μmol/L;H组:700 μmol/L;I组:800 μmol/L;J组:1 000 μmol/L;每组4个复孔,造模2 h后吸去H2O2待测。
1.4.3 细胞计数试剂盒-8(CCK-8)检测造模后的心肌细胞活力 按照说明书使用CCK-8试剂盒,按1∶10比例稀释CCK-8试剂,避光,每孔100 μL加入细胞,孵箱培养2 h后用酶标仪检测吸光度值(OD值),计算细胞活力。
1.4.4 凋亡试剂盒检测造模后的心肌细胞凋亡情况 使用黑色培养板,选取适当的H2O2浓度对培养3 d的心肌细胞进行造模2 h后染色。荧光染料分别为:Hoechst33342(Invitrogen,Eugene,USA,H1399),1 μg/mL;Mito Tracker®Deep Red(Invitrogen,Eugene,USA,22624),0.1 μmol/L;FITC Annexin V(BD Pharmingen,51-65874X),1 μg/mL;Propidium Iodide Staining Solution(BD Pharmingen,51-66211E),1 μg/mL;用DMEM/F12配制后,分别在每孔加50 μL,在37 ℃环境下孵育20 min。PBS洗3遍,每孔150 μL,每次5 min。最后加100 μL Annexin V Binding Buffer (BD Pharmingen,51-66121E)进行高内涵扫描。所有操作均在避光条件下进行。
设置合适的曝光时间和读板高度,设定阳性细胞大小和荧光强度阈值,选取要读板的孔和视野(保证各组实验以及重复实验选取的视野数目一致),进行扫板,得出细胞总数、死细胞数目、早期凋亡比例、晚期凋亡比例和染料荧光强度。
满足广大农村地区读者的阅读需求是新闻出版公共服务体系的重点之一。到2017年,我国已建成农家书屋60万个,覆盖了全国具备基本条件的行政村,建成数字农家书屋3.5万个,城乡阅报栏(屏)10万个,形成了形式多样、内容丰富的立体传播体系。
1.5 统计学处理 使用SPSS分析并处理数据,GraphPad Prism 5软件绘制图表并计算半数有效浓度(EC50)。
2 结 果
2.1 心肌细胞活性 不同浓度H2O2诱导凋亡后心肌细胞活力见图1。使用GraphPad Prism 5软件计算EC50为320 μmol/L,详见图2。选取EC50前后各一个H2O2浓度及EC50浓度使用高内涵技术进行进一步检测,其中EC50浓度选取配制容易且可精确配制的350 μmol/L浓度。此时选取其近似浓度300 μmol/L、350 μmol/L、400 μmol/L设定高中低剂量进行高内涵检测。
2.2 心肌活细胞个数 350 μmol/L、400 μmol/L浓度的H2O2处理后心肌细胞个数均减少(P<0.05或P<0.01),详见图3。
2.3 心肌细胞细胞核面积 350 μmol/L、400 μmol/L浓度的H2O2处理后心肌细胞细胞核面积均显著缩小(P<0.01),见图4。

各剂量组与control组比较,*P<0.01
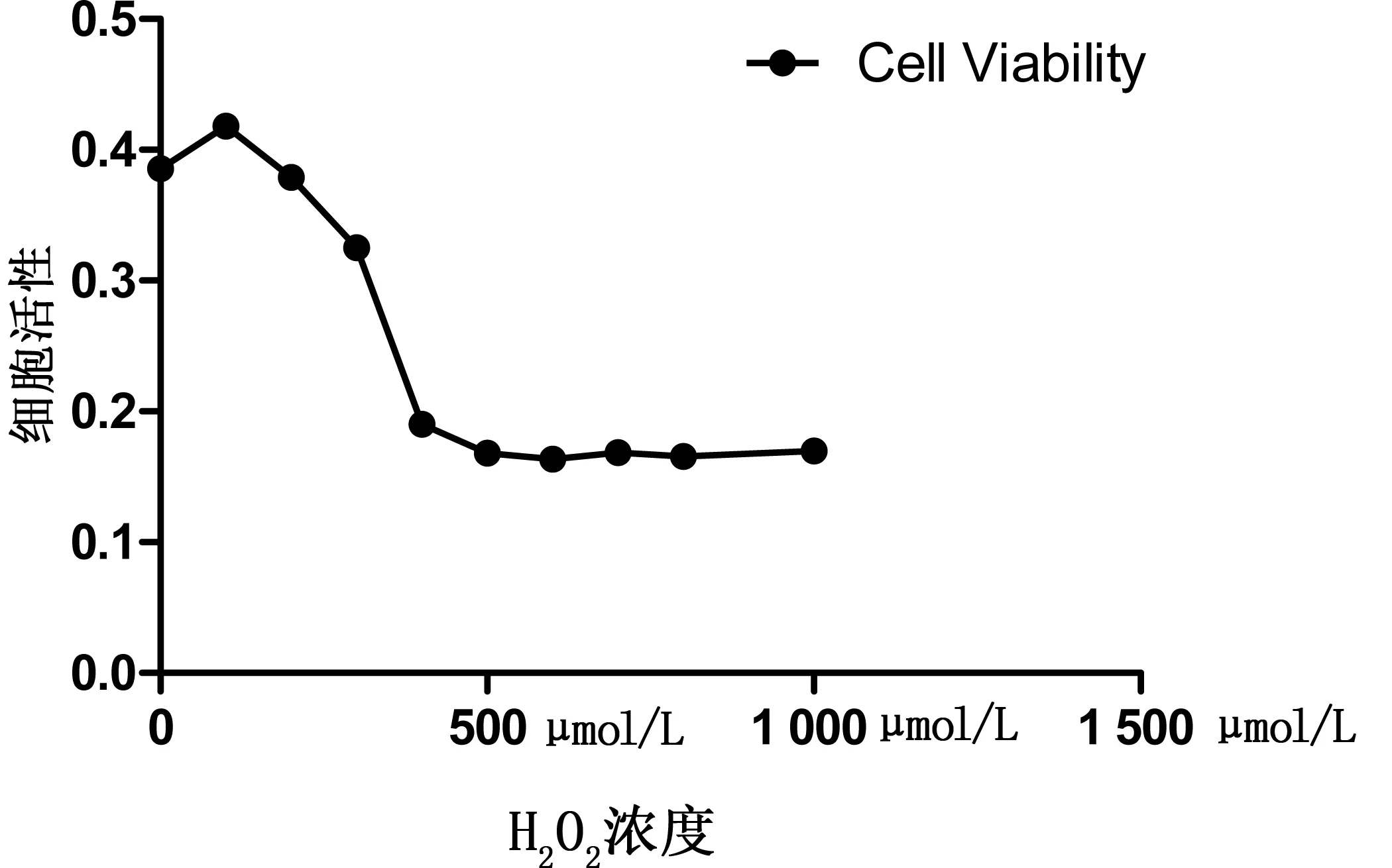
图2 细胞活性曲线图
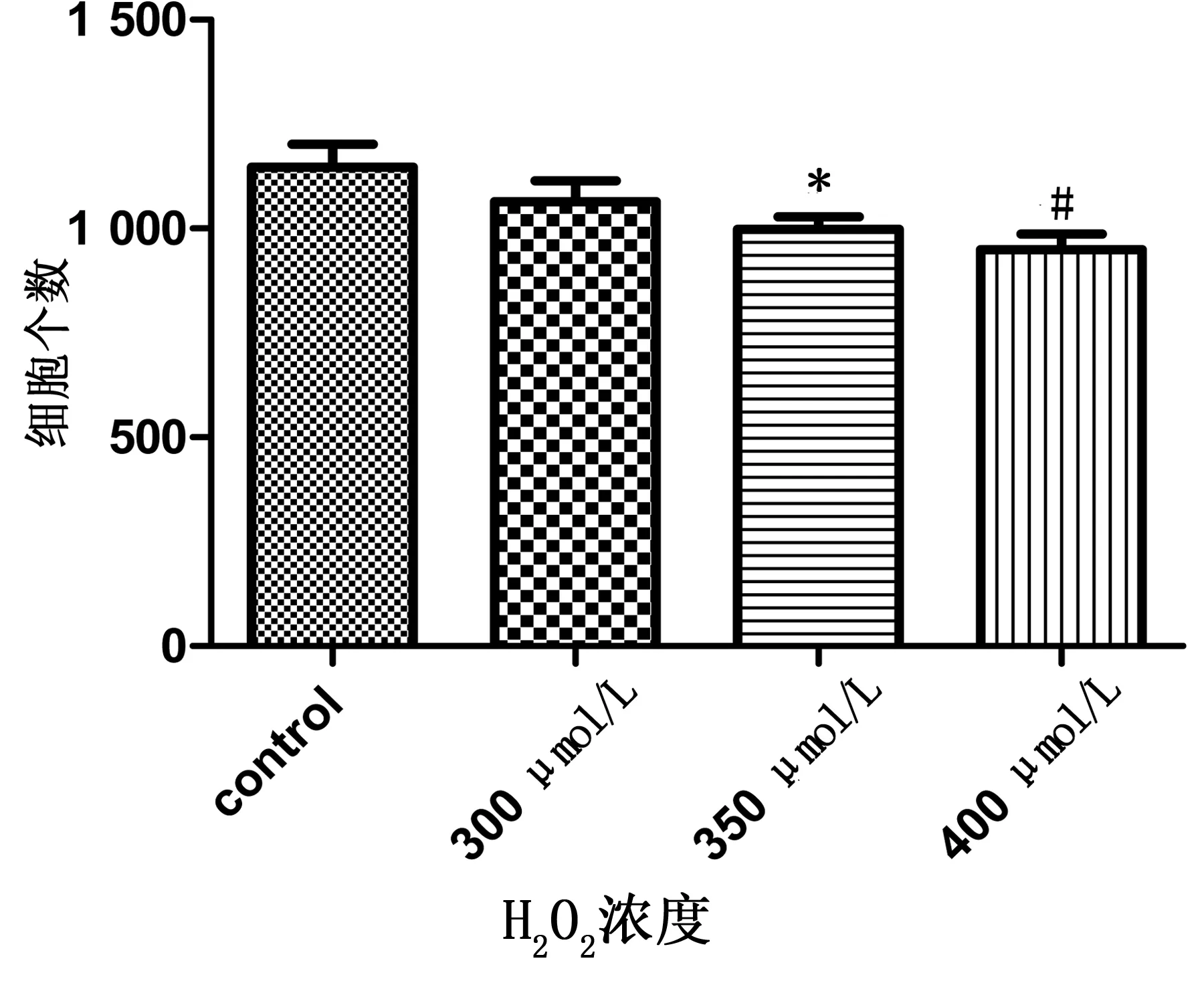
各剂量组与control组比较,*P<0.05;#P<0.01
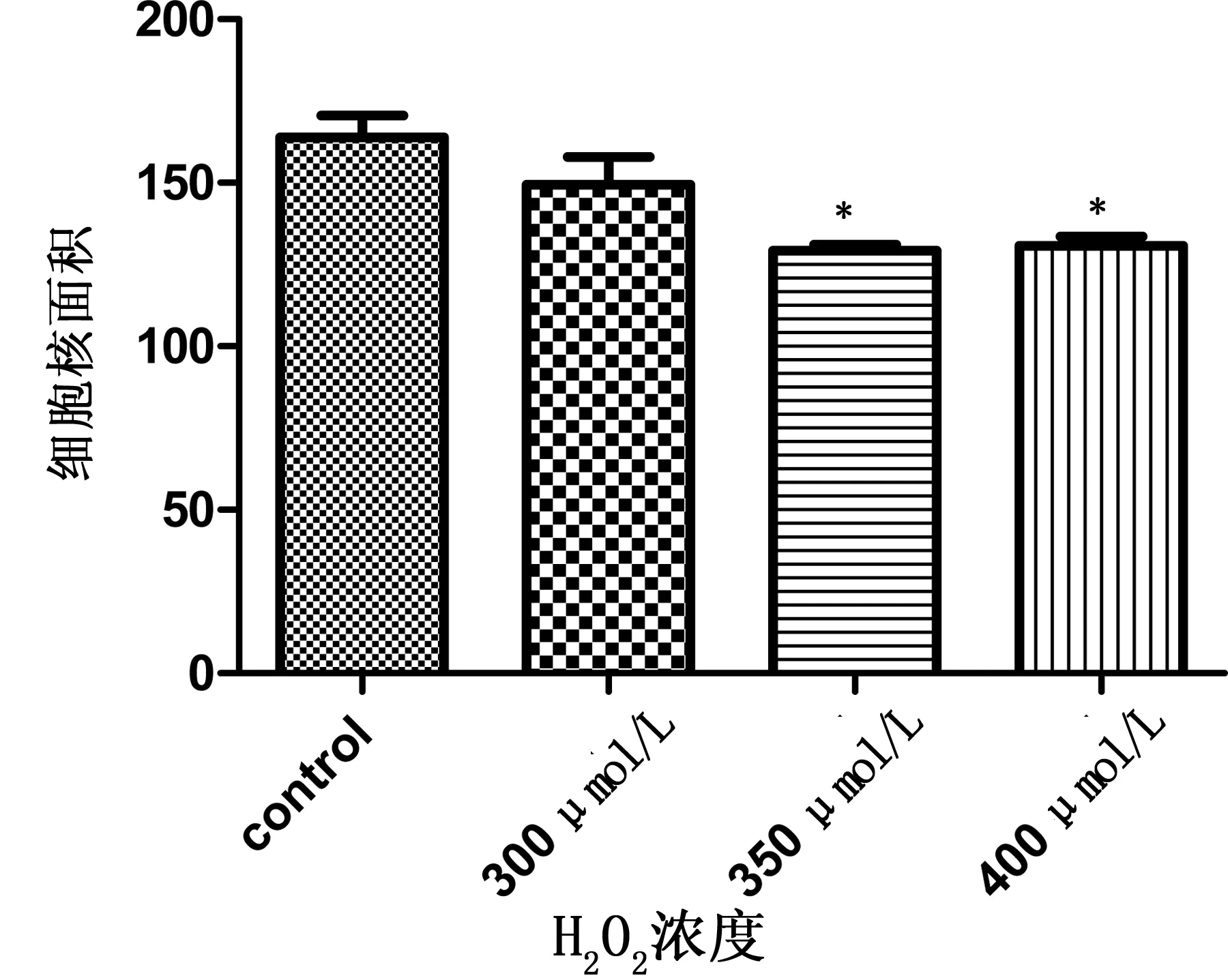
各剂量组与control组比较,*P<0.01
2.4 心肌细胞细胞质损伤情况 3个浓度的H2O2均对Mito Tracker染色的细胞质具有明显损伤(P<0.01)。详见图5。
2.5 心肌细胞凋亡细胞比例 300 μmol/L浓度的H2O2诱导细胞凋亡模型最理想,高内涵筛选计算早期凋亡细胞占61.4%,晚期凋亡细胞占38.2%。3个浓度的H2O2诱导早期凋亡细胞比例均明显增多(P<0.01)。详见图6。400 μmol/L浓度的H2O2诱导晚期凋亡细胞比例增多(P<0.05)。详见图7。
2.6 高内涵荧光显微成像情况 蓝色染色标记活细胞核,正常细胞核为圆形或椭圆形,荧光着色浅,而凋亡细胞的细胞核固缩,呈弱荧光反应;深红色染色为标记为线粒体的细胞质,与正常细胞相比,凋亡细胞线粒体排列散乱,形态异常,荧光强度改变。绿色荧光强度可显示早期凋亡细胞,黄色荧光强度可显示晚期凋亡细胞,荧光强度均较对照组强且数量多。详见图8。
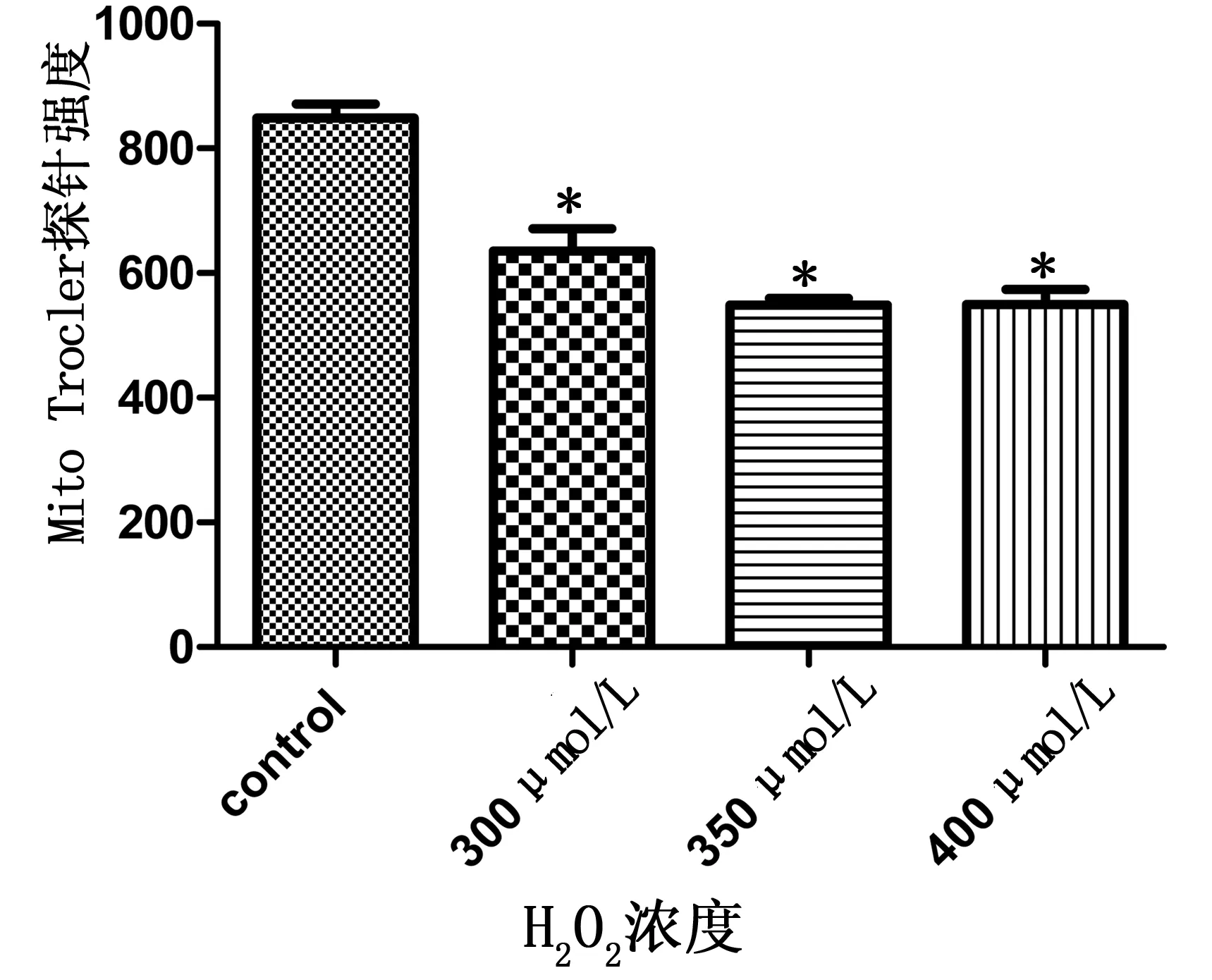
各剂量组与control组比较,*P<0.01
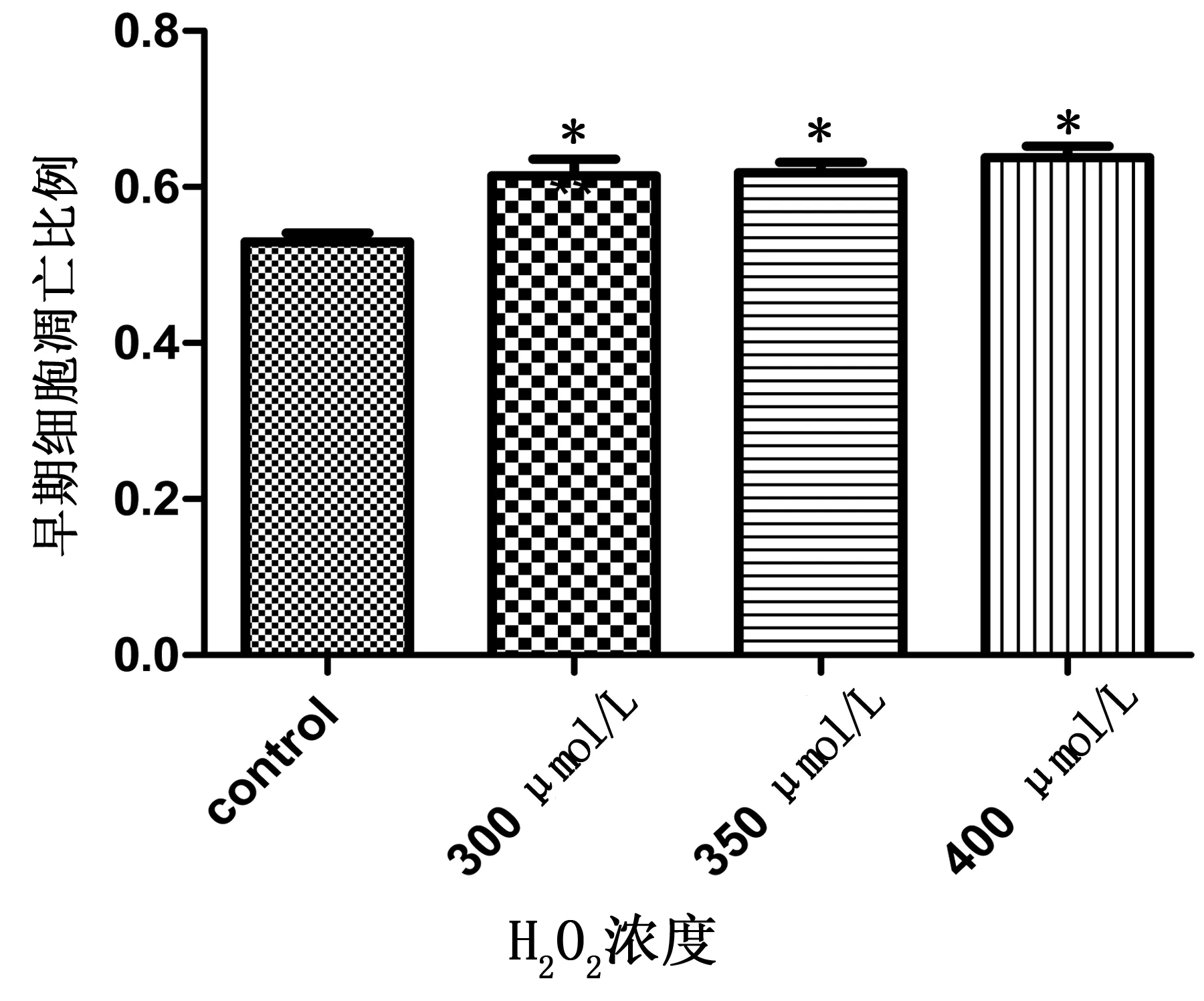
各剂量组与control组比较,*P<0.01
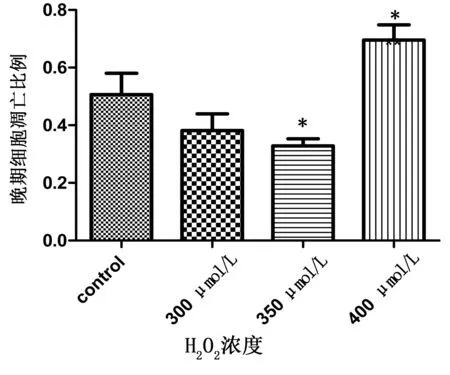
各剂量组与control组比较,*P<0.05

图8 高内涵荧光显微成像图片
3 讨 论
3.1 H2O2诱导心肌细胞凋亡造模分析 CCK-8检测结果表明200 μmol/L及以上浓度的H2O2即可抑制心肌细胞活性,诱导其凋亡,且400 μmol/L及以上剂量可极其明显的抑制细胞活性,但CCK-8检测方法不能直观细胞存活情况及损伤程度,不能计算细胞个数、凋亡百分比等量化指标。
分析给药后的细胞进行染色后扫板得出数据及显微成像图片,Hoechst染色为蓝色,Mito Tracker染色为深红色,绿色染色为FITC标记的膜联素V,黄色染色为PI标记的细胞DNA。Hoechst可穿透细胞膜标记细胞核,显示活细胞;Mito Tracker可标记线粒体,线粒体是较大的细胞器,故可显示细胞质;膜联素V与磷脂酰丝氨酸有高度亲和力,可与细胞发生凋亡后翻向质膜外侧的磷脂酰丝氨酸结合使其显色,可指示早期凋亡和坏死细胞;PI只能标记核破裂后溢出的DNA,可指示晚期凋亡和坏死细胞。4项指标综合分析即可判断细胞损伤程度和计算早期凋亡及晚期凋亡细胞比例。分析显示3种浓度剂量的H2O2对心肌细胞均有不同程度的损伤,均可诱导心肌细胞凋亡,且随着浓度剂量的升高,线粒体结构改变明显,细胞数减少,核面积减小,早期凋亡及晚期凋亡的心肌细胞均增多,检测指标趋势均较为明显,且差异有统计学意义(P<0.05)。300 μmol/L浓度的H2O2对原代心肌细胞损伤明显,早期凋亡细胞占61.4%,晚期凋亡细胞占38.2%。由此可知,此剂量可造成细胞明显的早期凋亡(P<0.01),但尚不足以导致大量细胞晚期凋亡以至坏死,损伤尚可逆,故可选取300 μmol/L剂量用于诱导心肌细胞凋亡。
3.2 高内涵检测细胞凋亡可行性分析 本实验研究使用FITC和PI双标记细胞凋亡试剂盒对心肌细胞染色,此试剂盒多用于免疫荧光染色检测细胞凋亡,应用较为成熟,但使用高内涵检测方法并不多见。Annexin V是一种检测细胞凋亡的灵敏指标,因细胞发生凋亡或坏死时,其由质膜内侧翻向外侧,且此过程可早于DNA碎片发生,因此,FITC标记Annexin V结合Hoechst染色可显示早期凋亡。PI可标记DNA碎片,结合Hoechst染色可显示晚期凋亡[1]。本研究使用该试剂盒加用Hoechst和Mito Tracker染料进行染色,结果比CCK-8检测方法对比数据更加丰富,使用高内涵仪器进行检测可直观细胞形态、细胞器状态,对细胞的各项指标进行计算,分析数据快速,准确性高。非常适合高通量、多指标检测,且活细胞实时检测数据更接近在体状态,可直观反映实时细胞情况。也有研究使用其他凋亡检测试剂盒,对细胞染色后进行高内涵检测,结果有效且可信度高[2]。
3.3 局限和展望 有研究表明高内涵分析方法最适合于贴壁细胞的数据采集和筛选分析,尤其在高通量分析多样本且细胞数较少时优势更为明显,其可从细胞群体中的单个细胞的反应获取大量信息,不仅仅是一个孔板中所有细胞的平均反应[3]。可以在保持细胞结构和功能完整的条件下,同时检测细胞生长、分化、凋亡、代谢途径等多个环节,涉及靶点广泛。其分析贴壁细胞时,保留所有的形态特征和目的靶标,用较少的细胞得到更多的数据结果,提高通量的同时节约了时间和试剂,分析速度比样品逐个处理快达数百倍[4]。高内涵基于图像的分析还可以对结果进行原始图像的追述,如本研究中可见FITC绿色荧光标记的Annexin V,可显示早期凋亡细胞,在获取信息方面更加多样化和可视化。但高内涵分析方法也存在一定的局限性,仪器设备购置费用高昂,维修烦琐,缺乏标准的细胞凋亡等数据的处理和分析方法,染料颜色不够丰富以致较容易重叠,可能造成实验研究中应用并不广泛。随着高内涵技术的发展,或可开拓新技术,解决现有问题,提高利用率。
本研究为高内涵技术检测心肌细胞凋亡提供了方法和数据基础,可为今后的细胞凋亡检测提供参考。
