特发性心房颤动病人血清胱抑素C与超敏C反应蛋白的表达及临床意义
2019-02-27,,,,,
,,,,,
心房颤动(atrial fibrillation,AF)被认为是全球最大的公共卫生问题之一,具有一系列危害性,表现为病人的生活质量降低,死亡风险增加。AF作为临床上较为多见的持续性心律失常,其中特发性AF占1.6%~11.4%[1]。特发性AF是指排除高血压、糖尿病、冠状动脉粥样硬化性心脏病、甲状腺功能亢进和肺源性心脏病等器质性心肺疾病而发生的AF。AF病人即使通过药物或电复律等手段复律后,窦性心律也很难长期维持,主要是由于心房发生电重构及结构重构,但有关心房重构的分子机制仍不明确。炎症在AF的发生、发展中发挥重要作用,但其与AF的内在联系及作用机制尚未完全阐明,仍需进一步探讨[2-4]。C反应蛋白(C-reactive protein,CRP)是临床上经常检测的指标之一,是炎症急性期反应因子。已有多项文献报道,AF病人CRP表达水平明显提高,CRP表达水平的高低还能够预测AF发生的远期风险[3]。血清胱抑素C(cystatin C,CysC)为半胱氨酸蛋白酶抑制剂,因其在肾小球滤过膜能自由滤过,且肾小管自身不分泌,被认为是理想的肾功能标记物。同时,CysC还参与调节细胞代谢、凋亡和炎症反应。有研究证实其与脑卒中、冠心病及心力衰竭病人的心血管终点事件及死亡有关[5]。但CysC水平与特发性AF的相关性研究报道甚少。故本研究观察在不伴慢性肾功能不全的特发性AF病人中血清CysC及超敏C反应蛋白(hs-CRP)的水平,探讨两者与AF发病的相关性及临床意义。
1 资料与方法
1.1 临床资料 选择2016年1月—2017年4月陕西省人民医院门诊及住院的AF病人78例,分为阵发性AF组(36例)和持续性AF组(42例)。选择同期无AF发作史的阵发性室上性心动过速病人20例为对照组。阵发性AF指7 d内终止的AF,可以是自行终止,也可以是经过药物或电复律终止;持续性AF指7 d内不能终止的AF[6]。要求入组病人年龄<60岁,无高血压病、心脏瓣膜病、冠状动脉粥样硬化性心脏病、心功能不全、慢性肺源性心脏病、心肌疾病等心肺疾病,无甲状腺功能疾病及洋地黄等药物中毒。入院前均停用抗心律失常药物至少5个半衰期。同时排除有肝肾功能异常者[肾小球滤过率(eGFR)<60 mL/(min·1.73 m2)]、孕妇、哺乳期妇女、感染、肿瘤、自身免疫及代谢性疾病等。
1.2 方法 收集病人临床资料,如年龄、性别、体质指数等。确定入组次日清晨采集静脉血6 mL(至少空腹8 h),静置1 h后离心10 min(2 500 r/min),收集上层血清,-80 ℃保存,以备后期使用。酶联免疫吸附实验(ELISA)测定hs-CRP、CysC浓度,根据标准流程操作,符合实验室质控标准。并分析hs-CRP与CysC的相关性。
2 结 果
2.1 3组临床资料比较 3组病人年龄、性别、体质指数、吸烟、病程、左心室后壁厚度、左心室舒张末内径、左心室射血分数和室间隔厚度等方面比较,差异均无统计学意义(P>0.05)。阵发性AF组与持续性AF组左心房内径均大于对照组,且持续性AF组大于阵发性AF组,差异均有统计学意义。详见表1。
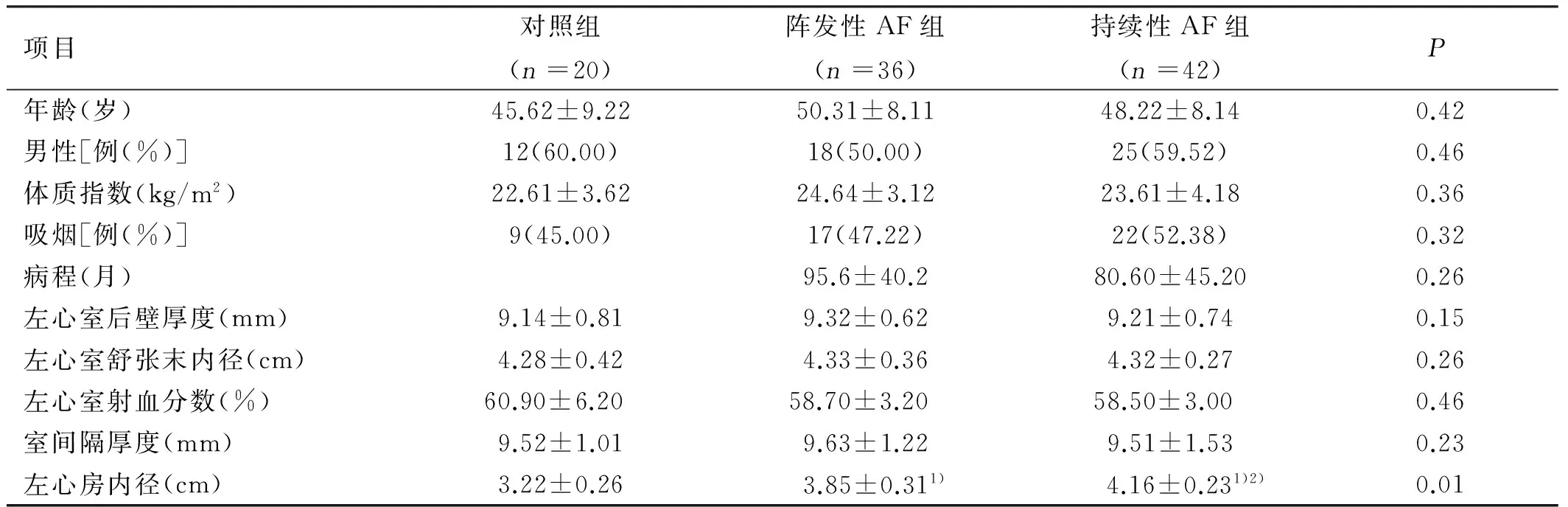
表1 3组临床资料比较
与对照组比较,1)P<0.05;与阵发性AF组比较,2)P<0.05
2.2 3组CysC及hs-CRP浓度比较 持续性AF组和阵发性AF组血清CysC和hs-CRP 浓度均高于对照组,且持续性AF组血清CysC和hs-CRP浓度均高于阵发性AF组,差异均有统计学意义(P<0.05)。详见表2。
表2 3组CysC、hs-CRP浓度比较(±s) mg/L
与对照组比较,1)P<0.05;与阵发性AF组比较,2)P<0.05
2.3 AF病人CysC与hs-CRP的相关性 Pearson相关分析结果显示,hs-CRP与CysC呈正相关(r=0.755,P<0.001)。详见图1。
3 讨 论
AF是临床上最为常见的心律失常之一,发病率占总人口的1%~2%,预计到2050 年,全球AF病人的总数将增加2.5倍[7],严重影响病人的生活质量。虽然近年来对AF的基础和临床研究取得了一些进步,但因其发病机制多样化,目前尚未彻底阐明。炎症作为心血管疾病的主要危险因素,在AF的发病中逐渐显示出其重要性。有研究表明,对特发性AF病人心肌组织进行活检,可发现心肌存在广泛炎症浸润、细胞坏死及心肌纤维化等一系列变化[3]。CRP主要由肝脏合成,参与全身的炎症反应,是临床上最常见的炎症反应敏感指标。CRP可以增加心房的氧化损伤,并导致心房的结构改变。观察CRP在各种类型AF病人中表达水平的变化,对认识炎症与AF的关系具有较大的临床价值。本研究发现,阵发性AF组与持续性AF组hs-CRP浓度均明显升高,且持续性AF组高于阵发性AF组,与既往研究结果一致[2,8]。大规模研究提示,AF病人CRP表达水平明显增高,而且基线CRP表达水平的高低还能够预测非AF人群远期发生AF的风险。通过对5 806例入组对象CRP的基线水平进行测量,随访(6.9±1.6)年,结果发现基线CRP水平越高,非AF人群远期发生AF的概率越高[9]。随着CRP水平的升高,可能导致心肌细胞发生变性坏死,引起左房扩大、心肌纤维化,从而导致心房发生结构重构或电重构。说明CRP作为炎症指标,在AF的发展及预测等方面具有重要作用。
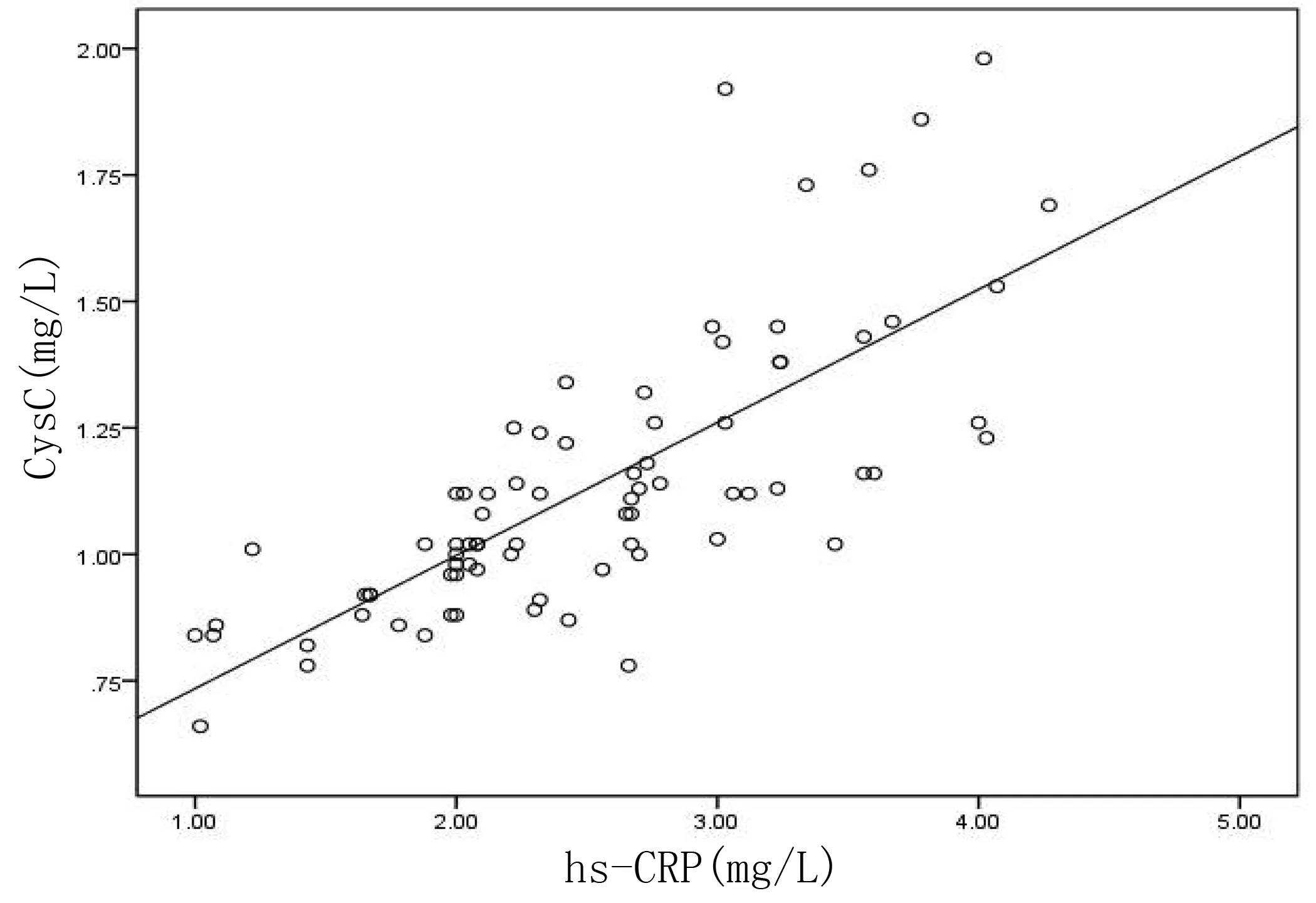
图1 AF病人血清hs-CRP与CysC的相关性
CysC是一种半胱氨酸蛋白酶抑制剂,由122个氨基酸残基组成,体内有核细胞均可以持续而稳定地产生。CysC主要作用是参与细胞外基质的重塑和降解,因其能自由通过肾小球,在近曲小管被完全重吸收并分解代谢,且不被肾小管上皮细胞分泌,被认为是一种特异性高、准确性好的用来评价肾脏功能的新指标,而且较肌酐清除率的敏感性更高[10]。近年来有研究发现CysC与脑卒中、冠心病及心力衰竭病人的心血管终点事件及死亡有关[5]。但CysC与AF的关系存在争议,可能与入选人群多合并冠心病、高血压、心力衰竭或其他类型心律失常有关[11-13]。
本研究选择特发性AF病人为研究对象,结果显示病人血清CysC浓度明显升高,且持续性AF病人高于阵发性AF病人,并与炎症因子hs-CRP 存在相关性。CysC在AF病人中表达水平升高,可能与以下几个因素有关:①肾素-血管紧张素-醛固酮系统(RASS)激活引起心房重塑和AF的发生,同时可引起早期肾功能损伤,血清CysC水平升高[14];②CysC能够改变心肌细胞外基质蛋白酶的活性,引起细胞外基质的重塑,参与心房纤维化的进程[15];③炎症在AF的发展中起着重要的作用,可能与CysC作为炎症因子参与机体炎症反应有关[16]。
本研究结果显示,特发性AF病人中,CysC水平明显升高,且与hs-CRP呈明显相关性。CysC水平可能是预测AF发生的一个指标。
