丝素蛋白/羟基磷灰石/聚多巴胺/BMP-2多孔支架的构建及促进BMSCs成骨分化的研究
2019-02-26张云庆邬丹莲
刘 勇,张云庆,邬丹莲
丝素蛋白(silk fibroin,SF)复合羟基磷灰石(hydroxyapatite,HA)多孔支架具有良好的生物学相容性、力学性能和骨传导能力,但骨诱导能力不足[1]。骨形态发生蛋白(bone morphogenetic protein,BMP)-2是目前已知最强的成骨活性因子之一,能够显著提高材料的成骨能力[2],但制备BMP-2复合材料时传统物理吸附或包裹方法存在结合率低、易早期爆释的现象,难以满足骨形成过程中的持续需求[3-4]。近年来有学者在材料表面构建聚多巴胺(poly dopamine,PDA)涂层,不仅提高了材料的生物相容性,还能高效结合并缓释生长因子,为制备具有生物活性的组织工程骨提供了途径[5]。本研究采用冷冻干燥法制备SF/HA 多孔支架,在其表面形成PDA 涂层,然后接枝BMP-2,构建类似天然骨成分、结构和生理功能的SF/HA/PDA/BMP-2 支架,评估支架的表面特征、理化性质及其对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)体外成骨分化能力的影响,探讨支架在组织工程骨领域应用的可行性,为临床新型人工骨修复骨缺损的研发提供可供选择的支架材料。
1 材料与方法
1.1 主要材料和仪器
BMP-2(上海瑞邦生物科技有限公司),生蚕丝(江苏如东新丝路有限公司),HA、无水LiBr、无水Na2CO3(上海阿拉丁试剂有限公司),透析袋、聚乙二醇(上海Biosharp 有限公司),碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒(上海Yeasen有限公司)。DMEM细胞培养基、胎牛血清(Gibco 公司,美国),CCK-8 试剂盒(Dojindo 同仁化学公司,日本),成骨诱导培养基、BMSCs、茜素红染液、细胞荧光染液荧光素双醋酸脂(fluorescein diacetate,FDA)和 碘 化 吡 啶(propidium iodide,PI)均购自美国Sigma公司。
主要仪器包括水浴锅(常州国华电器有限公司),细胞培养箱(Thermo 公司,美国),临界点干燥仪(Leica 公司,德国),扫描电镜(scanning electron microscope,SEM,Hitach 公司,日本),水接触角测量仪(Data Physics 公司,德国),酶标仪器(Bio-Red公司,美国),共聚焦显微镜(Leica公司,德国)。
1.2 支架制备方法
1.2.1 SF 溶液制备 取适量生蚕丝置于0.02 mol/L Na2CO3中脱胶,烘干后放入9.3 mol/L LiBr 溶液中,搅拌至完全溶解,经透析、浓缩后得到质量浓度6%的SF溶液,将其置于4℃冰箱中保存备用。
1.2.2 SF/HA 混悬溶液制备 将2 g HA 粉末加入10 mL PBS(0.001 M,pH=6.8)溶液中,采用超声震荡法制备HA 混悬液,质量浓度为20%(W/V)。按照质量比(1∶4)将SF 溶液与HA 混悬液混合,超声震荡3 min,制成均匀的SF/HA混合溶液。
1.2.3 SF/HA/PDA/BMP-2 支架制备及分组 取100 μL 适量SF/HA 混合液加入模具中,迅速置于液氮中冷冻,冻干过夜,甲醇浸泡30 min,再次冻干后制得SF/HA 多孔支架。将SF/HA 支架置入PDA 溶液中(2 mg/mL,pH=8.5),慢速(50 r/min)震荡4 h,双蒸水洗3 次,制得SF/HA/PDA 支架。将制得的SF/HA/PDA 支架置入BMP-2 溶液中(2 mg/mL,pH=8.5),慢速(50 r/min)震荡4 h,双蒸水洗3 次,最后制得SF/HA/PDA/BMP-2 支架。将制备好的支架分为SF/HA 支架组、SF/HA/PDA支架组和SF/HA/PDA/BMP-2支架组,以用于后续实验。
1.3 SF/HA/PDA/BMP-2 支 架 上BMP-2 释 放 量 的检测
采用ELASA法检测SF/HA/PDA/BMP-2支架制成后1 d、3 d、5 d、7 d、14 d、21 d、28 d 的BMP-2累积释放量。
1.4 支架表征和理化性质
应用水接触角测量仪检测各组支架表面亲水性变化,应用SEM观察支架表面形态。
1.5 BMSCs增殖检测
分别在3 组支架上进行细胞培养。将各组支架裁剪合适后铺于96孔板底部,胎牛血清培养基浸泡过夜,PBS 清洗2 次,每个支架加入含有1 ×104个BMSCs 的细胞培养基200 μL,置入37°C、5% CO2培养箱培养,分别于1、4、7 d 加入20 μL CCK-8 试剂,培养2 h,取100 μL 溶液移入新的96孔板中,酶标仪检测450 nm吸光度。
细胞SEM 成像:细胞培养7 d,去除培养液,4%多聚甲醛固定1 h,乙醇梯度脱水,临界点干燥后喷金处理,SEM观察细胞形态。
细胞荧光染色:细胞培养7 d,取出上清液,PBS清洗2次,每孔分别加入100 μL FDA(5 μg/mL)和100 μL P(I5 μg/ mL),于37°C、5% CO2培养箱培养15 min,PBS清洗,在共聚焦显微镜下观察细胞形态。
1.6 BMSCs成骨分化能力检测
1.6.1 ALP活性检测 细胞与3组支架共培养,14 d去除培养基,PBS清洗2次,加入Triton X-100细胞裂解液,向细胞裂解液中加入ALP 染色试剂盒中的pNPP底物,在405 nm处检测吸光度值。
1.6.2 茜素红染色光镜观察 细胞与3 组支架共培养,方法同1.6.1。培养14 d 去除培养基,加入4%多聚甲醛固定15 min,PBS清洗2次,再加入2%茜素红染液,室温下染色20 min,去除染液,PBS 清洗2次,光镜下观察。
1.7 统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,3组比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 支架表面特征、理化性质比较
SF/HA 支架、SF/HA/PDA 支架、SF/HA/PDA/BMP-2 支架接触角分别为(54.7 ± 4.8)°、(43.7 ±3.7)°、(32.3 ± 2.4)°,差异有统计学意义(F=180.526,P=0.001),提示在PDA 涂层及接枝BMP-2 后,支架的亲水性逐渐增加(图1)。SEM图像可见SF/HA 支架表面相对光滑,SF/HA/PDA支架表面有颗粒物形成,SF/HA/PDA/BMP-2支架表面颗粒物明显增多,说明PDA 增加了支架表面的粗糙度,而接枝BMP-2后,支架表面的粗糙度进一步增加(图2)。

图1 水接触角测量仪检测3组支架亲水性1A SF/HA支架1B SF/HA/PDA支架1C SF/HA/PDA/BMP-2支架

图2 3 组支架扫描电镜成像2A,2B SF/HA 支架2C,2D SF/HA/PDA 支架2E,2F SF/HA/PDA/BMP-2支架
2.2 SF/HA/PDA/BMP-2支架BMP-2释放情况
ELASA 法检测结果显示支架上BMP-2 制备后在1 d、3 d、5 d、7 d、14 d、21 d、28 d 累计释放量分别为4.8%、9.2%、13.5%、18.4%、25.7%、31.6%、38.7%,呈缓慢持续释放趋势(图3)。

图3 ELASA 法检测SF/HA/PDA/BMP-2 支架上BMP-2 累积释放量
2.3 支架上BMSCs增殖和成骨能力检测结果比较
2.3.1 BMSCs 增殖能力 电镜和荧光染色结果显示,SF/HA 支架上细胞数量稀少,形态呈多角形;PDA涂层后细胞数量增多,细胞铺展良好;进一步接枝BMP-2 后细胞数量明显增多,局部呈片状生长,细胞黏附和生长能力更好(图4)。
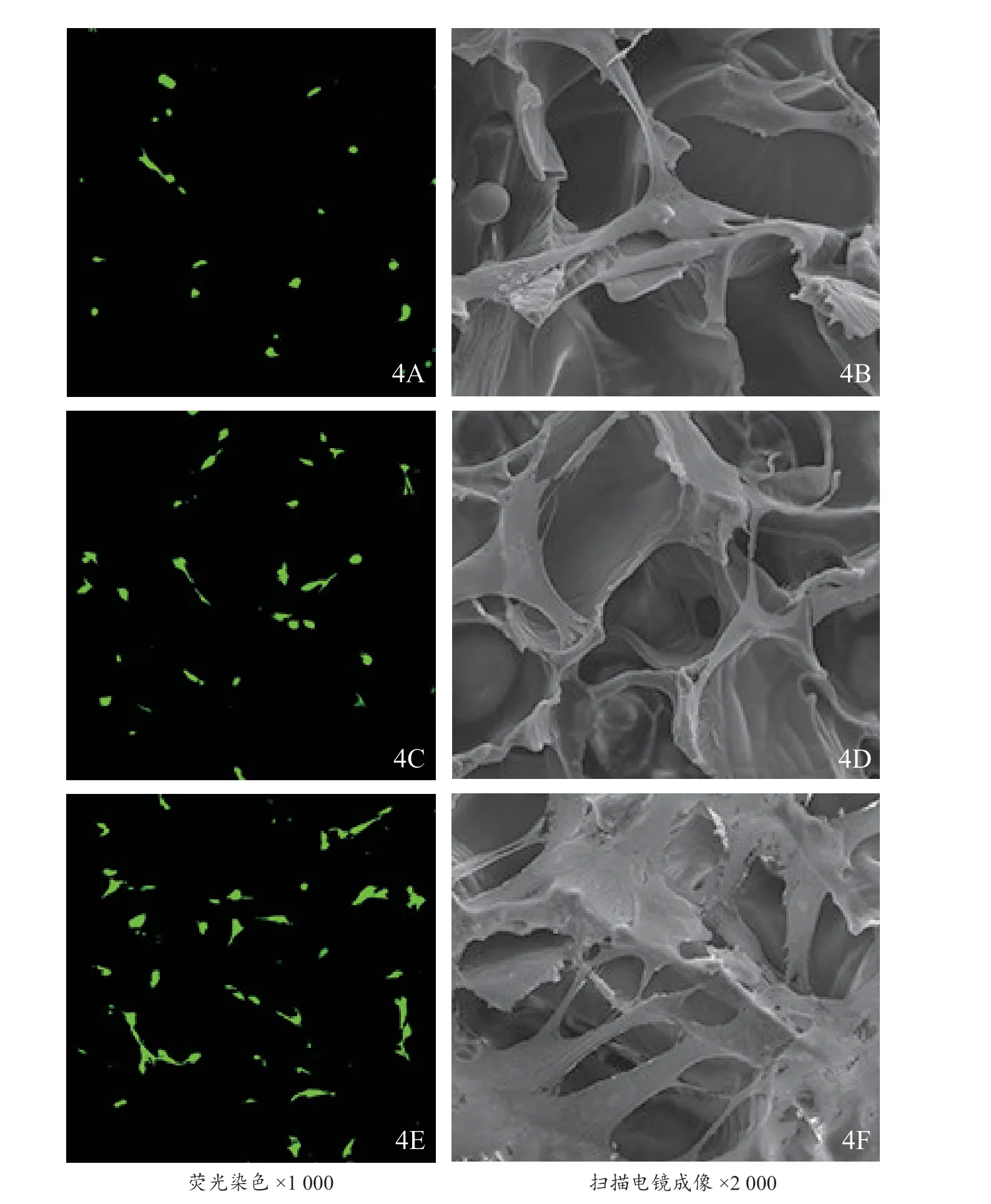
图4 3组支架上细胞荧光染色及扫描电镜成像4A,4B SF/HA支架4C,4D SF/HA/PDA支架4E,4F SF/HA/PDA/BMP-2支架
CCK-8检测结果显示3组支架上BMSCs随时间推移均呈增殖趋势,其在SF/HA/PDA/BMP-2支架上的增殖能力优于SF/HA/PDA 支架和SF/HA支架,差异有统计学意义(F=21.637,P= 0.002,图5)。
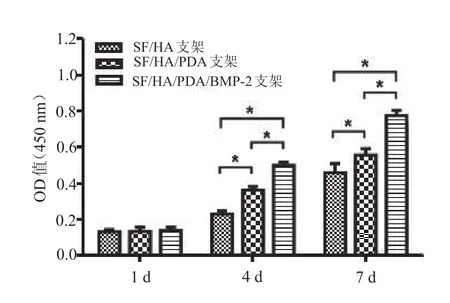
图5 CCK-8法检测细胞在3组支架上的增殖能力
2.3.2 BMSCs 成骨能力 与细胞共培养2 周后,检测3 组支架上BMSCs 的ALP 活性,结果显示SF/HA 支架、SF/HA/PDA 支架、SF/HA/PDA/BMP-2支架ALP水平分别为(2.9±0.4)、(3.4±0.7)、(6.8±0.8)U/mg,差异有统计学意义(F=232.215,P=0.001)。茜素红染色结果显示SF/HA 支架呈浅色红染,SF/HA/PDA 支架呈红色染色,SF/HA/PDA/BMP-2支架呈深色红染(图6)。

图6 3组支架茜素红染色6A SF/HA支架6B SF/HA/PDA支架6C SF/HA/PDA/BMP-2支架(×10)
3 讨论
3.1 SF/HA多孔支架在骨修复领域的应用
近年来陆续有研究以SF和HA为原料制成具有良好孔隙率和一定力学强度的复合支架,结构上与天然骨组织相类似[6-7]。由于生物学相容性良好,力学性能优异,SF/HA多孔支架在骨组织工程领域有着较大的应用潜力。Kweon 等[8]将SF/HA作为假体涂层植入兔胫骨内,结果显示涂层后假体具有促进骨再生的作用。SF/HA支架还可作为药物载体,负载并缓慢释放BMP-2,体外研究证实其可促进BMSCs向成骨细胞分化,植入大鼠体内后能加速大鼠颅骨缺损区的修复[9];SF/HA 支架还可通过负载BMSCs,促进兔桡骨缺损处的骨再生[10]。尽管目前基于SF/HA的骨组织工程支架材料尚处于基础研究阶段,但未来在骨科临床有着广阔的应用前景。
3.2 PDA涂层在SF/HA支架中的应用
单纯SF/HA 材料缺乏生物活性因子,导致其诱导成骨能力弱,在骨修复领域的应用受到限制。为提高其与生物活性因子的结合率,有学者通过PDA 涂层方法将生物活性因子接枝在高分子材料表面,明显提高了表面亲水性和粗糙度,生物学相容性得到改善[11];体内外研究结果亦证实该方法能有效促进细胞黏附和增殖[12-13],明显增强材料的成骨能力[14-15]。本研究结果表明,PDA涂层支架表面水接触角较单纯SF/HA 支架明显增加,颗粒物逐渐增多,PDA 涂层支架上细胞的黏附和增殖能力均优于单纯SF/HA 支架,与现有研究结果相似[16]。
3.3 SF/HA/PDA/BMP-2支架促进细胞增殖及成骨分化的作用
BMP-2 属于转化生长因子超家族成员,是一种疏水性酸性蛋白,具有强大的促成骨活性,能够诱导BMSCs向成骨细胞分化,在骨组织再生和修复领域应用广泛[17]。有研究者以SF/HA支架物理包裹BMP-2,体外实验结果显示该支架能够促进BMSCs向成骨细胞分化[18]。也有学者通过物理混合法制备壳聚糖/磷酸钙/BMP-2复合支架,结果表明支架能够促进兔胫骨缺损区的骨修复过程[19]。
尽管具有良好的骨再生作用,这些复合支架目前仍存在BMP-2 早期突释现象,难以满足骨骼再生过程中对BMP-2的持续需求[20]。本研究中采用PDA涂层方法接枝BMP-2,经过4周观察,支架上BMP-2 呈缓慢释放趋势,符合骨组织工程载药支架的需要。此外,本研究结果显示,SF/HA/PDA/BMP-2 支架上BMSCs 的黏附能力和增殖能力最佳,ALP活性及茜素红染色均优于其它两组,提示该支架上释放的BMP-2促进了细胞的黏附增殖和成骨分化。
相对于钛合金及天然高分子聚合物材料[21-22],SF/HA多孔支架具有与天然骨组织类似的成分和结构,通过PDA涂层可进一步提高SF/HA支架的生物学相容性,有效接枝并缓释BMP-2 后可发挥其骨传导和骨诱导作用。总之,本研究构建的SF/HA/PDA/BMP-2多孔支架具有良好的生物学相容性和成骨活性,在骨组织工程领域有着广阔的应用前景。
