隐丹参酮抗肺腺癌作用的研究
2019-02-25杨兴辉王海兵
杨兴辉 王海兵
肺癌是世界范围内癌症死亡的首要原因,我国肺癌死亡率也居各种恶性肿瘤死亡率的第一位[1]。肺腺癌是肺癌中最主要的病理类型,其发病率约占肺癌总数的30%~40%[2]。目前化疗仍是治疗肺腺癌的重要手段,但是对任何一种化疗药物来讲,均存在耐药性或抗药性以及毒性问题,即使是以细胞信号转导分子为靶点的化疗新药也存在抗药性问题。在克服耐药性和毒性方面有不少研究者倾向于天然抗肿瘤药物的成分及其衍生物。隐丹参酮(cryptotanshinone,CPT)是从唇形科植物丹参根部中提取的一个脂溶性二萜醌类化合物。研究表明CPT具有抗炎、抗血管生成、抗糖尿病和抗肿瘤的作用[3-6]。体外实验证实CPT主要通过诱导肿瘤细胞的凋亡而发挥抗肿瘤作用,如肝癌细胞HepG2和乳腺癌细胞MCF7[7]、黑色素瘤细胞A375[8]、卵巢癌细胞A2780[9]、慢性粒细胞白血病K562[10]等。然而关于CPT对人肺腺癌细胞的作用及其机制研究甚少。本实验采用人肺腺癌细胞株A549和PC-9,研究CPT对A549和PC-9细胞增殖、凋亡的影响及信号转导及转录激活因子 3(signal transducer and activator of transcription 3,STAT3)信号通路在其中的作用,为CPT的开发应用提供实验依据。
1 材料和方法
1.1 试剂和仪器 RPMI 1640(批号:2017082301)和高糖DMEM(批号:2017082302)细胞培养基购于杭州科易生物技术有限公司;0.25%胰蛋白酶(批号:1709120206)购于杭州吉诺生物医药技术有限公司;FBS(批号:1227693)购于美国GIBCO公司;BCA蛋白定量试剂盒(批号:50510)购于北京康为世纪生物科技有限公司;CPT粉剂(批号:S228530)购于美国Selleck公司,纯度>99%,溶于DMSO中,配制成10mmol/L的储存液,于-20℃保存,使用时稀释至所需浓度。CCK-8(批号:KL773)购于日本同仁化学研究所;Annexin V-FITC/PI凋亡检测试剂盒(批号:2279795)、线粒体膜电位检测试剂盒(JC-1)(批号:5113741)和流式细胞仪(型号:FACS-Cantoll)购于美国BD公司;ECL显色试剂盒(批号:15289A4)购于美国MERCK公司;实验用蛋白检测抗体均购于美国CST公司。CO2培养箱(型号:3111)、生物安全柜(型号:1374)、低温高速离心机(型号:Legend Micro 17R)和多功能酶标仪(型号:Thermo Varioskan Flash)购于美国Thermo公司;倒置荧光显微镜(型号:IX71)购于日本Olympus公司;蛋白电泳仪和转膜仪(型号:PowerpacTMBasic)和凝胶显微成像系统(型号:ChemiDoc XRS System)购于美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养 人肺腺癌细胞株A549和PC-9由本实验室保存,分别使用添加10%FBS的RPMI 1640和高糖DMEM 培养基,置于37℃、5%CO2、饱和湿度条件下培养,每3d换液,取对数生长期细胞用于实验。
1.2.2 CCK-8法检测细胞存活率 收集对数生长期的A549和PC-9细胞分别接种于96孔板,每孔接种50μl细胞悬液,共5 000个细胞。培养12h后,对照组每孔加入含DMSO的培养基50μl,加药组每孔加入含CPT的培养基 50μl,使 CPT 终浓度为 1、2.5、5、7.5、10、15 及20μmol/L,且保证每孔DMSO含量均为0.1%。每组设3个复孔。另设空白对照组,加入100μl培养基用于分析数据时去除背景。不同浓度的CPT分别作用24和48h后,每孔加入CCK-8试剂10μl,继续培养30min,用酶标仪测定在450nm处的吸光度(OD)值。根据OD值计算细胞存活率,细胞存活率=加药组平均值/对照组平均值×100%,利用SPSS 16.0统计软件,求出CPT对细胞50%生长抑制浓度(IC50)。
1.2.3 细胞形态学观察 收集对数生长期的A549和PC-9细胞分别接种于6孔板,每孔接种1ml细胞悬液,共2×105个细胞。培养12h后,对照组每孔加入含DMSO的培养基1ml,加药组每孔加入含CPT的培养基1ml,使CPT终浓度为15μmol/L,且保证每孔DMSO含量均为0.1%。分别于0和24h用光学显微镜观察,在倒置荧光显微镜下照相。
1.2.4 Annexin V-FITC/PI流式细胞术检测细胞凋亡率 根据Annexin V-FITC/PI凋亡检测试剂盒使用说明书进行操作。收集不同处理组细胞,调整待测细胞数为 1×105个/ml,取 1ml于 1 000r/min 离心 5min,弃上清液,用PBS漂洗1次后,加入Annexin V binding buffer 500μl混匀,制成单细胞悬液,再分别加入Annexin VFITC和PI染色液各5μl,轻柔混匀,室温下避光孵育15min,1h内上流式细胞仪检测。
1.2.5 JC-1染色流式细胞术检测线粒体跨膜电位 根据JC-1使用说明书进行操作。收集不同处理组细胞,调整待测细胞数为1×106个/ml,取1ml于1 000r/min离心5min,弃上清液,用PBS漂洗1次后,再加入JC-1溶液500μl混匀,37℃避光孵育 15min,1×Assay buffer漂洗 2次,加入1×Assay buffer 500μl混匀,制成单细胞悬液,上流式细胞仪检测。
1.2.6 凋亡相关蛋白 cleaved Caspase-9、cleaved Caspase-3、聚腺苷酸二磷酸核糖转移酶(poly ADP-ribose polymerase,PARP)和STAT3信号通路相关蛋白磷酸化(p-STAT3)蛋白表达水平检测 采用Western blot法。收集不同处理组细胞,用冰预冷的PBS洗涤2次,根据细胞沉淀量加入适量RIPA细胞裂解液,冰上放置30min,每隔5min振荡1次,4℃下 12 000r/min离心30min,收集上清液,按照BCA法测定蛋白含量。取各组样品等量总蛋白50μg,加入等体积的2×上样缓冲液,振荡混匀,煮沸变性5min,12 000r/min离心1min,取上清液,按预定顺序上样,在10%SDS-PAGE胶上进行电泳,以初始电压60V进行电泳,当蛋白Marker分开后换用100V电泳至胶下缘1cm以上结束。转膜条件为250mA恒流,转膜时间为100min,使用PVDF膜,5%脱脂牛奶室温下封闭2h,一抗4℃孵育过夜,1×TBST缓冲液洗膜3次,每次5min,加入辣根过氧化物酶偶联的二抗(1∶1 000),室温孵育 2h,弃二抗,1×TBST 缓冲液洗膜3次,每次5min,膜上滴加底物发光的ECL显影液,孵育后用ChemiDoc XRS化学发光成像系统进行检测。
1.3 统计学处理 采用SPSS 16.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。<斜体> P斜体<0.05为差异有统计学意义。每个实验均重复3次。
2 结果
2.1 CPT对A549和PC-9细胞存活率的影响 CCK-8法检测结果显示CPT可强烈抑制A549和PC-9细胞的增殖,该作用呈浓度和时间依赖性,见图1。A549细胞24 和 48h 的 IC50值分别为 8.915(95%CI:5.333~11.799)和 6.625(95%CI:4.337~8.478)μmol/L,PC-9 细胞 24 和48h 的 IC50值分别为 6.995(95%CI:4.815~8.794)和3.836(95%CI:2.015~5.246)μmol/L。在 A549细胞中,2.5、5、7.5、10、15、20μmol/L 的 CPT 作用 24h 的细胞存活率与对照组(0μmol/L)比较,差异均有统计学意义(均P<0.05);不同浓度的CPT作用48h的细胞存活率与对照组(0 μmol/L)比较,差异均有统计学意义(均P<0.05),见图1a。在PC-9细胞中,不同浓度的CPT作用24和48h的细胞存活率与对照组(0μmol/L)比较,差异均有统计学意义(均P<0.05),见图 1b。不同细胞株对CPT的敏感性存在显著差异,A549细胞的存活率高于PC-9细胞,差异均有统计学意义(均P<0.05)。

图1 CPT对A549和PC-9细胞存活率的影响(a:CPT对A549细胞存活率的影响;b:CPT对PC-9细胞存活率的影响;与对照组比较,*P<0.05)
2.2 CPT对A549和PC-9细胞形态的影响 15μmol/L CPT作用于A549和PC-9细胞24h后,细胞出现明显的凋亡现象:数量明显减少,胞体变圆、缩小。
2.3 CPT对A549和PC-9细胞凋亡的影响 与对照组比较,CPT作用24h对A549和PC-9细胞均有显著的诱导凋亡作用。在A549细胞中,7.5、10和15μmol/L CPT 组的细胞凋亡率分别为(14.04±0.16)%、(35.43±0.40)% 和(41.50±0.57)%,明显高于对照组的(6.84±0.20)%,差异均有统计学意义(均P<0.05);在 PC-9细胞中,7.5、10和15μmol/L CPT组的细胞凋亡率分别为(16.07±0.22)%、(22.09±0.18)%和(30.61±0.67)%,明显高于对照组的(5.08±0.17)%,差异均有统计学意义(均P<0.05),见图 2。
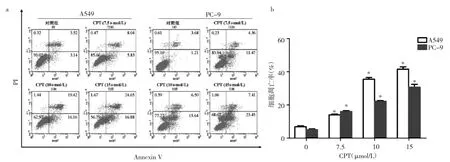
图2 CPT对A549和PC-9细胞凋亡的影响(a:各组细胞凋亡流式细胞图;b:各组细胞凋亡率;与对照组比较,*P<0.05)
2.4 CPT对A549和PC-9细胞线粒体跨膜电位的影响 与对照组比较,CPT均能降低A549和PC-9细胞的线粒体跨膜电位。15μmol/L CPT作用于A549和PC-9细胞24h后,线粒体跨膜电位分别为(54.56±0.51)%和(32.25±0.42)%,分别低于对照组的(84.42±0.56)%和(92.52±0.56)%,差异均有统计学意义(均P<0.05),见图3。
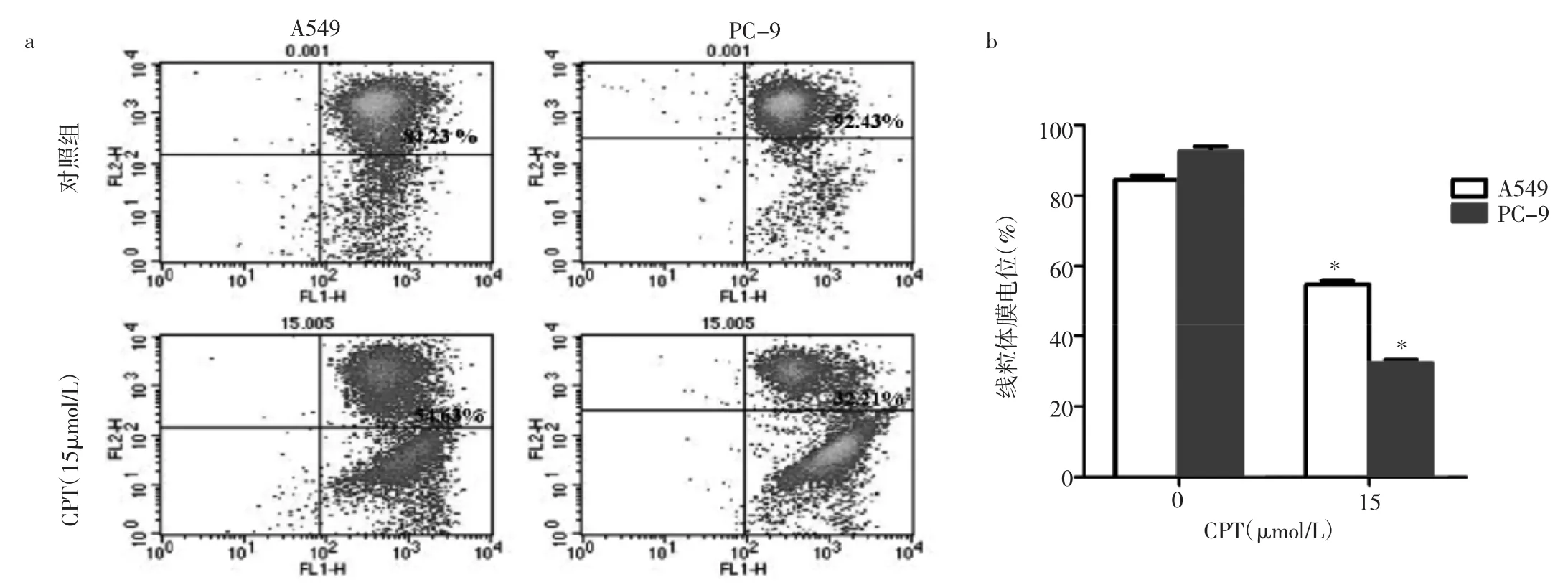
图3 CPT对A549和PC-9细胞线粒体膜电位的影响(a:各组细胞线粒体膜电位流式细胞图;b:各组细胞线粒体膜电位;与对照组比较,*P<0.05)
2.5 CPT对A549和PC-9细胞中Caspase凋亡通路的影响 7.5μmol/L CPT作用于A549和PC-9细胞24h后,可观察到cleaved Caspase-9、cleaved Caspase-3和cleaved PARP蛋白的表达。同时随着CPT浓度的增加,2株细胞中 cleaved Caspase-9、cleaved Caspase-3和cleaved PARP蛋白表达水平明显增加,与对照组比较,差异均有统计学意义(均P<0.05),表明此时细胞中Caspase凋亡通路已被激活,见图4。
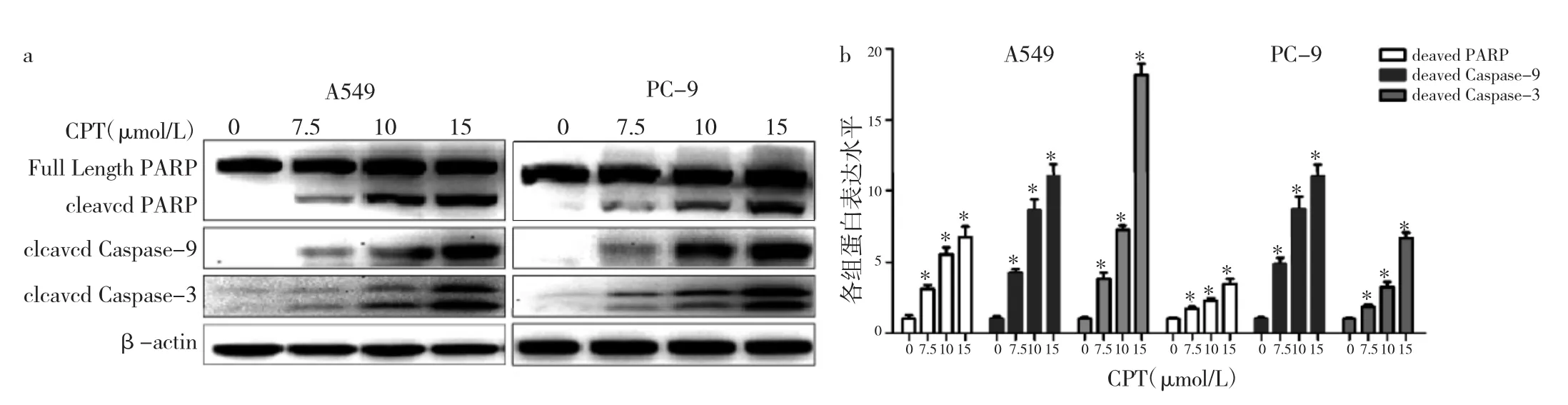
图4 CPT对A549和PC-9细胞Caspase凋亡通路的影响(a:各组细胞cleaved Caspase-9、cleaved Caspase-3和cleaved PARP蛋白表达电泳图;b:各组细胞cleaved Caspase-9、cleaved Caspase-3和cleaved PARP蛋白表达水平;与对照组比较,*P<0.05)
2.6 CPT对A549和PC-9细胞中STAT3通路的影响经不同浓度的CPT处理24h后,A549和PC-9细胞中p-STAT3蛋白表达水平下降,且在PC-9细胞中呈剂量依赖性,与对照组比较,差异均有统计学意义(均P<0.05),见图 5。
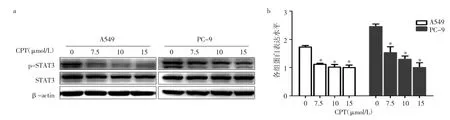
图5 CPT对A549和PC-9细胞中STAT3信号通路的影响(a:各组细胞p-STAT3蛋白表达电泳图;b:各组细胞p-STAT3蛋白表达水平;与对照组比较,*P<0.05)
3 讨论
CPT作为丹参的主要活性成分之一,具有显著的抗肿瘤作用[11],但是对肺腺癌的作用研究甚少。本研究中,CCK-8结果证实CPT能够抑制肺腺癌细胞A549和PC-9的增殖,并呈剂量和时间依赖性,提示CPT具有较强的抗肺腺癌的活性。
大多数药物抗肿瘤作用的机制主要是通过诱导肿瘤细胞发生凋亡来实现的[12-16]。本研究中,CPT处理A549和PC-9细胞后,细胞数量明显减少、胞体变圆、缩小,是典型的凋亡现象;同时,利用Annexin V-FITC/PI流式细胞术检测细胞凋亡,证实CPT可有效地诱导A549和PC-9细胞发生凋亡,该结果与先前CPT诱导其他肿瘤细胞发生凋亡的研究结果相似,提示CPT通过诱导肺腺癌细胞凋亡从而实现其细胞毒作用。
目前认为细胞凋亡信号转导通路主要包括3种:内源性途径(又称线粒体凋亡途径)、外源性途径(又称死亡受体凋亡途径)和内质网途径。Ye等[8]发现CPT能够显著减少活性氧的产生,增加Bax和cleaved Caspase-3蛋白的表达,降低B淋巴细胞瘤-2(Bcl-2)蛋白的表达,最终诱导黑色素瘤细胞A375线粒体途径的凋亡。Park等[17]研究证实,CPT通过阻止JNK和p38的激活,从而降低Bcl-2蛋白的表达,随后引发前列腺癌细胞DU145死亡受体凋亡途径的凋亡。本研究从与线粒体凋亡途径密切相关的线粒体跨膜电位、下游的Caspase凋亡通路相关蛋白等方面入手,对CPT诱导肺腺癌细胞凋亡的机制进行了初步探讨。实验结果表明,将CPT作用于A549和PC-9细胞后,线粒体跨膜电位降低,cleaved Caspase-9、cleaved Caspase-3 和 cleaved PARP蛋白表达水平明显增加,且呈剂量依赖性。由此可见,CPT诱导肺腺癌细胞发生凋亡的机制可能与线粒体凋亡途径有关。
STAT3在许多肿瘤细胞中存在持续激活,并在肿瘤的起始与进展中发挥重要作用[18]。STAT3信号通路的异常激活与肿瘤的增殖、细胞凋亡抑制、侵袭和转移、新血管生成以及肿瘤干细胞的自我更新和分化等密切相关,被认为是一种原癌基因[19-20]。有证据表明抑制STAT3的活性可能是一个理想的药物靶点。索拉菲尼通过抑制STAT3信号通路的激活,进而增强TNF相关凋亡诱导配体在胰腺癌细胞中的凋亡诱导作用[21]。CPT通过阻止STAT3信号通路的激活,抑制结肠癌和肾细胞癌细胞的生长,并且诱导其发生凋亡,证明CPT是一种有效的STAT3抑制剂[22-23]。本研究发现CPT可减少A549和PC-9细胞中p-STAT3蛋白表达,且在PC-9细胞中呈剂量依赖性,表明STAT3信号通路的抑制可能参与了CPT诱导的A549和PC-9细胞凋亡的过程。
综上所述,CPT在体外可显著抑制A549和PC-9细胞的增殖,并可以诱导细胞凋亡,其机制可能与线粒体凋亡途径以及STAT3信号通路相关,这些为CPT在肺腺癌治疗中的应用提供了分子基础和理论依据。
