局部晚期分化型甲状腺癌多学科临床讨论*
2019-02-21张成瑶汤喜李倩邓婕龙建林周晓红
张成瑶 汤喜 李倩 邓婕 龙建林 周晓红
甲状腺癌(thyroid cancer,TC)是头颈部发病率最高的恶性肿瘤,也是近年来发病率增长最快的实体肿瘤,2018年全球甲状腺癌发病率为10.2/10万例,占女性新发肿瘤的第5 位[1]。分化型甲状腺癌(differentiated thyroid cancer,DTC)包括甲状腺乳头状癌(papillary thyroid cancer,PTC)、甲状腺滤泡癌(follicular thyroid cancer,FTC),占甲状腺癌的90%以上,大多数患者预后良好。虽然甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)在确诊的甲状腺癌中所占权重最大,增长速度最快,但晚期甲状腺癌患者的数量并未明显减少。由于颈前区解剖结构复杂,重要器官多,局部晚期甲状腺癌易侵犯邻近喉、气管、下咽部和食管等。据报道[2]7%~13%的患者出现喉和气管侵犯,初期无临床表现,伴随腔内突破出现声音嘶哑、气道阻塞、吞咽困难及肿瘤出血导致窒息等严重并发症。近10年来,晚期甲状腺癌患者的死亡率趋于平稳,主要归功于甲状腺癌多学科综合治疗模式的推广和应用[3]。本研究旨在探讨局部晚期甲状腺癌患者的规范化及个体化治疗,分享多学科协作体系(multi-disciplinary treatment,MDT)诊治经验。
1 材料与方法
1.1 临床资料
患者,男性,54岁。因甲状腺癌术后1年,再发右颈部肿物6个月于2018年4月就诊于重庆大学附属肿瘤医院头颈肿瘤中心。2017年4月患者因发现颈部肿物伴吞咽疼痛2周于外院就诊,住院期间检查颈部彩超及超声造影示:1)甲状腺左右叶占位性病变,内见点状钙化,TI-RADS分类为5类;2)甲状腺左叶囊性占位,TIRADS分类为2类;3)双颈部异常回声(肿大淋巴结),位于双侧颈部Ⅳ区、右颈部Ⅵ区转移可能。甲状腺ECT示:甲状腺肿大,血供正常,双叶凉结节,有血供,结合图像融合,不排除恶变可能。喉镜示:双侧声带运动及闭合好。术前诊断甲状腺癌,行甲状腺全切术+双侧(Ⅱ、Ⅲ、Ⅳ、Ⅵ区)颈淋巴结清扫术。术后病理示:双侧甲状腺乳头状癌;(喉前淋巴结)甲状腺乳头状癌;(喉返神经后方、右颈Ⅱ区、左颈Ⅱ区)淋巴结见癌转移(分别为1/5、3/13、2/6);(气管前、右颈Ⅲ区、右颈Ⅳ区、左颈Ⅲ区、左颈Ⅵ区)淋巴结未见癌转移(分别为0/2、0/3、0/2、0/5、0/3)。术后分别于2017年5月和12月行2次131I治疗,剂量均为120 mCi。131I潴留显像:残余甲状腺影已基本清除,颈外未见异常放射性凝聚影(图1A)。辅助以每175 μg甲状腺素片进行TSH抑制治疗。2018年3月因甲状腺癌术后1年,发现右颈部肿物2个月于外院就诊。颈部增强CT示:右侧甲状软骨旁、右胸锁乳突肌前方及邻近右侧颈动脉鞘周围多发淋巴结肿大,考虑转移,病灶与周围肌肉分界不清。行右颈淋巴结(Ⅱ、Ⅲ区)清扫术。术后病理示:符合甲状腺乳头状癌,局部淋巴结转移癌(10/52)。术后继续辅以每175μg甲状腺素片TSH抑制治疗。2018年4月患者因甲状腺癌术后1年,再发右颈部肿物6个月于本院就诊。体检:颈前区偏右见肿物,约5~6 cm,侵犯表面皮肤,质硬,不活动。双侧颈部扪及多发淋巴结肿大。患者声嘶不明显,无吞咽困难及饮水呛咳等表现。甲状腺彩超示:气管右前方异常回声,颈部气管前淋巴结肿大,左颈、右颈上份、双颌下淋巴结肿大。性质待定:可疑淋巴结转移,病灶复发待排除(图2A)。颈部增强CT示:甲状腺缺如,甲状腺区域多发结节及肿块影,考虑复发可能。右侧甲状软骨骨质破坏;右侧颈鞘区、右侧颌下多枚淋巴结显示,考虑转移可能(图2B)。胃镜示:1)食管上段静脉显露,建议随访;2)十二指肠球部食物潴留;3)慢性非萎缩性胃炎。患者病程中甲状腺球蛋白(thyroglobulin,Tg)值变化情况见图3。
1.2 治疗方法
根据患者病程、实验室和影像学检查,诊断为甲状腺乳头状癌术后复发(rT4aN1bM0,ⅣA 期)。经MDT讨论后予以:1)行甲状腺肿瘤扩大切除+全喉切除+气管环状切除+下咽吻合+气管造瘘+胸大肌皮瓣修复手术(图4A~4D);2)术后辅助进行131I 治疗;3)进行分子靶向药物基因检测,可予以辅助分子靶向药物治疗准备;4)继续进行TSH抑制治疗;5)监测随访甲状腺球蛋白变化。
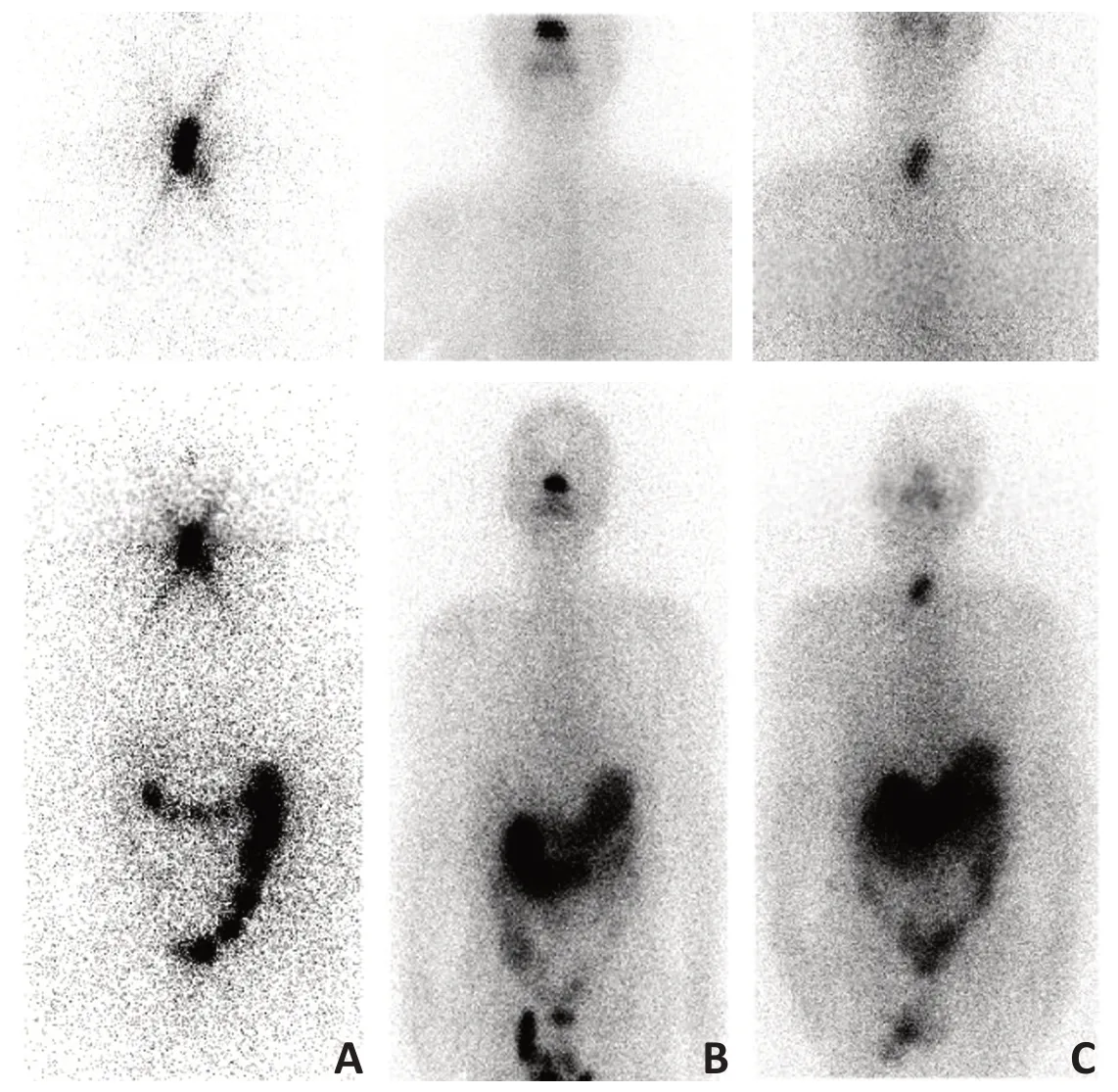
图1 本例患者分别进行3次131I治疗后行甲状腺潴留显像图像
2 结果
患者手术治疗随访18个月恢复良好,术后病理示:(右颈部肿物)转移性甲状腺乳头状癌(3/3),喉软骨见癌侵犯,脉管癌栓(+)。术后甲状腺潴留显像可见颈部淋巴结伴有放射性浓聚,患者于2018年6月行第3次131I治疗,剂量为220 mCi(图1C)。进行基因检测提示VEGF2高表达,BRAF V600E突变,Ret野生型无融合。患者进行索拉菲尼治疗,目前随访未见复发(图4E),随访Tg缓慢下降。

图2 本例患者在本院进行术前颈部超声(A)、颈部增强CT(B)及胃镜检查(C)
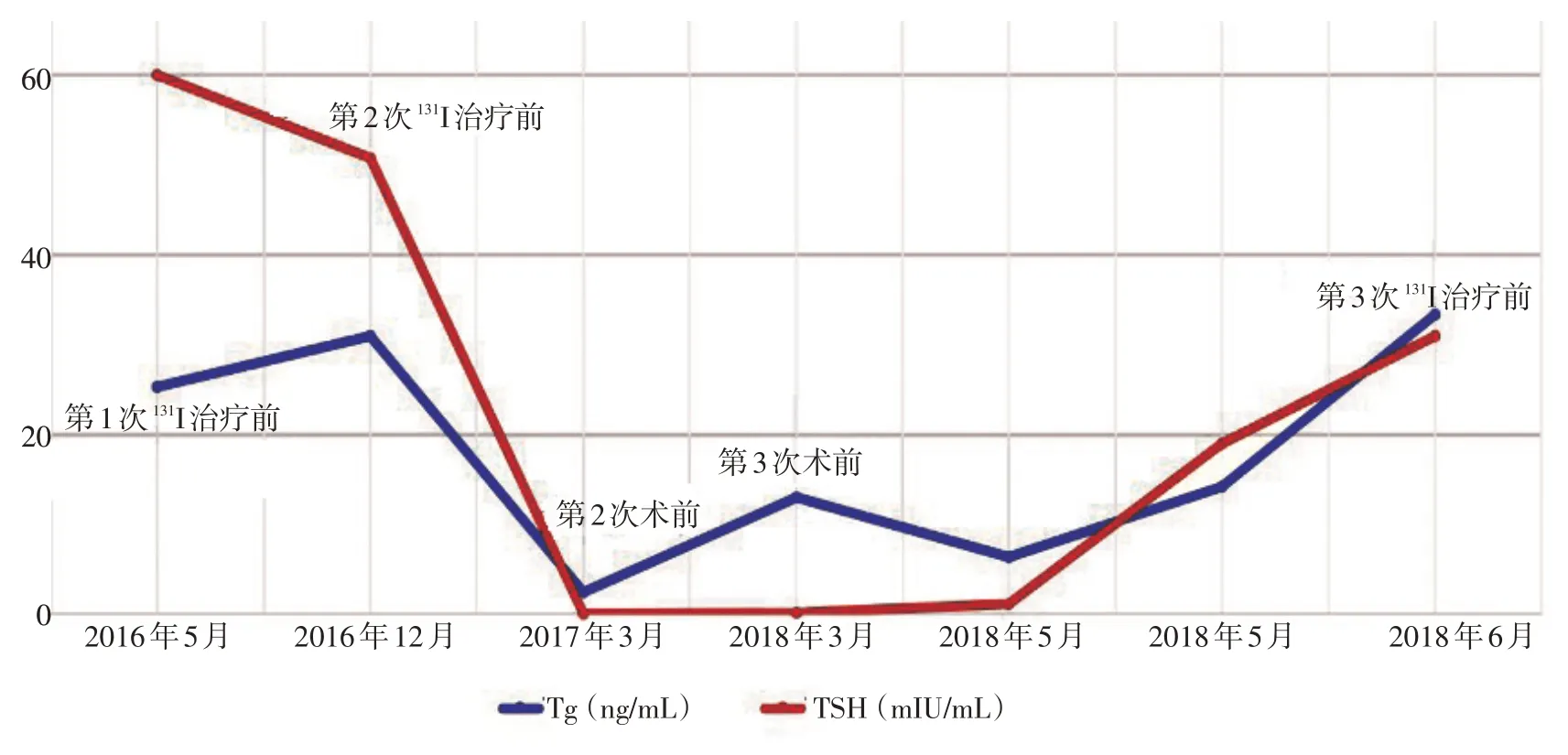
图3 本例患者病程中监测TSH和Tg动态变化

图4 本例患者在本院治疗术前(A)、术中(B)、标本正背面(C)、术后1周(D)、术后1年(E)情况
3 讨论
局部晚期DTC 出现侵犯周围组织器官导致梗阻、出血和呼吸困难等并发症,是甲状腺癌的主要死亡原因。MDT模式被广泛应用于甲状腺肿瘤的综合治疗并取得良好的效果。因为大部分局部晚期甲状腺癌需要制定个体化的治疗方案,目前在国际上并无相应的诊疗指南进行参考。个体化精准治疗也是复杂的恶性肿瘤诊疗发展趋势,开展MDT 有利于充分权衡疗效和评估治疗风险。MDT模式的诊疗优势不仅体现在制定治疗方案的个性化和合理化,更体现在患者术后的长期管理和随访,从而使患者获益。
头颈外科:由于DTC肿瘤进展缓慢,治疗策略不尽相同,对于复发或术后残存肿瘤的定义在临床中很难明确界定。随着甲状腺癌诊治技术的发展,学者们关注的预后焦点从DTC患者的死亡风险逐渐转变为复发风险的分层,早期根据不同的复发风险分层制定相应的治疗方案。2009年美国甲状腺学会(American Thyroid Association,ATA)指南中第一次提出DTC的复发风险分层概念[4],该分层主要包括手术中肿瘤清除情况、病理亚型、包膜及血管侵犯程度、淋巴结转移、远处转移、131I治疗后全身显像(131I posttreatment whole body scan,Rx-WBS)、甲状腺癌家族史等权重因素[5]。2012年我国甲状腺结节和分化型甲状腺癌诊治指南中,在DTC 的风险评估中再次强调了复发风险分层及其重要性[6],并建议对所有DTC患者进行术后TNM分期和复发危险度低、中、高危分层(表1)。2015年的ATA指南在2009年对甲状腺癌危险分层的基础上进行修订,增加了淋巴结受累程度、基因突变、血管侵犯及包膜外侵犯等指标[7]。本例患者在第1次术后的复发风险度属于中危分层,直至本院就诊,复发风险度升级为高危分层。此时选择合适的治疗方案对于延长生存期及提高生存质量尤为重要。
结合我国2015年发布的复发转移性分化型甲状腺癌诊治共识有关于复发转移性DTC的综合治疗方案推荐中强调,手术切除仍然作为首选治疗方案,还可以依次对可摄取131I 的病灶行131I 治疗、外照射治疗、L-T4 抑制治疗下的随诊观察、试验性治疗(如靶向药物、射频消融及经皮超声引导乙醇注射)等[8]。结合本例患者病情,选择根治手术治疗是首选。考虑患者已有2次手术史,复发后的手术切除范围不仅需包括原手术野的甲状腺床区和颈部转移灶,还需一并切除受复发肿瘤侵犯的甲状软骨及咽喉区域。该手术计划的难点之一在于原手术区域的广泛瘢痕化和解剖结构的紊乱,使手术时永久性甲状旁腺功能低下、永久性喉返神经损伤的发生率均明显升高[9],大幅增加手术难度。另一个亟待解决的关键问题是同期的修复重建,因患者的颈部皮肤、甲状软骨以及咽喉部均受累,根治手术后需要结合稳定可靠的修复手段。在制定手术方案时,需同时在手术风险和手术获益中权衡利弊。甲状旁腺原位血管化保留及自体移植技术、喉返神经自体移植和修复技术以及游离皮瓣修复技术的不断提高和进步为甲状腺外科的功能修复重建保驾护航。外科手术需要甲状腺外科、耳鼻咽喉科、口腔颌面肿瘤修复、整形外科以及ICU等多学科共同协作完成。
结合本例患者病情,制定“甲状腺肿瘤扩大切除+全喉切除+气管环状切除+下咽吻合+气管造瘘+胸大肌皮瓣修复”的手术方案。该手术方式包括复发肿瘤及转移灶,包括喉的根治性切除和同期修复重建。术前进行增强CT 或MRI 的评估,一定程度可以明确肿瘤的大小和手术切除的范围,但不能准确评估肿瘤侵犯的程度。故在CT或MRI显示邻近软骨侵犯、声带或下咽部受累时,提示外科医生需进行全喉切除。有研究[10]提出局部晚期甲状腺癌出现喉部侵袭的两种途径:一种是原发肿瘤局部直接浸润,另一种是通过转移淋巴结包膜外的扩散。本例患者的术前CT提示同时存在甲状软骨骨质破坏和颈鞘区颌下区多发淋巴结转移,考虑两种转移途径共存。Bal⁃lantyne等[11]报道32例局部晚期甲状腺癌进行全喉切除手术(27例全喉切除术和5例咽喉切除术),也是迄今局部晚期甲状腺癌进行全喉切除术纳入病例数最多的研究。仅1 例患者出现术后死亡,2 例出现颈动脉爆裂和5 例瘘管保守治疗,9 例患者在随访期间出现局部复发,5年生存率约75%。Gaissert 等[12]报道82例甲状腺癌患者中13例行全喉切除术或喉咽切除术,完全切除率为61%,平均生存期5.5年,5年总生存率为38%。而Chala 等[13]在16 例局部晚期甲状腺癌伴有喉侵犯的患者中,除全甲状腺切除术和颈部淋巴结清扫术外,4 例患者行全咽切除术,11 例全喉切除术和1例半喉切除术。术后死亡2例,吻合口漏2 例,保守治疗;平均总生存期(31±33)个月,中位生存期27.6个月。喉切除术为控制晚期甲状腺癌的发展提供了良好的局部控制和长期生存率。在肉眼可见喉浸润或广泛喉侵犯的情况下,部分或全部喉切除术是理想的手术方式。该手术不仅完全切除肿瘤,还可以缓解因阻塞和出血症状导致的窒息和死亡。
由于局部晚期甲状腺癌患者的组织类型、临床分期、既往治疗史均不同,很难给出标准统一的手术方案。结合2016年美国头颈学会(American Head and Neck Society,AHNS)发布的复发性甲状腺癌的综合治疗共识声明,全喉切除、咽切除或部分食管切除仅应用于少数患者,需要技术成熟的头颈外科医生完成,并建议在后续治疗中增加照射治疗[14]。

表1 分化型甲状腺癌(DTC)的复发危险度分层及初始TSH抑制目标(ATA)
核医学科:对甲状腺癌术后放射性碘治疗(radio⁃active iodine,RAI)应用的剂量,指南建议使用量处于逐渐减少的趋势[15]。在权衡RAI 剂量时一定要同时考虑治疗效果的保障和不良反应的积累。2015年有研究发现低剂量RAI 在保证“清甲”成功率的同时具有更低的不良反应发生率[16]。同年郑立春等[17]提出,低剂量(30 mCi)和高剂量(100 mCi)RAI 对于ps-Tg 较低(≤5 ng/mL)且不伴有远处转移的DTC 患者,其“清甲”和无病生存情况均无显著性差异,该结果为低剂量RAI 治疗前评估中低ps-Tg 患者的“清甲”治疗提供了循证证据,不仅可以降低131I辐射剂量,也能减少治疗所致的相关不良反应。但对于手术治疗不充分或复发转移的患者,选择高剂量的RAI 更合适。在2015年复发转移性分化型甲状腺癌诊治共识中,对单次131I“清灶”治疗的剂量尚有争议。根据临床医生的经验,建议治疗剂量为3.7~7.4 GBq(100~200 mCi)[8]。2017年第2版NCCN甲状腺肿瘤指南也指出,若为放射性碘聚集的肿瘤,应行剂量为100~200 mCi 的RAI 治疗或通过放射量测定而调整剂量,在治疗后进行全身放射性碘成像,并在完成RAI治疗后继续进行左旋甲状腺素抑制性治疗[18]。
本例患者在进行第1次甲状腺全切手术后,病理证实为甲状腺乳头状癌伴有双侧颈淋巴结转移(右颈Ⅲ区+左颈Ⅱ区)。该患者符合术后进行RAI治疗的适应证,并分别进行了剂量为120 mCi的131I“清甲”和“清灶”治疗。治疗后131I潴留显像提示甲状腺床及颈部均未见明显吸收病灶。在第3次根治手术后尝试131I治疗。结合目前指南及专家共识,选择220 mCi剂量。ATA指南中关于DTC患者的复发危险度分层对进行RAI治疗同样具有重要的临床指导意义。本例患者肿瘤复发时评估处于高危风险分层,且已经有240 mCi的RAI治疗史。一项基于监测、流行病学和最终结局(surveillance,epidemiology,and results,SEER)数据库包括14 545例DTC患者的研究[19]表明,对于高危人群(年龄>45岁、肿瘤直径>2 cm且伴有淋巴结转移及远处转移)经过RAI后,其总生存明显提高(P<0.05)。分子特征纳入复发风险分层的评估条件,分子特征与转移灶摄碘能力的关系也受到关注。有研究表明BRAF V600E基因突变组的远处转移灶摄碘率明显低于BRAF V600E基因野生组(15.8%vs.94.4%),结果表明出现BRAF V600E基因突变的患者更易出现远处转移病灶不摄碘,其RAI疗效较差,也会伴随血清Tg水平无明显下降甚至出现升高的情况[20]。分子特征与转移灶摄碘能力的相关性可能协助RAI前预判断远处转移灶的碘难治性可能。
肿瘤内科:众所周知,TSH抑制治疗在甲状腺癌术后辅助治疗中的重要价值。术后及时的TSH抑制治疗不仅可以补充缺失的甲状腺激素,更重要的是减少DTC的复发。有关TSH抑制标准,在我国2012年专家共识中根据患者的双风险(肿瘤复发风险和抑制治疗不良反应风险)制定了相应的TSH治疗目标[6](表2),随后在2015年ATA指南中也根据复发风险度制定了初始TSH抑制治疗目标。针对复发和转移性甲状腺癌患者经再次治疗干预后的TSH抑制治疗,则需要依据动态评估及风险分层进行相应的调整[8]。
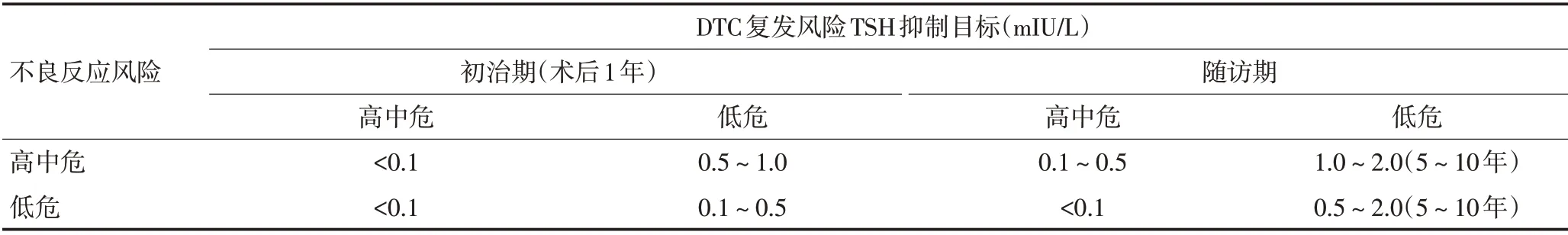
表2 DTC患者术后TSH抑制治疗目标
近10年甲状腺癌分子诊断技术迅速发展,从最初的RAS 和RET/PTC 两种甲状腺癌突变基因,截至目前发现了几乎90%以上的甲状腺癌相关基因。目前相关研究聚焦在RAS、RET/PTC、TP53、TERT、PTEN、BRAF、PIK3CA等近20种突变基因。BRAF作为评估甲状腺癌预后的最常见标志物,同时可辅助指导RAI 和TSH 抑制治疗。索拉非尼已经成为国内首个用于治疗晚期DTC 的靶向药物,乐伐替尼也正在进行放射性碘难治性DTC的Ⅲ期临床试验。考虑本例患者经过3 次手术治疗和RAI 后处于高复发风险分层,仍建议在TSH治疗并严密监测的同时,辅助分子靶向药物控制肿瘤发展。
虽然局部晚期DTC的综合治疗方式目前国际上尚无统一的指南,但我国学者在该领域进行的大量工作和提出的部分治疗理念为推动国际甲状腺癌规范化诊疗做出卓越的贡献,其中包括2012年中国甲状腺结节和分化型甲状腺癌诊治指南、2015年复发转移性分化型甲状腺癌诊治共识、2016年中国甲状腺微小乳头状癌诊断与治疗专家共识、2017年甲状腺癌血清标志物临床应用专家共识等相关指南和共识。对于复杂棘手的晚期DTC 患者的治疗,临床医生可以做到有据可依,有的放矢。
