单核细胞/高密度脂蛋白胆固醇比值对老年急性STEMI患者术后新发心房颤动的预测价值
2019-02-21李贝贝金至赓贾小伟刘惠亮
李贝贝,金至赓,李 屹,张 蛟,贾小伟,刘惠亮
目前,冠心病已成为严重威胁人类生命健康的主要疾病之一,ST段抬高型心肌梗死( ST segment elevation myocardial infarction, STEMI) 是常见的冠心病类型。大多数STEMI是在冠状动脉粥样硬化不稳定斑块破裂、糜烂及内皮损伤基础上,继发血栓形成,导致冠状动脉急性、持续、完全闭塞,血供急剧减少或中断,从而导致心肌细胞缺血坏死。虽然直接经皮冠状动脉介入治疗通过迅速恢复血管通畅,能够较好地治疗STEMI,但是由于冠状动脉的急性闭塞,心肌细胞缺血坏死,降低心肌收缩力,导致多种并发症出现。其中,术后新发心房颤动(new-onset atrial fibrillation,NOAF)是急性STEMI后一种较常见的心律失常。研究报道,老年急性STEMI术后NOAF的患者发生脑卒中的风险及住院期间病死率明显高于无NOAF发生的患者,因此临床上急需提高早期识别和预测此类高危患者的能力[1]。目前,急性STEMI术后房颤的可能危险因素尚未得到充分探索,有学者认为,MHR与全身性炎性反应和内皮功能障碍有关,是心血管疾病中新近公认的基于炎性反应的诊断和预后标志物[2,3]。目前,关于MHR与老年急性STEMI后NOAF的相关性报道较少,本研究旨在探讨MHR对老年急性STEMI患者PCI术后NOAF的预测价值。
1 资料与方法
1.1 一般资料 回顾性收集了原武警总医院(解放军总医院第三医学中心)2012-01至2018-06收治的181例急性STEMI患者的临床资料,按照住院7 d内是否发生NOAF分为房颤组和非房颤组。(1)纳入标准:①年龄≥60岁,且STEMI发病时间≤24 h。STEMI的诊断标准均参照中华医学会2010年制定的《急性ST段抬高型心肌梗死诊断和治疗指南》。②术后NOAF指患者既往无房颤病史(包括阵发、持续和永久性房颤),PCI术后住院7 d内通过心电图检查或心电监护装置首次发现的房颤。(2)排除标准:①严重肝肾功能不全、先天性心脏病及瓣膜病、心源性休克、脑梗死、慢性房颤、恶性肿瘤、血液增生性疾病、活动性肝胆疾病、甲状腺疾病、活动性感染;②慢性炎性疾病或接受自身免疫性疾病类固醇激素治疗的患者,以及接受他汀类药物治疗的患者;③PCI术前未记录入院实验室参数测量值的患者。
1.2 观察指标 通过病案检索系统查询患者的住院病历,相关资料包括: (1)临床特征。性别、年龄、入院时心率、糖尿病史、高血压史等。(2)血液检测指标。患者入院后即刻抽取静脉血检测血常规,收集全自动生化分析仪检测的三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等值。通过单核细胞计数除以高密度脂蛋白值计算得出MHR值。(3)心脏超声检查指标。如左室射血分数(LVEF)、左心房前后径(LAD)均是由专业人员于患者入院48 h内采用飞利浦公司生产的型号 HD11 心脏超声仪测定而得。
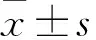
表示,组间比较采用独立样本t检验;计数资料采用百分率和构成比表示,组间比较采用χ2检验;采用Logistic多因素回归分析急性STEMI术后NOAF的危险因素,并以受试者工作特征(ROC)曲线描述MHR对STEMI患者术后发生房颤的预测价值。P<0.05为差异具有统计学意义。
2 结 果
2.1 一般资料比较 181例老年急性STEMI患者于住院7 d内发生NOAF 31例(17.1%)。房颤组的年龄、入院时心率、单核细胞数、MHR、LAD均显著高于非房颤组(P均<0.05);而房颤组中的TC、LDL-C、HDL-C、LVEF显著低于非房颤组(表1,P均<0.05)。
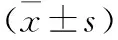
表1 两组老年急性STEMI患者一般资料比较
2.2 多因素Logistic回归分析房颤独立预测因素 以是否发生NOAF为应变量,以年龄、性别、高血压、糖尿病、入院心率、TG、TC、HDL-C、LDL-C、MHR、LAD、单核细胞数等危险因素为自变量进行logistic逐步回归分析,最后进入模型的因素是入院心率、MHR、LAD(P<0.01,表2)。

表2 老年急性STEMI患者以是否发生房颤为因变量进行Logistic回归分析结果
2.3 ROC曲线分析 应用ROC曲线分析MHR对老年STEMI患者术后NOAF的预测价值,分析得出,对于房颤患者的MHR最佳切点值为15.81,预测的敏感性为81.8%,特异性为90.3%,ROC曲线下面积为0.923(95%CI:0.859~0.987;P<0.01,图1)。

图1 急性STEMI术后新发房颤患者的单核细胞/高密度脂蛋白胆固醇比值的受试者工作特征曲线
3 讨 论
临床一直致力于评估炎性反应和氧化应激在房颤起始、持续和复发中的作用,在此过程中产生多种细胞因子,而单核细胞和巨噬细胞是促炎因子的最重要来源,单核细胞活化黏附在内皮细胞表面然后外渗到损伤组织诱导肿瘤坏死因子TNF-α、白介素IL-1、IL-6等多种因子产生[4,5]。炎性部位的促氧化细胞因子会导致心房电生理紊乱和结构重塑,心房基质底物修饰重塑,增加了房颤易感性[6,7]。同时有研究报道,单核细胞聚集和高密度脂蛋白胆固醇减少可能通过释放活化物质,如氧自由基、蛋白酶、促炎细胞因子等参与心房重塑[7]。病理学研究发现,AF患者的心房中存在巨噬细胞炎性斑块状浸润,Fontes等[9]报道,术后房颤中出现了单核细胞活化,循环中单核细胞的长半衰期及其分化为巨噬细胞的能力可能在导致房颤的炎性反应中发挥了作用。血脂异常是心血管疾病的传统危险因素,高密度脂蛋白胆固醇具有抗炎、抗氧化和抗血栓作用[10,11]。Annoura等[12]报道,高密度脂蛋白低值患者的阵发性房颤患病风险是高密度脂蛋白高值患者的9.4倍,HDL胆固醇低值通过影响反向胆固醇运输导致心房肌细胞的异常,间接导致抗炎和抗氧化作用的降低,这可能与NOAF发生有一定的关系。
Kanbay等[13]首先提出了MHR这一概念,并发现慢性肾脏病患者中MHR较高的患者心血管预后较差。Canpolat等[14]研究发现,MHR结合了炎性反应和氧化应激这两种有害过程,是房颤导管消融术后复发的独立预测因子,其中不仅是单核细胞计数和血液中高密度脂蛋白胆固醇水平的数值变化发挥了一定作用,同时单核细胞的激活和高密度脂蛋白胆固醇颗粒的分子变化也可能对MHR预测能力有贡献。MHR能够预测STEMI 患者 PCI 术后的短期及长期死亡风险、住院期间心脏主要不良心血管事件(MACE)、卒中及靶血管重构等[15]。
急性STEMI术后NOAF具有较高的发生率。Schmitt等[6]报道,急性STEMI后住院期间NOAF的发生率达6%~21%。本研究中,181例STEMI中有31例术后7 d内发生NOAF,发生率为17.1%。研究表明NOAF常发生在急性STEMI后72 h内[16]。STEMIPCI术后发生NOAF时,由于心房泵血功能基本消失,可导致心排血量显著减少,使心脏及全身缺氧状态恶化,患者近期和远期预后不良[17]。因此寻找高度敏感特异的实验室指标,对于临床上早期识别STEMI术后NOAF的高危患者,并进行早期干预防治相关并发症具有重要的意义。而MHR作为一种综合新型炎性指标,较单一指标更具有优势,可通过血常规等常规检测项目计算得到,操作简单,廉价,在不同级别的医院均可开展,对心血管疾病的发生发展及预后有较高的预测价值。
基于上述研究,我们设想单核细胞计数及MHR与STEMI术后NOAF相关。本研究发现,MHR是老年STEMI患者术后NOAF的独立危险因素。另外,入院心率、LAD也是老年STEMI患者术后NOAF的独立危险因素。这与文献[18]报道结果相一致。通过绘制STEMI患者MHR的受试者工作特征(ROC)曲线,得出:MHR对STEMI患者术后房颤有一定的预测能力,AUC曲线下面积为0.923(95%CI:0.859~0.987;P<0.01)。在我们的ROC分析中,临界值与Ulus等[19]的研究报告一致,但是AUC值及其特异性与敏感性均高于Ulus的研究(临界值15.87,AUC 0.750,敏感性 75.9,特异性65.0),这可能是因本研究对象为STEMI患者,是ACS患者的特殊类型,或者是样本选择差异的原因,研究结果表明该参数对STEMI术后NOAF的预测能力较好。
本研究存在一些局限性:(1)本研究为单中心分析,样本量较小,尚需多中心的、大样本研究来证实MHR在STEMI患者术后房颤中的预测价值;(2)本研究中MHR仅为一次的测量值,并没有排除一些因急性心血管事件导致的机体应激引起的一些异常值。
综上所述,STEMI患者入院时的MHR水平与术后NOAF密切相关,MHR是STEMI患者术后NOAF的独立危险因素。
